不同采集时间和不同干燥处理方法获取红松针叶抗氧化能力效果的差异1)
赵好战 王百田
(北京林业大学,北京,100083)
近年来,许多研究显示,松针具有生物活性及极高的营养价值。红松(Pinus koraiensis)针叶含有许多抗氧化物,如多酚类、花青素、类黄酮等。有研究指出,松针具有抗致突变性及抗肿瘤效果[1],树皮具有抗氧化、抗发炎、抑制血小板凝集[2]等作用;这是由于其含丰富的原花青素及类黄酮[3]。吴楠等[4]采用无水乙醇和蒸馏水分别对红松针叶进行提取,观察其对1,1-二苯基-2-苦基苯肼(DPPH)自由基的清除作用和β-胡萝卜素-亚油酸氧化体系的抑制作用,以此评价红松针叶提取物的抗氧化活性。发现,红松针叶醇提取物和水提取物对DPPH 自由基有较好的清除作用,乙醇提取物的抗氧化活性明显高于水提取物。认为,红松针叶的乙醇提取物及水提取物,在抗衰老、抗炎症等方面有广泛的应用前景。
植物的抗氧化活性及酚类物质含量[5-7],会受到不同品种、生长季节、采集部位、萃取方式、萃取溶剂、干燥处理及冲泡方式等各种因素的影响[8-9]。因此,本研究探讨不同采集时间、不同干燥处理,对红松针叶抗氧化能力的影响;希望研究结果能对促进人们对红松针叶化学成分的了解、促进红松针叶的进一步开发利用、促进红松资源的综合利用,提供参考。
1 材料与方法
红松针叶采自吉林露水河林业局东升林场,红松树龄200 a 以上,采集的叶片为嫩叶。采集地海拔750 ~1 000 m;采集时间分别为2012年6月15日、8月15日、10月15日、12月25日。
新鲜红松针叶萃取液的制备:用天平秤取采集于不同时间的200 g 新鲜红松针叶样品加入2 000 mL 的蒸馏水后再打汁,经滤纸过滤,在50 ℃条件下减压浓缩至干,用蒸馏水定量至100 mL,质量浓度为20 g/L。萃取液,供试验测定用。
烘干干燥红松针叶萃取液的制备:80 ℃于烘箱中将红松针叶干燥至恒质量,取出秤质量。将干燥后的松针,经粉碎机磨成粉末,用10 倍体积的蒸馏水煮沸120 min,萃取液滤纸过滤,重复萃取;收集3次滤液,在50 ℃条件下减压浓缩至干;用蒸馏水定量至100 mL,质量浓度为20 g/L。萃取液,供试验测定用。
冻干干燥红松松针萃取液的制备:以冻干干燥的方式干燥新鲜的红松针叶,以-40 ℃冷冻干燥红松针叶,干燥完全后取出秤质量。将干燥后的红松针叶,经粉碎机磨成粉末,用10 倍体积的蒸馏水煮沸120 min,萃取液滤纸过滤,重复萃取;收集3 次滤液,50 ℃条件下减压浓缩至干;用蒸馏水定量至100 mL,质量浓度为20 g/L。萃取液,供试验测定用。
萃取方式:试剂用50%的甲醇,萃取方法为索氏萃取法,萃取时间为1 h。
测定指标:叶绿素质量分数测定,采用分光光度法[10];总酚、总类黄酮质量分数测定,参照田莉[11]的方法测定;清除自由基测定,根据Brand- William[12]的方法测定;还原力测定,根据Oyaizu[13]的方法测定;抗氧化性测定,根据Zainol et al[14]的方法测定。
统计分析:所有试验数据的分析,采用SPSS10.0软件进行统计分析,并用Duncan’s multiple range test 进行多组样本间差异显著性分析。
2 结果与分析
2.1 不同采集时间对红松针叶抗氧化能力的影响
由表1可见:不同采集时间,叶绿素质量分数都有明显的差异。12月25日采集的针叶叶片,叶绿素质量分数最低,其次为10月15日采集的、6月15日采集的,8月15日采集的针叶叶片叶绿素质量分数高最。不同采集时间,叶绿素a/b 比值也有显著差异,8月15日采集的针叶叶片叶绿素a/b 比值最高,其次为6月15日采集的、10月15日采集的,12月25日采集的针叶叶片叶绿素a/b 比值最低。
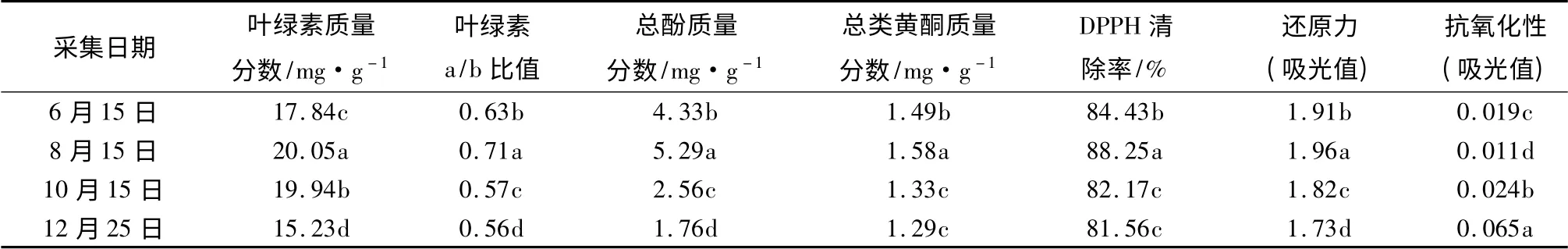
表1 不同时间采集的红松针叶叶绿素质量分数、叶绿素a/b 比值及相关抗氧化能力测定结果
由表1可见:不同采集时间,总酚类质量分数都具有明显的差异。8月15日采集的针叶叶片总酚类质量分数最高,其余依次为6月15、10月15、12月25日采集的针叶叶片。8月15日采集的针叶叶片总类黄酮质量分数最高,其余依次为6月15日、10月15日、12月25日采集的针叶叶片,总类黄酮质量分数逐渐变低。
由表1可见:8月15日采集的松针,具有最佳的清除DPPH 自由基能力;其次为6月15日采集的松针;10月15日、12月25日采集的松针,清除DPPH自由基能力较差。还原力方面,吸光值越高,表示还原力越强。不同时间采集的针叶,还原力有显著差异:8月15日采集的针叶,还原力最高,吸光值可达1.96;其次为6月15日、10月15日采集的针叶;12月25日采集的松针,还原力最低,吸光值为1.73。抗氧化性方面,吸光值越低,表示抗氧化性越强。不同时间采集的针叶,抗氧化性具有显著差异:8月15日采集的松针,抗氧化性最高;其次为6月15日、10月15日采集的针叶;12月25日采集的松针,抗氧化性最低。
在本项研究中,不同时间采集的红松针叶的叶绿素a/b 比值、总酚类质量分数、类黄酮质量分数、清除DPPH 自由基能力、还原力、抗氧化性,都是8月15日采集的红松针叶效果最好,其次为6月15日、10月15日采集的针叶;12月25日采集的松针,效果最差。
2.2 不同采集时间及不同干燥处理对红松针叶抗氧化能力的影响
由表2可见:不同采集时间及干燥处理,叶绿素质量分数有显著差异,冻干处理的红松针叶比烘干处理的松针叶绿素质量分数高。不同时间采集的松针,经烘干及冻干处理后,叶绿素质量分数都是8月15日采集的最高;其次为10月15日、6月15日采集的松针;12月25日采集的松针,叶绿素质量分数最低。不同采集时间及不同干燥处理的红松针叶,以冻干处理的8月15日采集的红松针叶,叶绿素质量分数最高;12月25日采集的红松针叶,经烘干处理后,叶绿素质量分数最低。
由表2可见:冻干处理的红松针叶,比烘干处理的红松针叶的叶绿素a/b 比值高。烘干处理的红松针叶的叶绿素a/b 比值,12月25日采集的松针的最高,8月15日采集的红松针叶的最低。冻干处理的红松针叶叶绿素a/b 比值,6月15日采集的松针的最低。
由表2可见:冻干处理的红松针叶,比烘干处理的红松针叶的总酚类质量分数高。不同时间采集的红松针叶,经过烘干及冻干处理后,8月15日采集的红松针叶,总酚类质量分数都是最高的。在冻干处理中,红松针叶总酚类质量分数最高可达4.46 mg/g;在冻干处理中,12月25日采集的红松针叶,总酚类质量分数最低。在烘干处理中,8月15日采集的红松针叶,总酚类质量分数最高;其次为6月15日、10月15日采集的红松针叶;12月25日采集的红松针叶,总酚类质量分数最低(1.85 mg/g)。
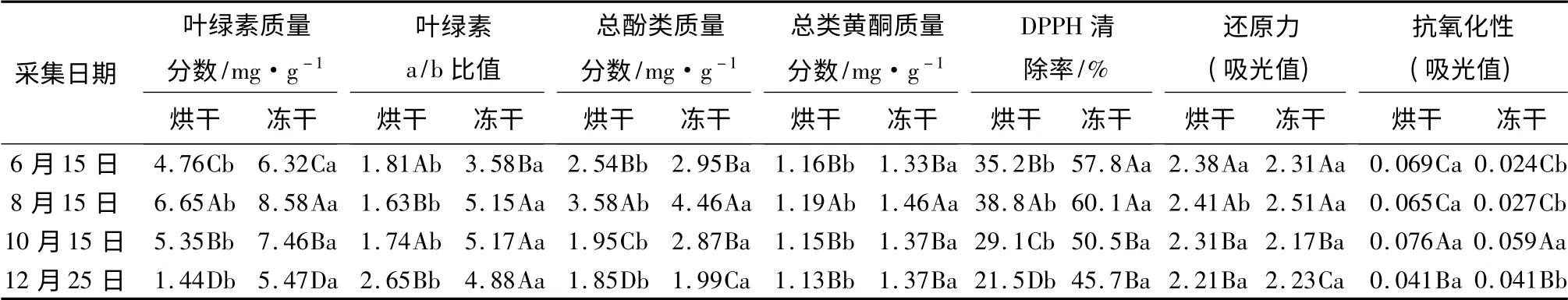
表2 不同时间采集的红松针叶经干燥处理后叶绿素质量分数、叶绿素a/b 比值及相关抗氧化能力测定结果
由表2可见:冻干处理的红松针叶,其类黄酮质量分数高于烘干处理的。经过烘干及冻干处理后的红松针叶,其类黄酮质量分数,都是8月15日采集的显著高于其他时间采集的。不同时间采集的及不同干燥处理的红松针叶,8月15日采集的红松针叶,经冻干处理,具有较高的类黄酮质量分数,可达1.46 mg/g;12月25日采集的红松针叶,经烘干处理,类黄酮质量分数最低(1.13 mg/g)。
由表2可见:冻干处理红松针叶的清除DPPH自由基能力,显著高于烘干处理的红松针叶。经冻干处理,6月15日、8月15日采集的红松针叶,清除DPPH 自由基能力都强;12月25日采集的红松针叶,清除DPPH 自由基能力最低。经烘干处理,8月15日采集的红松针叶,清除DPPH 自由基能力最好;其次为6月15日、10月15日采集的红松针叶;12月25日采集的红松针叶,清除DPPH 自由基能力最差。
由表2可见:相对于其他时间采集的红松针叶,只有8月15日采集的红松针叶,经不同干燥处理后,还原力有差异,冻干处理的红松针叶的还原力明显高于烘干处理的。烘干处理后,6月15日、8月15日采集的红松针叶的还原力,高于10月15日、12月25日采集的红松针叶的还原力,12月25日采集的红松针叶的还原力最低。冻干处理的8月15日采集的红松针叶的还原力最高,10月15日采集的红松针叶的还原力最低。
由表2可见:6月15日、8月15日、10月15日采集的红松针叶,经冻干处理,红松针叶的抗氧化性显著高于烘干处理的红松针叶抗氧化性,其中:6月15日、8月15日采集的红松针叶,抗氧化性较好;12月25日采集的红松针叶,抗氧化性次之;10月15日采集的红松针叶,抗氧化性最低。经烘干处理,12月25日采集的红松针叶,抗氧化性最好;8月15日采集的红松针叶,抗氧化性最差。
3 讨论
植物叶片中叶绿素的质量分数与羧化酶活性及植物光合速率等有相关性,随着植物叶片衰老,叶片中叶绿素质量分数逐渐降低。植物叶片叶绿素质量分数,因温度、光照、种类、采集季节和采集部位不同而不同。本实验对比了4 个不同时间采集的红松针叶的叶绿素质量分数,结果表明:8月15日采集的红松针叶,叶绿素质量分数最高;10月15日采集的红松针叶,叶绿素质量分数次之;12月25日采集的红松针叶,叶绿素质量分数最低;红松可能更适合东北的夏季气候。不同季节,在红松针叶萃取物的抗氧化物含量及抗氧化能力比较中发现,抗氧化能力因不同的生长季节而变化。
红松是我国东北部地区重要的松属树种,针叶及球果可提取抗氧化活性成分。在欧洲国家,红松针叶提炼成分已用作食品添加剂。研究结果表明:在不同的生长季节采集的红松针叶,或用不同的干燥方法处理采集的红松针叶,红松针叶萃取物的抗氧化物性质及能力有差异。尽管对红松针叶研究取得了一定的进展,但红松针叶内仍有许多其他的有效成分,可能对其他抗氧化能力的表达有关,未来仍需对红松针叶进行更深入的研究。
[1] Kong Z,Liu Z,Ding B.Study on the antimutagenic effect of pine needle extract[J].Mutat Res,1995,347(3/4):101-104.
[2] Bito T,Roy S,Sen C K,et al.Pine bark extract pycnogenol downregulates IFN-induced adhesion of T cells to human keratinocytes by inhibiting inducible ICAM-1 expression[J].Free Radic Biol Med,2000,28(2):219-227.
[3] Yen G C,Duh P D,Huang D W,et al.Protective effect of pine(Pinus morrisonicola Hay.)needle on LDL oxidation and its antiinflammatory action by modulation of iNOS and COX-2 expression in LPS-stimulated RAW 264.7 macrophages[J].Food Chem Toxicol,2008,46(1):175-185.
[4] 吴楠,王微,祖元刚.红松针叶提取物抗氧化活性研究[J].中国老年学杂志,2008,28(20):1985-1986.
[5] 高翔,武佳业,张直峰,等.翅果油树不同部位多糖含量及抗氧化活性比较研究[J].植物研究,2011,31(3):363-366.
[6] 范现丽,王高,王宏,等.香桃木叶片粗多酚抗氧化活性的研究[J].植物研究,2009,29(3):375-379.
[7] 范庆,吕秀军,杨柳,等.镉胁迫对矮牵牛种子萌发、幼苗生长及抗氧化酶活性的影响[J].植物研究,2010,30(6):685-691.
[8] Ferreyra R M,Via S Z,Mugridge A,et al.Growth and ripening season effects on antioxidant capacity of strawberry cultivar Selva[J].Sci Hortic,2007,112(1):27-32.
[9] Hussain A I,Anwar F,Sherazi S T H,et al.Chemical composition,antioxidant and antimicrobial activities of basil (Ocimum basilicum)essential oils depends on seasonal variations[J].Food Chem,2008,108(3):986-995.
[10] 赵世杰,刘华山,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,1998:68-72.
[11] 田莉.葡萄果实查耳酮合成酶研究[D].北京:中国农业大学,2007:65-77.
[12] Brand-Williams W,Cuvelier M E,Berset C.Use of a f ree radical method to evaluate antioxidant activity[J].Lebensm Wiss Technol,1995,28(1):25-30.
[13] Oyaizu M.Studies on products of browning reaction prepared from glucosamine[J].Jpn J Nutr,1986,44(6):307-315.
[14] Zainol M K,Abd-Hamid A,Yusof S,et al.Antioxidative activity and total phenolic compounds of leaf,root and petiole of four accessions of Centella asiatica (L.)Urban[J].Food Chem,2003,81(4):575-581.

