利拉鲁肽——早期应用,长期获益
北京大学第一医院内分泌科 郭晓蕙
2型糖尿病是进展性疾病,如不能早期有效控制血糖,最终将导致患者β细胞功能下降及常见并发症发生风险增加,还可能给患者带来体重增加、低血糖等不良反应。中国2型糖尿病防治指南建议:对新诊断和早期2型糖尿病患者采用严格控制血糖的策略来减少糖尿病并发症发生风险。DCCT、UKPDS等研究证实,在处于早期的2型糖尿病患者中采用强化血糖控制可显著减少糖尿病微血管病变的发生风险[1]。导致2型糖尿病进展的主要原因是β细胞功能衰退,UKPDS结果显示新诊断的2型糖尿病患者就已经丧失了约50%的β细胞功能,且β细胞的功能随着糖尿病病程延长而不断减退[2]。目前尚无证据证实β细胞可再生和复制,但有研究提示受损的β细胞功能仍具有逆转和恢复的可能性,特别是在疾病的早期[3]。尽早改善和保护β细胞功能是2型糖尿病治疗的关键。早期使用具有抗β细胞凋亡作用的药物,如新一代的肠促胰素类药物,具有改善β细胞功能、延缓2型糖尿病进展的潜能。
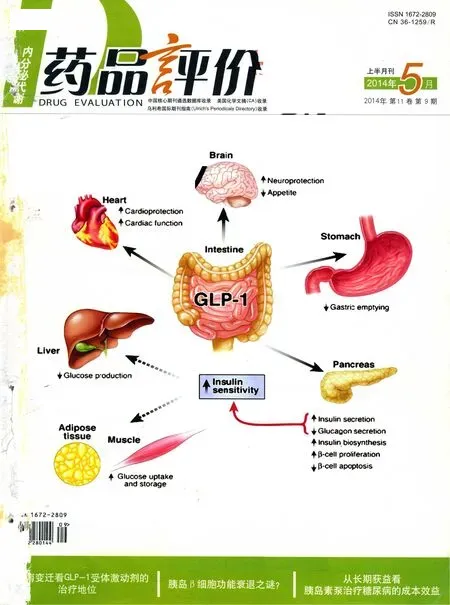
基于肠促胰素治疗是近年来糖尿病领域研究的热点,胰高血糖素样肽1(GLP-1)是肠促胰素的一种,其独特的生理效应引发了人们的广泛关注。GLP-1经肠道细胞分泌,血糖依赖性刺激胰岛β细胞分泌胰岛素;促进β细胞增殖、减少凋亡,但天然GLP-1在体内易被二肽基肽酶4(DPP-4)降解而失活。人GLP-1类似物——利拉鲁肽将GLP-1第34位赖氨酸替换为精氨酸,并在26位增加了一个16碳棕榈酰脂肪酸侧链,与天然GLP-1保持97%的同源性,既克服了天然GLP-1易被降解的缺点,又保留了天然GLP-1的多重生理作用,不仅能按需促进胰岛素的分泌,抑制胰高血糖素的分泌,还具有抑制胰岛β细胞凋亡、延缓胃排空和可能保护心血管系统等作用[4]。本文将从基础和临床角度系统阐述利拉鲁肽早期治疗及长期持续应用的多重获益。
利拉鲁肽早期应用,有效改善胰岛β细胞功能
尽早改善和保护β细胞功能是糖尿病治疗的关键。多项基础研究证实利拉鲁肽对β细胞具有保护作用,可改善β细胞功能从而发挥降糖作用。一项对年龄为10周的雄性db/db和m/m小鼠接受利拉鲁肽持续治疗2周的研究中,采用激光捕捉显微解剖和即时的RTPCR研究胰岛核心区域的基因表达谱的变化。结果显示利拉鲁肽可改善db/db小鼠的代谢变量和胰岛素敏感性,同时增加两种小鼠的葡萄糖刺激胰岛素分泌,减少db/db小鼠甘油三酯。该研究结果表明,利拉鲁肽不仅可直接调节细胞动力学来增加β细胞数量;还可通过抑制氧化应激和内质网应激,减轻糖脂毒性,从而减少β细胞凋亡[5]。
多项临床研究证实利拉鲁肽可改善胰岛β细胞的分泌功能。一项纳入39例2型糖尿病患者随机接受0.65、1.25或1.9mg/d的利拉鲁肽或安慰剂治疗14周的研究中,通过静脉葡萄糖耐量试验的平均胰岛素来评定葡萄糖效应和胰岛素敏感性。结果证实利拉鲁肽可改善第一时相和第二时相胰岛素分泌,同时改善高血糖时精氨酸刺激的胰岛素分泌。1.25和1.9mg/d剂量组的利拉鲁肽均可显著增加第一时相胰岛素分泌(P<0.05)[6]。LEAD系列研究中用稳态模型评估间接评估利拉鲁肽对β细胞功能的改善。LEAD-1研究纳入1041例HbA1c均值8.4%的2型糖尿病患者,试验组为不同剂量利拉鲁肽(0.6、1.2、1.8mg/d)联合格列美脲(2~4mg/d)治疗,对照组为罗格列酮(4mg/d)联合格列美脲(2~4mg/d)或格列美脲单药治疗,观察26周。该研究结果显示:与罗格列酮联合格列美脲组相比,利拉鲁肽(1.8mg或1.2mg)联合格列美脲治疗组的HOMA-β增加均具有统计学差异(P<0.05)[7]。同样,LEAD-2研究纳入1091例基线HbA1c7%~11%的2型糖尿病患者,随机分配至不同剂量利拉鲁肽(0.6、1.2、1.8mg/d)联合二甲双胍治疗组,二甲双胍单药治疗组、二甲双胍联合格列美脲组(4mg/d),给药26周,结果显示,与安慰剂相比,利拉鲁肽(1.8mg或1.2mg)联合二甲双胍的治疗组均可显著改善患者HOMA-β指数(P<0.05)[8]。Matthews等在2010年对LEAD研究进行的荟萃分析结果显示:利拉鲁肽的应用可增加自基线的胰岛HOMA-β指数;并减少自基线的胰岛素原与胰岛素比值(P/IR)[9]。可见,以GLP-1为基础的降糖治疗方案早期应用可有效改善2型糖尿病患者的胰岛素分泌。
利拉鲁肽兼顾空腹和餐后血糖,早期应用,效果更优
严格的血糖控制可以有效减少糖尿病相关的微血管和大血管并发症发生风险,改善预后,减轻患者负担。一项纳入13例2型糖尿病患者观察2周的研究结果显示,利拉鲁肽组2型糖尿病患者在注射后的24小时内,血糖水平持续低于安慰剂组[10]。利拉鲁肽半衰期长达13小时,每日1次皮下注射,可24小时持续发挥降糖作用[11]。与GLP-1的多重生理效应一致,利拉鲁肽可有效改善患者空腹和餐后血糖,实现HbA1c达标。利拉鲁肽具有全面的降糖作用,且其注射时间非常灵活,无需拘泥于餐前注射,同样可显著降低餐后血糖[12]。LEAD-1和LEAD-3研究对2型糖尿病患者早期应用利拉鲁肽后血糖水平的变化进行了研究。LEAD-1研究中,纳入既往口服单药或联合治疗效果不佳的HbA1c均值8.4%的2型糖尿病患者,结果显示,治疗26周后,利拉鲁肽1.2mg、1.8mg组空腹血糖(FPG)下降1.6mmol/L,罗格列酮组FPG下降0.9mmol/L,安慰剂组FPG增加0.9mmol/L;利拉鲁肽1.2mg、1.8mg组餐后血糖(PPG)下降2.5~2.7mmol/L,罗格列酮组PPG下降1.8mmol/L,安慰剂组PPG下降0.4mmol/L[7],利拉鲁肽1.2mg、1.8mg组显著改善FPG、PPG,均优于罗格列酮组,且有统计学差异。利拉鲁肽对空腹、餐后血糖良好的控制效果同样在LEAD-3研究中得到证实。该研究纳入746例早期2型糖尿病患者(36.5%只接受生活方式干预,63.5%使用未达最高剂量二分之一的口服药单药治疗2个月),随机分组接受,每日1次的利拉鲁肽1.2mg、1.8mg单药治疗或格列美脲8mg单药治疗52周,结果显示,利拉鲁肽1.2mg、1.8mg治疗后空腹血糖(FPG)分别下降0.84、1.42 mmol/L,均显著优于格列美脲组(FPG下降0.29 mmol/L),P<0.05,均具有统计学差异。利拉鲁肽1.2mg、1.8mg治疗后FPG分别下降1.71、2.08mmol/L,利拉鲁肽1.8mg治疗后餐后血糖下降显著优于格列美脲组(2.08 vs 1.36mmol/L,P<0.05)[13]。可见,2型糖尿病患者尽早使用利拉鲁肽,无论单药还是联合治疗,与基线相比,利拉鲁肽均可有效降低患者的空腹和餐后血糖。
各国指南都推荐了2型糖尿病血糖控制目标(HbA1c为6.5%~7.0%)。已有证据显示HbA1c降低到7%或以下可减少糖尿病微血管并发症,如果在诊断糖尿病后立即良好控制血糖,可以减少远期大血管疾病。利拉鲁肽在2型糖尿病早期应用的临床研究显示HbA1c水平显著下降。既往使用口服药血糖控制不佳的2型糖尿病患者加用利拉鲁肽后HbA1c的下降均呈现优于既往治疗的趋势。LEAD-1研究中,利拉鲁肽(0.6、1.2、1.8mg/d)联合格列美脲与罗格列酮4mg/d或安慰剂联合格列美脲(2~4mg/d)治疗26周后,利拉鲁肽(1.2或1.8mg)联合格列美脲组HbA1c值均下降1.1%,显著优于罗格列酮联合格列美脲组(-1.1% vs-0.4%,P<0.0001)[7];在LEAD-2研究中,利拉鲁肽1.2mg和1.8mg加用二甲双胍治疗治疗26周后,HbA1c值均下降1.0%,显著优于二甲双胍单药治疗(-1.1% vs+0.1%,P<0.0001)[8]。另一项利拉鲁肽与西格列汀头对头的研究中,在使用二甲双胍的基础上加用利拉鲁肽或西格列汀,利拉鲁肽1.2mg和1.8mg组治疗26周后HbA1c分别下降1.2%和1.5%,西格列汀组HbA1c下降0.9%[14]。上述三项研究结果均表明,既往使用其他口服降糖药物治疗疗效不佳的2型糖尿病患者,联合利拉鲁肽治疗后,可显著降低患者HbA1c,此外,上述研究还提示,利拉鲁肽1.2mg和1.8mg治疗组的HbA1c达标率(<7%)均显著高于对照组:利拉鲁肽1.2mg与格列美脲联合治疗组高于罗格列酮与格列美脲联合组(35% vs 22%,P=0.0005) ,利拉鲁肽1.8mg与格列美脲联合治疗组高于罗格列酮与格列美脲联合组(42%vs 22%,P<0.0001)[7];利拉鲁肽1.2mg与二甲双胍联合治疗组显著高于二甲双胍与西格列汀联合组(44%vs 22%,P<0.0001),利拉鲁肽1.8mg与二甲双胍联合治疗组显著高于二甲双胍与西格列汀联合组(55% vs 22%,P<0.0001)[14]。可见,对于早期2型糖尿病患者尽早应用利拉鲁肽,可有效降低HbA1c,并使更多患者治疗后达到ADA指南建议的HbA1c<7%目标。
新近EVIDENCE研究结果提示在糖尿病早期使用利拉鲁肽可为患者带来更大临床获益。该项研究对纳入既往使用一种、两种或三种以上OAD或胰岛素基础上联用或不联用OAD治疗的患者按病程及既往治疗背景进行分层,分别为糖尿病病程(0~5年;6~10年;≥10年),分析利拉鲁肽治疗1年后的HbA1c下降程度。研究数据显示,与糖尿病病程>10年的受试者相比,病程为0~5年的受试者使用利拉鲁肽治疗1年有更大幅度的HbA1c降低(1.22%和0.76%;P<0.001);在不同的基础治疗中,与联合使用≥3种OAD或胰岛素(±OAD)的患者相比,联合使用1种OAD者有更大幅度的HbA1c降低(1.4%和0.74%;P<0.001)[15]。这表明,在糖尿病病程较短并且基础治疗较少的患者中,利拉鲁肽可实现更佳的治疗效应,提示利拉鲁肽在2型糖尿病患者中应尽早使用。
利拉鲁肽长期使用,多重获益
2型糖尿病患者往往还合并多重危险因素,如高血压、脂代谢紊乱等,增加患者不良结局的风险,因此2型糖尿病患者需要强调综合管理,各国2型糖尿病指南均建议糖尿病治疗应综合考虑血糖、血压和血脂水平的管理,还应避免体重增加和低血糖发生。与传统降糖药相比,基于GLP-1的多重效应,早期使用以利拉鲁肽为基础的降糖治疗方案,除了全面有效降糖之外,长期使用还可带来降糖以外的多重获益。
血糖达标已经不是2型糖尿病治疗的唯一目标。利拉鲁肽降血糖之外的临床获益包括减轻患者体重、降低收缩压等作用。一些利拉鲁肽延长期的研究结果证实了其长期应用的多重获益。LEAD-3延长研究旨在对比利拉鲁肽与格列美脲长期治疗的获益与安全性,长达2年的治疗结果显示:利拉鲁肽1.2mg、1.8mg及格列美脲治疗均可降低患者收缩压水平,利拉鲁肽1.2mg治疗组收缩压下降幅度与格列美脲治疗组相当(2.1mmHg vs 0.7mmHg,P=0.29),利拉鲁肽1.8mg组患者收缩压降幅显著高于格列美脲组(3.6mmHg vs 0.7mmHg,P<0.01);利拉鲁肽1.2mg、1.8mg治疗2年患者体重分别下降2.7kg和2.1kg,格列美脲组患者体重持续增加1.1kg,利拉鲁肽1.2mg组和1.8mg组治疗后患者体重的改善均显著优于格列美脲组(P值均为0.0001)[16]。LEAD-2延长研究结果与LEAD-3研究结果相似。LEAD-2主体研究完成后590例患者又继续完成为期2年的延长研究,结果显示:与格列美脲联合二甲双胍相比,利拉鲁肽联合二甲双胍治疗2年,不仅患者的HbA1c持续改善,利拉鲁肽1.8mg和1.2mg组的体重也分别降低2.9kg和3.0kg,提示利拉鲁肽可长期有效减轻体重。Jendle等的分析显示,在LEAD-2研究中利拉鲁肽减轻体重的主要原因是脂肪组织减少(占全部减少量的2/3),并主要体现在内脏脂肪的减少(内脏脂肪的减少比例约是皮下脂肪的2倍)[17],内脏脂肪与高血压、血脂异常和2型糖尿病的发生发展相关,脂肪组织减少也可能与收缩压及血脂水平降低相关。另一项与西格列汀头对头对照研究的延长期结果显示,利拉鲁肽治疗的患者在用药1.5年后,利拉鲁肽不仅可持续有效改善患者血糖水平,且患者体重减轻,血压和血脂等改善均获得持续良好改善,患者轻度低血糖发生极少[18]。上述研究表明,利拉鲁肽除更能有效地控制血糖之外,还具有减轻体重、降低血压、低血糖风险小等多重益处,对2型糖尿病患者长期的血糖控制和管理非常重要。
同样,在临床实践中利拉鲁肽也表现出长期有效性和安全性。一项意大利糖尿病门诊对205名2型糖尿病患者给予利拉鲁肽治疗,并进行为期2年的临床随访中,纳入的糖尿病患者病程≤5年者占21%,病程>15年者占32%;基线体质指数≤30kg/m2者占38%,给药方案中利拉鲁肽作为添加治疗为39%,作为替换治疗为61%;其中与胰岛素联用者为20%。经历为期2年的随访观察,结果显示:利拉鲁肽治疗可使更多患者HbA1c达标。利拉鲁肽在临床实际应用中同样对患者的血糖控制、体重减轻、血压和腰围等指标改善均获得持续良好疗效[19]。
总结
2型糖尿病是进展性疾病,患者的胰岛β细胞数量和功能呈进行性下降。很多糖尿病患者由于存在低血糖、体重增加等种种顾虑而不愿起始或难以维持降糖治疗,加之β细胞功能进行性的减退,使得血糖水平持续升高,增加糖尿病并发症和血压、血脂紊乱的风险。基于GLP-1受体激动剂类药物明确的降糖疗效,以及对体重和低血糖的独特安全性,ADA及EASD共识建议,GLP-1受体激动剂可作为2型糖尿病患者的治疗选择,尤其是在初始治疗失败及重点考虑体重减轻或低血糖的风险下。人GLP-1类似物利拉鲁肽可改善β细胞功能、减少β细胞凋亡,无论单药或联合其他降糖药物治疗,均能有效改善2型糖尿病患者血糖水平,降低低血糖的发生风险,还可有效控制体重增加和收缩压升高。多项临床研究证实,2型糖尿病患者尽早应用利拉鲁肽可有效降低患者血糖,提高降糖达标率,且安全性良好,可使患者尽早获益,长期使用,更有多重获益。利拉鲁肽良好的降糖作用在临床实践中也得到了充分的验证,将为更多2型糖尿病患者带来新的希望。
[1]中华医学会糖尿病学分会.中国2型糖尿病防治指南(2010年版).中华医学电子音像出版社,2010.
[2]Matthews DR, Cull CA, Stratton IM, et al.UKPDS 26: Sulphonylurea failure in non-insulin-dependent diabetic patients over six years.UK Prospective Diabetes Study (UKPDS) Group.Diabet Med, 1998,15(4):297-303.
[3]Donath MY, Halban PA, et al.UKPDS 26: Decreased beta-cell mass in diabetes: significance, mechanisms and therapeutic implications.Diabetologia, 2004, 47(3):581-589.
[4]Nauck MA.Unraveling the science of incretin biology.Am J Med, 2009,122(6 Suppl):S3-S10.
[5]Shimoda M, Kanda Y, Hamamoto S, et al.The human glucagonlike peptide-1 analogue liraglutide preserves pancreatic beta cells via regulation of cell kinetics and suppression of oxidative and endoplasmic reticulum stress in a mouse model of diabetes.Diabetologia, 2011,54(5):1098-1108.
[6]Vilsboll T, Brock B, Perrild H, et al.Liraglutide, a once-daily human GLP-1 analogue, improves pancreatic B-cell function and argininestimulated insulin secretion during hyperglycaemia in patients with Type 2 diabetes mellitus.Diabet Med, 2008, 25(2):152-156.
[7]Marre M, Shaw J, Brandle M, et al.Liraglutide, a once-daily human GLP-1 analogue, added to a sulphonylurea over 26 weeks produces greater improvements in glycaemic and weight control compared with adding rosiglitazone or placebo in subjects with Type 2 diabetes (LEAD-1 SU).Diabet Med, 2009, 26(3):268-278.
[8]Nauck M, Frid A, Hermansen K, et al.Efficacy and safety comparison of liraglutide, glimepiride, and placebo, all in combination with metformin,in type 2 diabetes: the LEAD (liraglutide effect and action in diabetes)-2 study.Diabetes Care, 2009, 32(1):84-90.
[9]Matthews D, et al.Liraglutide improves B-cell function assessed by HOMA-B and proinsulin to insulin: meta analysis of six clinical trials.Diabetes, 2010, 59 (Suppl 1): S1513.
[10]Degn KB, Juhl CB, Sturis J, et al.One week's treatment with the longacting glucagon-like peptide 1 derivative liraglutide (NN2211) markedly improves 24-h glycemia and alpha- and beta-cell function and reduces endogenous glucose release in patients with type 2 diabetes.Diabetes,2004, 53(5):1187-1194.
[11]Nauek MA, Kleine N, Orskov C, et al.Normalization of fasting hyperglycaemia by exogenous glucagon-like peptide 1(7-36 amide) in type 2 (non-insulin-dependent) diabetic patient.Diabetologia, 1993, 36:741-744.
[12]Flint A, Kapitza C, Hindsberger C, et al.The once-daily human glucagon-like peptide-1 (GLP-1) analog liraglutide improves postprandial glucose levels in type 2 diabetes patients.Adv Ther, 2011,28(3):213-226.
[13]Garber A, Henry R, Ratner R, et al.Liraglutide versus glimepiride monotherapy for type 2 diabetes (LEAD-3 Mono): a randomised, 52-week, phase III, double-blind, parallel-treatment trial.Lancet, 2009,373(9662):473-481.
[14]Pratley RE, Nauck M, Bailey T, et al.Liraglutide versus sitagliptin for patients with type 2 diabetes who did not have adequate glycaemic control with metformin: a 26-week, randomised, parallel-group, openlabel trial.Lancet, 2010, 24, 375(9724):1447-1456.
[15]Presented at the 49th Annual Meeting of the European Association for the Study of Diabetes (EASD), 23–27 September 2013, barcelona,Spain.
[16]Garber A, Henry RR, Ratner R,et al.Liraglutide, a once-daily human glucagon-like peptide 1 analogue, provides sustained improvements in glycaemic control and weight for 2 years as monotherapy compared with glimepiride in patients with type 2 diabetes.Diabetes Obes Metab, 2011,13(4): 348-356.
[17]Nauck M, Frid A, Hermansen K, et al.Long-term efficacy and safety comparison of liraglutide, glimepiride and placebo, all in combination with metformin in type 2 diabetes: 2-year results from the LEAD-2 study.Diabetes Obes Metab, 2013, 15(3):204-212.
[18]Pratley RE, Nauck MA, Bailey T, et al.Efficacy and safety of switching from the DPP-4 I nhibitor sitagliptin to the human GLP-1 analog liraglutide after 52 weeks in metformin-treated patients with type 2 diabetes: a randomized, open-label trial.Diabetes Care, 2012,35(10):1986-1993.
[19]Ponzani P.Long-term effectiveness and safety of liraglutide in clinical practice.Minerva Endocrinol, 2013, 38(1):103-112.