厌氧氨氧化脱氮工艺研究进展
张珏,陈辉,姬玉欣,杨毕娥,刘甲红,金仁村
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
厌氧氨氧化工艺(ANAMMOX)是在厌氧条件下,以亚硝酸盐为电子受体,将氨转化为N2。厌氧氨氧化工艺具有高脱氮效率,在污水处理中发展潜力巨大。但是,该脱氮过程非常复杂。厌氧氨氧化工艺在实验室规模和工业应用中的第一个难题是微生物的生长速度非常缓慢[1-2]。在实验室中,解决该问题的办法是使用序批式反应器(SBR),SBR具有较高的生物持留能力[2]和附着生长型反应器(如生物膜和颗粒污泥反应器)。国际上第一个工业化规模的厌氧氨氧化反应器于 2002年在荷兰鹿特丹建成,用于污泥压滤液处理[3]。该工艺由上流式厌氧氨氧化反应器与短程硝化反应器(SHARON)组成,其中,经过SHARON可将进水中50%~57%氨氮转化成亚硝酸氮[3]。之后,第一个工业化规模的单级厌氧氨氧化系统——完全自养脱氮(CANON)系统在奥地利的 Strass启动[4]。在该系统中,通过限制O2的供应量,使半短程硝化和厌氧氨氧化在单一反应器中同时发生[5]。
目前已有约40个工业化规模的自养脱氮装置,应用在各种高浓度含氨市政和工业废水,包括制革、食品加工、半导体、发酵、酵母、酿酒等废水[6]。据统计,现阶段该系统处理废水的最大氮负荷为11t/d。此外,据报道,实验室规模的厌氧氨氧化工艺还可以处理厕所排水厌氧消化液[7]、粪便消化液[8]、尿液[9]和制药废水[10]。
本文概述了厌氧氨氧化工艺的现状,并对厌氧氨氧化工艺的稳定性、厌氧氨氧化工艺的温室气体(N2O)排放及其工业化应用前景进行了讨论。
1 厌氧氨氧化工艺的应用现状
在过去的十年里,厌氧氨氧化工艺的累积氮负荷增加了近60倍,这表明,该工艺的应用已日趋广泛。目前,厌氧氨氧化工艺只有在中温条件下才能成功实现工业化规模来处理含高浓度氨氮废水[3-4,11]。两种方法可以为厌氧氨氧化过程提供亚硝酸盐,一种是在一个独立的曝气反应器中产生亚硝酸盐[12],另一种是在一个无O2的或者少量O2的[5,13]厌氧氨氧化反应器中产生亚硝酸盐。这两种方法有很多不同的命名方式(表1),以下将分别称它们为两级系统和单级系统。
因为没有短程硝化罐,单级系统往往比两级系统的投资要少。但在两级系统中,可以更好地调控短程硝化和厌氧氨氧化过程,进行单独优化,所以两级系统运行更灵活、稳定。尽管如此,这两者之间的选择还要考虑很多具体的情况,如短程硝化单元、贷款利率、厂区空间和废水特性等。资料数据表明,在约40个自养脱氮的工业化系统中,只有4个使用了两级系统[3,15]。

表1 涉及厌氧氨氧化工艺的脱氮系统的工艺选项和名称
对于单级系统来说,如气提式SBR、生物转盘(RBC)和移动床生物膜反应器(MBBR)等可以用来建立在微氧条件下好氧氨氧化菌(AOB)和厌氧氨氧化菌的共存体系[13-14,22-23]。当菌体存在形态为生物膜或颗粒时,由于氧气扩散受限,所以AOB只在有氧的外层活性较高,而氧气扩散不到内部的核心,内部核心会形成厌氧环境,确保其内厌氧氨氧化菌的高活性。好氧氨氧化会产生一定量的亚硝酸盐,这些亚硝酸盐可以完全穿透生物膜,供厌氧氨氧化菌代谢[2,13,24-25]。在悬浮生长系统中,可以通过开关曝气装置来限制溶解氧浓度在较低的水平。基于模型的研究表明,若生物膜的表面氨负荷一定,则存在一个最佳的溶解氧浓度和生物膜厚度,可使反应器获得最高脱氮效率[26]。表面氨负荷一定,温度越低,则需要较厚的生物膜厚度和较高浓度的DO来维持高水平的氮去除率;生物膜厚度一定,温度越低,需要较小的表面氨负荷和较低浓度的DO来保持高效率氮去除能力。
在单级系统中,可防止亚硝酸盐氧化菌(NOB)产生硝酸盐,这是由于NOB对O2的亲和力比AOB低;和厌氧氨氧化菌相比,NOB对亚硝酸的亲和力较低[27]。一些研究者提出,在高浓度废水条件下,通过游离氨(FA)来抑制亚硝酸盐的氧化作用,可以快速高效地提升总氮去除效率。但FA对NOB的效果在文献中存在较大的分歧[28-29],建议不要仅仅依赖FA来抑制亚硝酸氧化[30]。因此在今后的研究中,单级系统的操作条件优化将成为主要研究方向,如溶解氧浓度、氨浓度、COD/N比、pH值等如何影响单级系统的运行性能。在实际运行过程中确定最优运行参数,寻找有效的调控策略对系统进行性能优化。
由厌氧氨氧化菌或亚硝酸盐氧化菌产生的硝酸盐可以在硝酸盐还原(如异养反硝化)的过程中脱除。不过,为了能够成功实现厌氧氨氧化,目前认为首要条件是去除COD。由于厌氧氨氧化菌的生长速率缓慢且产率较低,应严格控制异养生长条件,使污泥中厌氧氨氧化菌的丰度维持在较高水平。有机物可以在反硝化微生物的催化下还原硝酸盐。此外,有研究证实,若COD/N设定为0.5 gCOD/(gN)时,厌氧氨氧化菌能成功与异养微生物竞争[31-33],这就为工艺优化提供了新的思路。
2 厌氧氨氧化工艺的N2O排放
氧化亚氮(N2O)是一种重要的温室气体,拥有比CO2强300倍以上的全球变暖的潜力,它是反硝化反应的中间产物,在一定的条件下也是 AOB的副产物。在处理污水的过程中,有几个氮转化的过程均会产生大量的N2O,包括硝化反应、反硝化反应以及亚硝酸盐和羟胺之间的化学反应[34]。但在厌氧氨氧化的代谢中,N2O既不是中间产物,也不是副产物[35]。 然而,在单级系统中,AOB的生长需要 O2,因此可能有两种途径产生 N2O:①AOB可以通过氨或 H2等电子供体来还原亚硝酸盐产生N2O[36];②AOB中不稳定的中间产物羟胺的化学反应会产生N2O[37]。据报道,在一个工业化规模的单级短程硝化-厌氧氨氧化系统中,N2O的排放量为氮负荷的1.3%[38],而在间歇曝气与连续曝气期间N2O的排放量分别为氮负荷的0.6%和0.4%[14]。在一个工业化规模的两级短程硝化-厌氧氨氧化系统中(荷兰鹿特丹Dokhaven Sluisjesdijk污水处理厂),N2O的排放量占短程硝化反应器氮负荷的1.7%,为厌氧氨氧化反应器氮负荷的0.6%[21]。而在另一个工业化规模的两级系统中,N2O的排放量占 6.6%[15]。de Graaff等[7]测得厌氧氨氧化SBR反应器的N2O排放量为总氮负荷的 1%,该反应器用于处理厕所排水厌氧消化液短程硝化后的出水。最近有报道称,在12℃下运行的实验室规模的单级系统反应器中,氮去除量的2.4%要归因于N2O的排放[39]。这些结果表明,N2O从单级系统和两级系统都有排放。但详细的排放数据还有待进一步研究,以期充分了解这两类系统的 N2O排放量,并能够与传统的硝化-反硝化系统进行比较。同时,应该重视在污水处理过程中N2O的排放,积极改进和研发污水处理技术,优化工艺参数,从而有效地控制N2O的排放。
3 厌氧氨氧化工艺的稳定性
厌氧氨氧化菌的倍增时间长[1],因此,菌体最大限度地持留对于厌氧氨氧化工艺的稳定性至关重要。因此,生物膜和颗粒系统比絮状生长系统更具优势。SBR中絮状污泥的上浮问题已有报道[14],通过缩短曝气时间和添加纳米絮凝剂的方式优化污泥的沉降性能,解决上浮问题。然而,当污泥的沉降发生在一个单独的步骤中时,例如在一个CSTR反应器的沉淀池或者一个SBR反应器中沉降,此时有必要对其进行优化。一般情况下,较大的聚集体更适合单级系统[26]。此外,有研究表明,较大的聚集体还会表现出较高的厌氧氨氧化活性和较低好氧氨氧化-亚硝酸氧化活性[33,40]。为了能更好地留住较大的聚集体,可以在絮状污泥SBR中安装水力旋流器[41]。然而,也有部分没有这种装置的SBR反应器表现出了长期稳定性[14](SBR反应器内安装搅拌器)。此外,反应器的构型也是污泥沉降性能的影响因素之一,气升式系统和升流式反应器系统中低沉降性能的污泥不断洗出,反应器内留下沉降性能较好的污泥逐渐集聚形成较大颗粒,所以此类反应器内会产生较大的颗粒污泥[11]。在反应器启动过程中,应综合考虑接种污泥类型与反应器构型,这样能够更有效地建立高效稳定的厌氧氨氧化工艺。对于固体和COD负荷的波动,生物膜和颗粒系统比絮状污泥系统更稳定。事实上,在生物膜和颗粒污泥的系统中,小颗粒和异养的絮状污泥很容易从生物膜中分离出来。因此,这可以更有效地去除它们,避免其对自养微生物的干扰。
厌氧氨氧化菌是在厌氧的条件下才能显示出较好的活性,这使得溶解氧成为厌氧氨氧化工艺的关键操作参数。最初报道,0.5%的饱和溶解氧即可抑制厌氧氨氧化菌[24]。不过在实验室规模的生物反应器中已经多次发现,即使经过较长时间的有氧状态(>8mgO2/L),厌氧氨氧化的活性也可以恢复。但过量的溶解氧也会导致NOB的增长,它会与厌氧氨氧化菌竞争亚硝酸盐,与AOB竞争O2,最终导致整个系统崩溃。由此可见,溶解氧的浓度是厌氧氨氧化工艺中一个重要的参数,其浓度的调控得当与否直接决定该工艺的运行性能的优良。因此,严格控制溶解氧的浓度是厌氧氨氧化工艺建立与运行的必备条件。但是实际运行过程中溶解氧的稳定控制存在一定的难度,鉴于好氧微生物和厌氧微生物错综复杂的关系,有人建议将溶解氧和氮的液相浓度结合起来作为控制参数。Joss等[14]建议,溶解氧浓度应该维持在一个设定的点(<1mgO2/L),在这种操作模式下,第一个SBR反应器连续的亚硝氮生成与消耗最终使出水亚硝氮浓度保持在 10mg/L以下,并直接通过氨离子选择电极来测量氨氮,对SBR进行调控;为了验证连续曝气与间歇曝气对反应器产生的不同影响,在随后启动的反应器中采取两种不同模式曝气方式进行运作,两个反应器的出水亚硝氮均低于2mg/L,这说明厌氧氨氧化在两个反应器中都能持续发生,但是连续曝气方式的优势在于其操作的简易性。另一方面,对于连续流系统中的溶解氧可以通过自动比色测量氨进行控制[11]。
工业废水和生活污水的成分往往非常复杂,这使得厌氧氨氧化的成功工业化实施和稳定运行面临巨大挑战[3],这些废水通常会含较高浓度氮素、抗生素、重金属和酚类等有毒物质,这些成分会很大程度地影响厌氧氨氧化的活性[12,42-44],最终导致厌氧氨氧化工艺性能降低,稳定性变差。低浓度的无毒性有机物会对厌氧氨氨氧化不会有抑制作用,有时还能起到促进作用,但是浓度过高就会对厌氧氨氧化产生毒害作用。一些有毒性的有机物会通过微生物毒害与酶活的钝化对厌氧氨氧化产生毒害,这些抑制作用通过是不可恢复的。重金属为不易降解物质,它们会在微生物内部积累从而产生毒害作用。
氨对厌氧氨氧化菌不会产生抑制,反而是它的基质,但亚硝酸盐会对它产生很强的抑制[45]。有研究表明,长期(超过一周)暴露于980mg/L氨对厌氧氨氧化菌不会产生明显的负面影响[45],而 20~25mg/L的游离氨可以抑制厌氧氨氧化菌[25,46]。当亚硝酸盐的浓度高于100mg/L时,厌氧氨氧化菌的活性会完全被抑制,但抑制可逆,添加微量的联氨或羟胺可以迅速恢复厌氧氨氧化菌的活性[45]。早期的亚硝酸盐对厌氧氨氧化菌抑制研究表明,这种抑制效果与接触时间和亚硝酸盐的浓度有关[22,45,47]。最近对亚硝酸盐抑制的综合研究表明,暴露在高达1000mg/L的亚硝酸盐浓度下24h,其活性同样是可以恢复的[48]。这表明厌氧氨氧化菌生存在高浓度的亚硝酸盐浓度时,它将表现出与常规条件不一样的特性。此外,在低浓度的亚硝酸盐浓度(<1mg/L)下培养的厌氧氨氧化菌似乎更容易被短时的高浓度亚硝酸盐抑制,而在更高浓度的亚硝酸盐下运行需要严格调控亚硝酸盐的浓度,否则就会导致厌氧氨氧化菌中毒[4,48]。
本文作者课题组在厌氧氨氧化抑制方面做了大量研究,包括土霉素、铜(Ⅱ)、盐度、硫化物、苯酚对厌氧氨氧化工艺的抑制作用以及土霉素、铜(Ⅱ)、硫化物、苯酚对厌氧氨氧化工艺的联合抑制作用[43,49-52](表2)。研究发现,由于不同的工作条件、实验方法、污泥的物理化学特性差异和所涉及的微生物种群,抑制剂的作用差别也很大,其中重金属铜的毒害作用较为显著,其半抑制浓度(IC50)仅为 12.9mg/L,而重金属又是多种废水中常见的有毒污染物之一,因此就重金属对厌氧氨氧化工艺抑制毒害作用以及有效地缓解重金属抑制方法的研究意义重大。此外,厌氧氨氧化菌对生长环境的要求较为严格,要想实现厌氧氨氧化工艺更广的工业化应用,仍需进行大量关于厌氧氨氧化菌快速富集培养与抑制物毒害作用的研究。
4 展 望
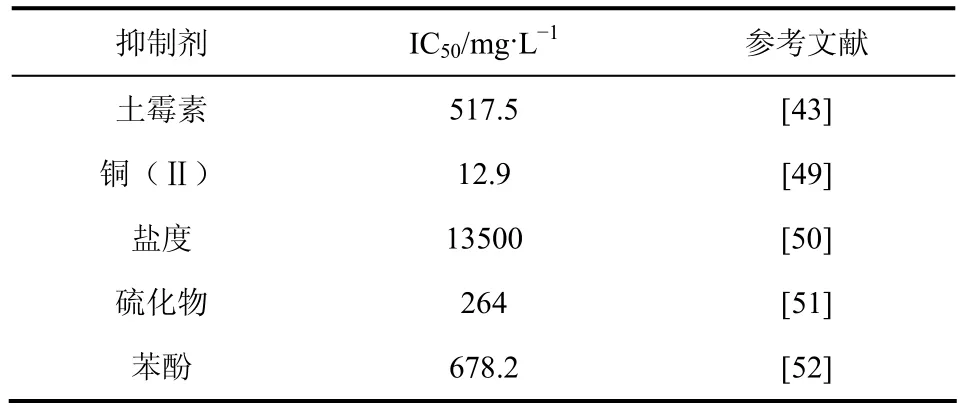
表2 不同抑制剂对厌氧氨氧化菌的IC50
基于对厌氧氨氧化菌生理特性的研究,已经出现了一些厌氧氨氧化工艺的崭新应用方式:①市政污水处理中厌氧氨氧化工艺的应用;②与有机酸氧化耦合去除硝酸盐。
到目前为止,大多数文献报道的自养脱氮系统都在25℃以上运行,进水氮的浓度超过0.1g/L[53]。因此下一个研究工作就是在较低的温度下和较低的氮浓度下进行厌氧氨氧化工艺的应用。这将增加厌氧氨氧化工艺应用到市政污水处理的可能性,有望使污水处理厂达到一个能量平衡[54]。为了避免过多的有机物输入到自养脱氮步骤,能最大限度地从市政污水中进行能量的回收,可以在A/B步骤中的A阶段后预先脱除有机碳,或设置在厌氧消化或者物化预处理之后[4,14,54-56]。
厌氧氨氧化工艺在处理市政污水时最大的挑战就是能够实现在低温下(8~15℃)有良好的菌体持留能力和较低的出水氮浓度。近日,低温条件下厌氧氨氧化工艺的研究已经取得了突破性进展[39,57]。一个实验室规模的单级系统在25℃正常运行,可以迅速地适应(10d)并正常运行在 12℃下。此外,该系统运行超过了300d都没有亚硝酸盐的积累,也检测不到NOB的活性,去除率能够在12℃能够达到90%以上[39]。本文作者课题组的研究表明,实验室规模的UASB反应器在35℃下正常运行,逐渐降低温度,通过常规驯化、菌种流加和添加甜菜碱的策略,反应器可在9.1℃的低温下,总氮去除速率达到6.61 kg/(m3·d)[57]。这两个最新的研究报告证明,厌氧氨氧化系统原则上是能够在低温下运行的,但进一步的研究是有必要的,以便能够确定该工艺的可行性,为将来实施中试和最终的工业化应用提供理论依据。
目前,厌氧氨氧化工艺仅适用于氨的去除。但是在未来,这些过程将被组合在一起实现同步去除氨、溶有机物和亚硝酸盐。厌氧氨氧化菌在氨和亚硝酸盐的环境中生长会导致硝酸盐的产生,因为这些微生物会氧化部分亚硝酸盐成为硝酸盐并释放出固碳的必要的质子。因此,硝酸盐会始终存在于采用厌氧氨氧化菌的污水处理系统中。厌氧氨氧化菌也可以耦合硝酸盐和亚硝酸盐还原来氧化还原多种有机物(甲酸、乙酸、丙酸、甲胺)[31-33,58-59]。有机酸的共氧化可能会增加厌氧氨氧化菌在污水处理中的应用潜力。在实验室规模的反应器中,厌氧氨氧化菌可以在C/N比低于2∶1的情况下与异养反硝化菌竞争,这将意味着厌氧氨氧化过程可以应用于同时含有机物和氨的废水中。此外,这种现象可以用来去除厌氧氨氧化反应器出水中的硝酸盐。而且,这两种厌氧氨氧化菌都可以从相同的接种污泥中富集培养,且所有已知的厌氧氨氧化菌均能在没有诱导的情况下转化有机酸[32-33,59]。
5 结 语
厌氧氨氧化提供了一种新的脱氮思路,与传统脱氮工艺相比,可大大降低能源和化学药剂的消耗,为今后污水处理降低成本、简化脱氮过程提供了可能,具有很好的发展空间。尽管厌氧氨氧化工艺的应用目前仅限于高浓度氨氮废水的脱氮处理,但有关低温厌氧氨氧化、反硝化耦合厌氧氨氧化的实验室研究表明,厌氧氨氧化菌具有非常大的潜力,将会以几种不同的方式应用于污水处理领域。为了实现这些最新研究成果的工业化应用,进一步的可行性研究很有必要。
[1] 姬玉欣,诸美红,陈辉,等.高负荷厌氧氨氧化反应器的研究进展[J].化工进展,2013,32(8):1914-1920.
[2] Strous M,Heijnen J J,Kuenen J G,et al.The sequencing batch reactor as a powerful tool for the study of slow ly grow ing anaerobic ammonium-oxidizing microorganisms[J].Appl.Microbiol.Biotechnol.,1998,50(5):589-596.
[3] van der Star W R L,Abma W R,Blommers D,et al.Startup of reactors for anoxic ammonium oxidation:Experiences from the first full-scale anammox reactor in Rotterdam[J].Water Res.,2007,41(18):4149-4163.
[4] Wett B.Development and implementation of a robust deammonification process[J].Water Sci.Technol.,2007,56(7):81-88.
[5] Third K A,Sliekers A O,Kuenen J G,et al.The CANON system(completely autotrophic nitrogen-removal over nitrite) under ammonium lim itation:Interaction and competition between three groups of bacteria[J].Syst.Appl.Microbiol.,2001,24(4):588-596.
[6] Vlaem inck S E,De Clippeleir H,VerstraeteW.M icrobial resource management of one-stage partial nitritation/ anammox[J].Microb.Biotechnol.,2012,5(3):433-448.
[7] de Graaff M S,Temmink H,Zeeman G,et al.Autotrophic nitrogen removal from black water:Calcium addition as a requirement for settleability[J].Water Res.,2011,45(1):63-74.
[8] Villegas J D,de Laclos H F,Dovat J,et al.Nitrogen removal from digested manure in a simple one-stage process[J].Water Sci.Technol.,2011,63(9):1991-1996.
[9] Udert K M,Kind E,Teunissen M,et al.Effect of heterotrophic grow th on nitritation/anammox in a single sequencing batch reactor[J].Water Sci.Technol.,2008,58(2):277-284.
[10] Tang C J,Zheng P,Chen T T,et al.Enhanced nitrogen removal from pharmaceutical wastewater using SBA–ANAMMOX process[J].Water Res.,2011,45(1):201-210.
[11] Abma W R,Driessen W,Haarhuis R,et al.Upgrading of sewage treatment plant by sustainable and cost-effective separate treatment of industrial wastewater[J].Water Sci.Technol.,2010,61(7):1715-1722.
[12] van Dongen U,Jetten M S,van Loosdrecht M C.The SHARON((R))-Anammox((R)) process for treatment of ammonium rich wastewater[J].Water Sci.Technol.,2001,44(1):153-160.
[13] Sliekers A O,Third K A,Abma W,et al.CANON and anammox in a gas-lift reactor[J].FEMS Microbiol Lett.,2003,218(2):339-344.
[14] Joss A,Salzgeber D,Eugster J,et al.Fullscale nitrogen removal from digester liquid w ith partial nitritation and anammox in one SBR[J].Environ.Sci.Technol.,2009,43(14):5301-5306.
[15] Desloover J,De Clippeleir H,Boeckx P,et al.Floc-based sequential partial nitritation and anammox at full scale w ith contrasting N2O em issions[J].Water Res.,2011,45(9):2811-2821.
[16] Christensson M,Ekström S,Lamaire R,et al.ANITA Mox—A biofarm solution for fast startup of deammonifying MBBRs[C]//WEFTEC:Proceedings of the Water Environment Federation,2011:265-282.
[17] Rosenw inkel K H,Cornelius A,Thöle D.Full scale application of the deammonification process for the treatment of sludge water[C]//Krakow:Proceedings of IWA specialized conference on Nutrient Management in Wastewater Treatment Processes and Recycle Streams,2005:483-491.
[18] Kuai L P,Verstraete W.Ammonium removal by the oxygen-lim ited autotrophic nitrification-denitrification system[J].Appl.Environ.Microbiol.,1998,64(11):4500-4506.
[19] Hippen A,Rosenw inkel K H,Baumgarten G,et al.Aerobic deammonification: A new experience in the treatment of wastewaters[J].Water Sci.Technol.,1997,35(10):111-120.
[20] Furukawa K,Lieu P K,Tokitoh H,et al.Development of single-stage nitrogen removal using anammox and partial nitritation(SNAP) and its treatment performances[J].Water Sci.Technol.,2006,53(6):83-90.
[21] Kampschreur M J,van der Star W R L,Wielders H A,et al.Dynamics of nitric oxide and nitrous oxide em ission during full-scale reject water treatment[J].Water Res.,2008,42(3):812-826.
[22] Egli K,Fanger U,Alvarez P J J,et al.Enrichment and characterization of an anammox bacterium from a rotating biological contactor treating ammonium-rich leachate[J].Arch.Microbiol.,2001,175(3):198-207.
[23] Jaroszynski L W,Cicek N,Sparling R,et al.Importance of the operating pH in maintaining the stability of anoxic ammonium oxidation (anammox) activity in moving bed biofilm reactors[J].Bioresour Technol.,2011,102(14):705-7056.
[24] Strous M,van Gerven E,Kuenen JG,et al.Effects of aerobic and m icroaerobic conditions on anaerobic ammonium-oxidizing(anammox) sludge[J].Appl.Environ.Microbiol.,1997,63(6):2446-2448.
[25] Jin R C,Yu J J,Ma C,et al.Performance and robustness of an ANAMMOX anaerobic baffled reactor subjected to transient shock loads[J].Bioresour Technol.,2012,144:126-136.
[26] Hao X D,Heijnen J J,Van Loosdrecht MCM.Modelbased evaluation of temperature and inflow variations on a partial nitrification-anammox biofilm process[J].Water Res.,2002,36(19):4839-4849.
[27] Blackburne R,Yuan Z,Keller J.Demonstration of nitrogen removal via nitrite in a sequencing batch reactor treating domestic wastewater[J].Water Res.,2008,42(8-9):2166-2176.
[28] Fux C,Lange K,Faessler A,et al.Nitrogen removal from digester supernatant via nitrite—SBR or SHARON?[J].Water Sci.Technol.,2003,48(8):9-18.
[29] Vadivelu V M,Keller J,Yuan Z.Effect of free ammonia on the respiration and grow th processes of an enriched Nitrobacter culture[J].Water Res.,2007,41(4):826-834.
[30] Xing B S,Qin T Y,Chen S X,et al.Performance of ANAMMOX process using multi- and single-fed upflow anaerobic sludge blanket reactors[J].Bioresour Technol.,2013,149:310-317.
[31] Güven D,Dapena A,Kartal B,et al.Propionate oxidation by and methanol inhibition of anaerobic ammoniumoxidizing bacteria[J].Appl.Environ.Microbiol.,2005,71(2):1066-1071.
[32] Kartal B,Kuypers M M M,Lavik G,et al.Anammox bacteria disguised as denitrifiers:Nitrate reduction to dinitrogen gas via nitrite and ammonium[J].Environ.Microbiol.,2007,9(3):635-642.
[33] W inkler M K H,Yang J,Kleerebezem R,et al.Nitrate reduction by organotrophic anammox bacteria in a nitritation/ anammox granular sludge and a moving bed biofilm reactor[J].Bioresour Technol.,2012,114:217-223.
[34] Kampschreur M J,Temm ink H,Kleerebezem R,et al.Nitrous oxide em ission during wastewater treatment[J].Water Res.,2009,43(17):4093-4103.
[35] Kartal B,Maalcke W J,de Almeida N M,et al.Molecular mechanism of anaerobic ammonium oxidation[J].Nature,2011,479(7371):127-130.
[36] Bock E,Schmidt I,Stuven R,et al.Nitrogen loss caused by denitrifying Nitrosomonas cells using ammonium or hydrogen as electron-donors and nitrite as electron-acceptor[J].Arch.Microbiol.,1995,163(1):16-20.
[37] Colliver B B,Stephenson T.Production of nitrogen oxide and dinitrogen oxide by autotrophic nitrifiers[J].Biotechnol.Adv.,2000,18(3):219-232.
[38] Weissenbacher N,Takacs I,Murthy S,et al.Gaseous nitrogen and carbon emissions from a fullscale deammonification plant[J].Water Environ.Res.,2010,82(2):169-175.
[39] Hu Z,Lotti T,Lotti T,et al.Nitrogen removal by a nitritation-anammox bioreactor at low temperature[J].Appl.Environ.Microbiol.,2013,79(8):2807-2812.
[40] V laem inck S E,Terada A,Smets B F,et al.Aggregate size and architecture determ ine m icrobial activity balance for one-stage partial nitritation and anammox[J].Appl.Environ.Microbiol.,2010,76(3):900-909.
[41] Wett B,Hell M,Nyhuis G,et al.Syntrophy of aerobic and anaerobic ammonia oxidisers[J].Water Sci.Technol.,2010,61(8):1915-1922.
[42] Jin R C,Yang G F,Yu J J,et al.The inhibition of the Anammox process:A review[J].Chem.Eng.J.,2012,197:67-79.
[43] Yang G F,Zhang Q Q,Jin R C.Changes in the nitrogen removal performance and the properties of granular sludge in an Anammox system under oxytetracycline(OTC) stress[J].Bioresour Technol.,2013,129:65-71.
[44] Yang G F,Jin R C.The joint inhibitory effects of phenol,copper(II),oxytetracycline (OTC) and sulfide on Anammox activity[J].Bioresour Technol.,2012,126:187-192.
[45] Strous M,Kuenen J G,Jetten M S M.Key physiology of anaerobic ammonium oxidation[J].Appl.Environ.Microbiol.,1999,65(7):3248-3250.
[46] Fernandez I,Dosta J,Fajardo C,et al.Short- and long-term effects of ammonium and nitrite on the anammox process[J].J.Environ.Manage,2012,95:S170-S174.
[47] Dapena-Mora A,Fernandez I,Campos JL,et al.Evaluation of activity and inhibition effects on anammox process by batch tests based on the nitrogen gas production[J].Enzyme Microb.Technol.,2007,40(4):859-865.
[48] Lotti T,van der Star W R L,Kleerebezem R,et al.The effect of nitrite inhibition on the anammox process[J].Water Res.,2012,46(8):2559-2569.
[49] Yang G F,Ni W M,Wu K,et al.The effect of Cu(Ⅱ) stress on the activity, performance and recovery on the Anaerobic Ammonium-Oxidizing (Anammox) process[J].Chem.Eng.J.,2013,226(15):39-45.
[50] Ma C,Jin R C,Yang G F,et al.Impacts of transient salinity shock loads on Anammox process performance[J].Bioresour Technol.,2012,112:124-130.
[51] Jin R C,Yang G F,Zhang Q Q,et al.The effect of sulfide inhibition on the ANAMMOX process[J].Water Res.,2013,47(3):1459-1469.
[52] Yang G F,Guo X L,Chen S X,et al.The evolution of Anammox performance and granular sludge characteristics under the stress ofphenol[J].Bioresour Technol.,2013,137:332-339.
[53] van Hulle S W H,Vandeweyer H J P,Meesschaert B D,et al.Engineering aspects and practical application of autotrophic nitrogen removal from nitrogen rich streams[J].Chem.Eng.J.,2010,162(1):1-20.
[54] Kartal B,Kuenen J G,van Loosdrecht M C M.Sewage treatment w ith anammox[J].Science,2010,328(5979):702-703.
[55] A lvarez J A,Armstrong E,Gomez M,et al.Anaerobic treatment of low-strength municipal wastewater by a two-stage pilot plant under psychrophilic conditions[J].Bioresour Technol.,2008,99:7051-7062.
[56] Jetten M S M,Horn S J,van Loosdrecht M C M.Towards a more sustainable municipal wastewater treatment system[J].Water Sci.Technol.,1997,35(9):171-180.
[57] Jin R C,Ma C,Yu J J.Performance of an Anammox UASB reactor at high load and low ambient temperature[J].Chem.Eng.J.,2013,232:17-25.
[58] Kartal B,Rattray J,van Niftrik L A,et al.Candidatus“Anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J].Syst Appl Microbiol,2007,30(1):39-49
[59] Kartal B,van Niftrik L,Rattray J,et al.Candidatus ‘Brocadia fulgida’:An autofluorescent anaerobic ammonium oxidizing bacterium[J].FEMS Microbiol.Ecol.,2008,63(1):46-55.

