脂多糖诱导高脂家兔动脉血管重塑的研究
韩琼,李燕燕,杜菲,冯津萍
脂多糖诱导高脂家兔动脉血管重塑的研究
韩琼,李燕燕,杜菲,冯津萍
目的:探讨高血脂和慢性炎症导致高脂血兔血管重塑的病生理机制。
方法:建立高血脂和慢性炎症动物模型,随机分4组:对照组(n=5)、高脂组(n=10)、脂多糖组(n=10)和高脂+脂多糖组(n=10)。Masson染色,观察动脉壁结构变化;测量内膜厚度(IT)和中膜厚度(MT),计算IT/MT比值;检测血清高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C);酶联免疫分析法(ELISA)测定 血清基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶组织抑制剂(TIMP-1)、I型胶原C末端肽(CTX-1)。
结果:高脂+脂多糖组与其他三组比较,内膜明显增厚,内弹力板中断甚至消失,内膜下大量泡沫细胞、脂质及炎细胞浸润,可见多量平滑肌细胞,胶原沉积;中膜平滑肌细胞排列紊乱,中膜明显萎缩。高脂+脂多糖组与其他三组比较,IT和IT/MT的比值均增加;进食高脂饲料8周后,高脂组、高脂+脂多糖组的血清高密度脂蛋白胆固醇及低密度脂蛋白胆固醇水平较对照组和脂多糖组均增高;进食高脂饲料16周后,高脂+脂多糖组较其他三组MMP-9、TIMP-1浓度明显升高 ,脂多糖组、高脂+脂多糖组较对照组CTX-1显著升高。上述比较差异均有统计学意义(P<0.05)。
结论:高血脂和慢性炎症反应可能是动脉粥样硬化(AS)和血管重塑的共同致病因素,在二者的交互作用下AS和血管重塑过程可以同时启动和进展。
炎症 ;动脉粥样硬化; 血管平滑肌细胞;胶原C末端肽
Methods: The experimental rabbits were randomly divided into 4 groups. Normal control group, n=5, Hyperlipidaemia group, the animal received high fat diet, n=10, LPS group, the animal received LPS injection, n=10 and Hyperlipidaemia + LPS group, n=10. All animals were treated for 16 weeks. The arterial wall structure changes were observe by Masson stain method for tunica intima thickness (IT), media thickness (MT) and the ratio of IT/MT. The serum levels of HDL and LDL were examined. The serum levels of matrix metallo proteinase 9 (MMP-9), tissue inhibiter of matrix metallo protinase (TIMP-1) and C-terminel telopeptide of type I collagen (CTX-1) were detected by ELISA.
Results: Compared with the other 3 groups, Hyperlipidaemia + LPS group showed obviously thicker tunica intima, the inner elastic plate was interrupted or even disappeared, there were foam cells, lipid and inf l ammatory cells invasion, smooth muscle cell and collagen deposing under the intima. The media showed smooth muscle cell disorder and atrophy, the ratio of IT/MT increased. With 8 weeks treatment, Hyperlipidaemia and Hyperlipidaemia + LPS groups had signif i cantly increased HDL and LDL. With 16 weeks treatment, Hyperlipidaemia + LPS group had obviously elevated MMP-9 and TIMP-1. Compared with Normal control group, LPS and Hyperlipidaemia + LPS groups had elevated CTX-1. All P<0.05.
Conclusion: Hyperlipidaemia and chronic inf l ammation might be the common pathogenic factors of atherosclerosis and vascular remodeling in experimental rabbits, the process could start and progress with their interaction.
(Chinese Circulation Journal, 2014,29:466.)
近些年来,学者们发现,血管重塑在动脉粥样硬化(AS)及一些心脑血管疾病中发挥重要作用,还参与其他一些疾病的病理生理过程,管壁结构发生改变的过程至少包括细胞增生、细胞凋亡、细胞迁移及细胞外基质合成降解等过程,血管除了能代偿性扩张外,还可发生慢性收缩[1]。目前血管重塑的机制并不是很清楚,可能与血流动力学刺激、细胞外基质改变、平滑肌细胞增殖、凋亡、迁移及炎性反应损伤等有关。血管重塑参与AS疾病的发生、发展、结局,并与血管成形术后再狭窄密切相关[2]。本实验在建立高血脂和慢性感染模型的基础上,探讨了高血脂和慢性炎症导致血管重塑的病生理机制。
1 材料和方法
材料:本实验时间:2010-09至2013-09。胆固醇购自武汉诺辉酶制剂厂。脂多糖(LPS O55:B5)、弗氏完全佐剂购自美国Sigma公司。高脂饲料的配制:1 %胆固醇、5 %猪油及94 %基础饲料。血清基质金属蛋白酶-9(MMP-9)、基质金属蛋白酶组织抑制剂(TIMP-1)、I型胶原C末端肽(CTX-1)、ELISA试剂盒均购自盒购自美国R&D System公司。Masson染液(丽春红染液、0.5 %冰醋酸、1 %磷钼酸、亮绿染液、苏木素染液)由天津市胸科医院病理科供。
动物分组及处理:35只8月龄雄性新西兰大白兔(体重2.5~3.5kg,购自中国医学科学院放射医学研究所实验动物中心)。将实验兔单笼饲养普通饲料1周,随机分为4组:对照组(n= 5)、高脂组(n=10)、脂多糖组(n= 10)和高脂+脂多糖组 (n=10)。对照组和脂多糖组兔喂食普通饲料,150 mg/d,高脂组和高脂+脂多糖组兔喂食已制备好的高脂饲料,150 mg/d,所有动物均自由饮水,持续喂养至16周。脂多糖组和高脂+脂多糖组的实验兔在4、8、12周,于背部皮下注射LPS乳化剂(0.5 mg/ml,弗氏完全佐剂和LPS按体积比1:1配制),采取小剂量多点注射的方法,每只兔注射LPS乳化剂总量为4 ml。四组实验兔均饲养观察至16周。各组兔分别于实验开始、8周、12周及16周末处死前取血行血液生化检测。于16周末取耳缘静脉注射20%乌拉坦溶液后处死动物,剥取主动脉弓起始部约2.0 cm动脉段,10 %中性甲醛液固定、包埋、切片。
检测指标:Masson染色,利用病理图像分析系统(HMIAS-2000型)摄片,观察动脉壁结构及成分变化,并测量内膜厚度(IT)、中膜厚度(MT)和IT/ MT比值,每个切片均测量3次,取其平均值。检测血清高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。ELISA法检测血清MMP-9、TIMP-1、CTX-1。
统计学分析:采用SPSS19.0统计学软件进行统计学分析,所有数据以均数±标准差表示,计量资料经K-S检验证实均符合正态分布,采用单因素方差分析进行计算,以P<0.05为差异有统计学意义。
2 结果
四组实验兔Masson染色主动脉壁结构及成分的变化:Masson染色结果平滑肌细胞呈红色,胶原纤维呈绿色。对照组主动脉壁各层结构清晰,内膜平整光滑,未见明显泡沫细胞及炎细胞浸润,内弹力板完整,中膜平滑肌细胞排列整齐(图1、图2)。高脂组内膜增厚,内弹力板部分断裂,内膜下可见脂质沉积、数层多量泡沫细胞、少量炎细胞浸润,可见少量平滑肌细胞迁移、胶原纤维沉积;中膜平滑肌细胞排列较整齐,可见平滑肌细胞少量增生(图3、图4)。脂多糖组内膜增厚,内弹力板断裂较高脂组增多,内膜下亦可见脂质沉积、多量泡沫细胞、炎性细胞浸润,可见平滑肌细胞迁移,胶原纤维沉积;中膜平滑肌细胞排列较整齐,平滑肌细胞少量增生(图5、图6)。高脂+脂多糖组较其他三组内膜明显增厚,内弹力板中段甚至消失,平滑肌细胞增生明显,胶原沉积,中膜明显萎缩(图7、图8)。
Masson染色分析高脂和脂多糖对四组实验兔主动脉内膜和中膜厚度的影响:高脂组、脂多糖组及高脂+脂多糖组与对照组比较,IT厚度和IT/MT的比值均增加,高脂+脂多糖组比对照组的MT厚度降低;高脂+脂多糖组与高脂组和脂多糖组比较,IT厚度和IT/MT的比值均增加,MT厚度降低,差异均有统计学意义(P<0.05)。表1
四组实验兔血脂水平在不同时间点的变化比较:进食高脂饲料8周后,高脂组、高脂+脂多糖组的血清高密度脂蛋白胆固醇及低密度脂蛋白胆固醇水平较对照组和脂多糖组均增高,差异有统计学意义(P<0.01)。表2
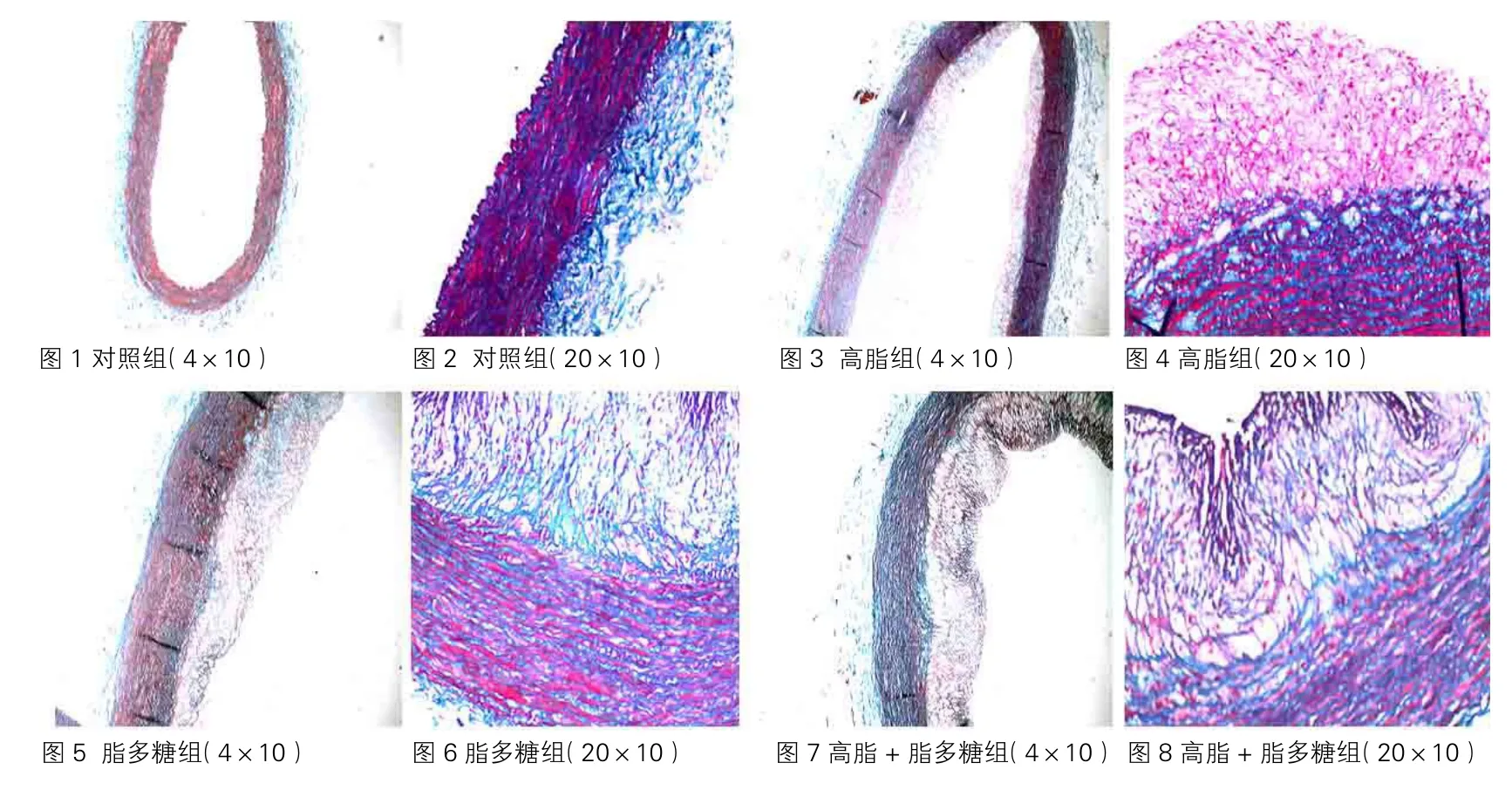
图1~8 四组实验兔Masson染色主动脉壁结构及成分的变化
表1 Masson染色分析高脂和脂多糖对四组实验兔主动脉内膜和中膜厚度的影响

表1 Masson染色分析高脂和脂多糖对四组实验兔主动脉内膜和中膜厚度的影响
注:与对照组比较*P<0.01;与高脂组比较△P<0.05;与脂多糖组比较▲P<0.05。IT:主动脉内膜 MT:中膜厚度
对照组(n=5)高脂组(n=10)脂多糖组(n=10)高脂+脂多糖组(n=10) IT (μm) 7.92±1.44 70.47±2.22* 78.28±8.76*152.84±24.08*△▲MT (μm) 181.62±12.57 179.75±12.55 181.07±13.57 82.80±5.44*△▲IT/MT (%) 4.34±0.54 39.31±2.00* 43.36±4.99*184.22±23.38*△▲
表2 四组实验兔血脂水平在不同时间点的变化比较(,mmol/L)
注:与对照组比较*P<0.01;与脂多糖组比较△P<0.01
对照组(n=5)高脂组(n=10)脂多糖组(n=10)高脂+脂多糖组(n=10)高密度脂蛋白胆固醇0周 0.52±0.08 0.47±0.12 0.48±0.10 0.49±0.13 8周 0.60±0.13 4.59±1.09*△ 0.54±0.20 4.20±1.56*△12周 0.49±0.14 5.43±1.52*△ 0.50±0.14 4.33±0.75*△16周 0.45±0.20 7.04±1.80*△ 0.45±0.19 5.15±0.61*△低密度脂蛋白胆固醇0周 0.62±0.11 0.47±0.11 0.47±1.19 0.50±0.11 8周 0.67±0.19 13.93±3.28*△ 0.65±0.20 13.25±3.02*△12周 0.89±0.26 15.52±2.59*△ 0.88±0.15 15.40±2.81*△16周 0.75±0.27 15.77±2.57*△ 0.63±0.22 16.80±1.45*△
表3 高脂和脂多糖对四组兔血清MMP-9、TIMP-1、CTX-1水平及MMP-9/TIMP-1比例的影响(,ng/ml)
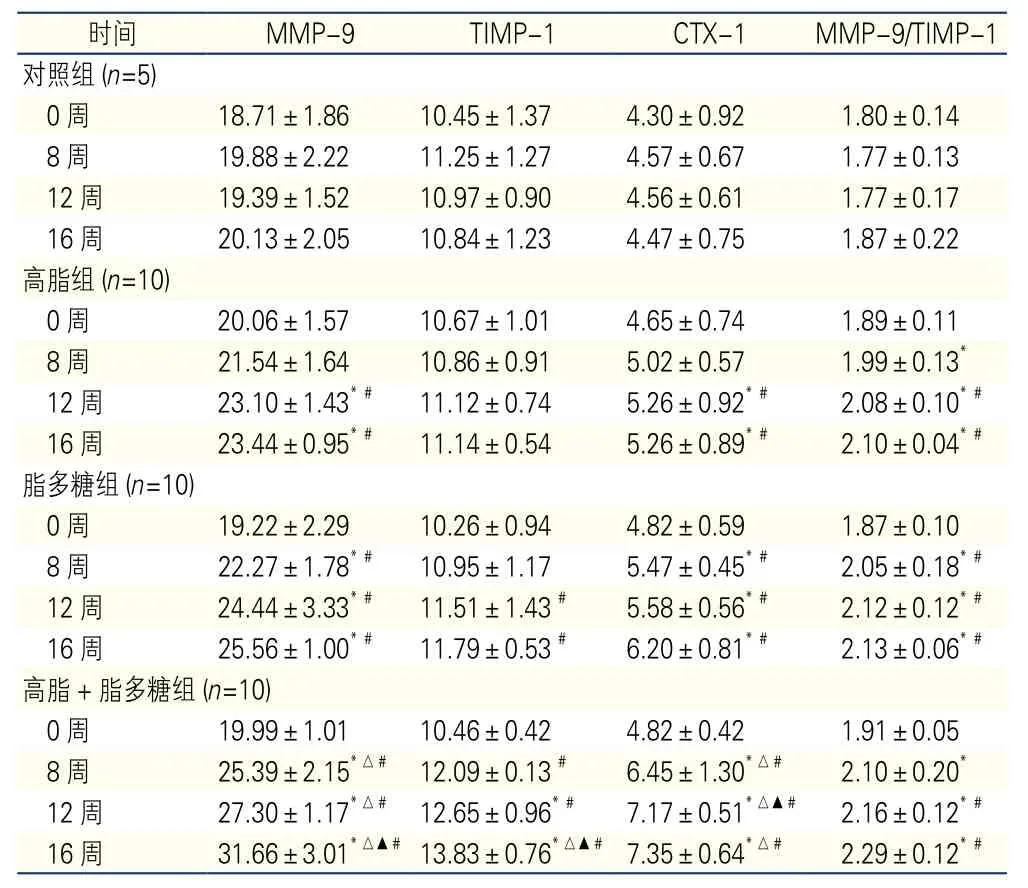
表3 高脂和脂多糖对四组兔血清MMP-9、TIMP-1、CTX-1水平及MMP-9/TIMP-1比例的影响(,ng/ml)
注:与同期对照组比较*P<0.05 ; 与同期高脂组比较△P<0.05 ;与同期脂多糖组比较▲P<0.05 ;与本组0周比较为#P<0.05。MMP-9:基质金属蛋白酶-9 TIMP-1:基质金属蛋白酶组织抑制剂 CTX-1 :I型胶原C末端肽
时间 MMP-9 TIMP-1 CTX-1 MMP-9/TIMP-1对照组(n=5) 0周 18.71±1.86 10.45±1.37 4.30±0.92 1.80±0.14 8周 19.88±2.22 11.25±1.27 4.57±0.67 1.77±0.13 12周 19.39±1.52 10.97±0.90 4.56±0.61 1.77±0.17 16周 20.13±2.05 10.84±1.23 4.47±0.75 1.87±0.22高脂组(n=10) 0周 20.06±1.57 10.67±1.01 4.65±0.74 1.89±0.11 8周 21.54±1.64 10.86±0.91 5.02±0.57 1.99±0.13*12周 23.10±1.43*# 11.12±0.74 5.26±0.92*# 2.08±0.10*#16周 23.44±0.95*# 11.14±0.54 5.26±0.89*# 2.10±0.04*#脂多糖组(n=10) 0周 19.22±2.29 10.26±0.94 4.82±0.59 1.87±0.10 8周 22.27±1.78*# 10.95±1.17 5.47±0.45*# 2.05±0.18*#12周 24.44±3.33*# 11.51±1.43# 5.58±0.56*# 2.12±0.12*#16周 25.56±1.00*# 11.79±0.53# 6.20±0.81*# 2.13±0.06*#高脂+脂多糖组(n=10) 0周 19.99±1.01 10.46±0.42 4.82±0.42 1.91±0.05 8周 25.39±2.15*△# 12.09±0.13# 6.45±1.30*△# 2.10±0.20*12周 27.30±1.17*△# 12.65±0.96*# 7.17±0.51*△▲# 2.16±0.12*#16周 31.66±3.01*△▲# 13.83±0.76*△▲# 7.35±0.64*△# 2.29±0.12*#
高脂和脂多糖对四组实验兔血清MMP-9、TIMP-1、CTX-1浓度及MMP-9/TIMP-1值的比较:高脂饲养8周后:高脂组与对照组同期比较,MMP-9浓度(12、16周) 、CTX-1浓度(12、16周)及MMP-9/TIMP-1(12、16周)均增加;高脂组与本组0周时比较,MMP-9浓度(12、16周)、CTX-1浓度(12、16周)及MMP-9/TIMP-1 (8、12、16周)均增加;脂多糖组与对照组同期及本组0周比较,MMP-9 浓度(8、12、16周)、TIMP-1浓度(高脂组12、16周)、CTX-1浓度(8、12、16周)及MMP-9/TIMP-1(8、12、16周)均增加;高脂+脂多糖组与对照组同期比较,MMP-9 浓度、TIMP-1浓度(12、16周)、CTX-1浓度及MMP-9/TIMP-1值均增加;高脂+脂多糖组与高脂组同期比较,MMP-9 浓度、TIMP-1浓度(16周)、CTX-1浓度均增加;高脂+脂多糖组与脂多糖组同期比较,MMP-9 浓度(16周)、TIMP-1浓度(16周)、CTX-1浓度(12周)均增加;高脂+脂多糖组与本组0周比较,MMP-9 浓度、TIMP-1浓度、CTX-1浓度及MMP-9/TIMP-1值(12、16周)均增加;差异均有统计学意义(P<0.05)。表3
3 讨论
流行病学资料提示,高血脂和慢性炎症是AS的重要危险因素[3]。低密度脂蛋白(LDL)的升高与AS的发生呈正相关。AS斑块中存在巨噬细胞、活化T细胞、肥大细胞等,感染和炎症反应是引起粥样斑块形成和不稳定的因素[4,5]。近些年来,学者们发现,血管重塑在AS及一些心脑血管疾病中发挥重要作用 。血管重塑是指血管腔面积及形态、血管壁结构及成分、血管功能的慢性改变。目前血管重塑的机制并不是很清楚,部分研究认为与血流动力学刺激、细胞外基质改变、平滑肌细胞增殖、凋亡、迁移及炎性反应损伤等有关[6,7]。基质金属蛋白酶(MMPs)在血管平滑肌细胞(VSMC)的迁移和基质重构方面发挥着重要作用[8]:一方面VSMC增生迁移分泌大量的细胞外基质;另一方面又产生MMPs,使基质不断降解。MMPs活性增强可促进动脉粥样斑块纤维帽中的基质成分的降解,使纤维帽变薄,粥样斑块易发生破裂而并发血栓形成。 研究发现[9,10],MMP-9等炎症因子在动脉粥样硬化组织中显著高表达,进一步阐明了炎症因子在动脉粥样硬化发生发展过程中起重要作用。TIMPs由与产生MMPs同样的细胞合成、分泌,对所有的MMPs均具有抑制作用。但高血脂和慢性炎症导致血管重塑的病生理过程尚需较为深入的探讨。本研究发现,单纯高血脂或慢性炎症均可引起内膜增厚,内弹力板部分断裂,内膜下脂质和胶原纤维沉积、泡沫细胞和炎细胞浸润、少量平滑肌细胞迁移,中膜平滑肌细胞少量增生。这既是动脉粥样硬化的病理表现 ,也是血管重塑的病理学基础。而慢性感染性炎症反应与高血脂相互作用加重了病理表现,而出现内弹力板中断甚至消失、中膜萎缩、平滑肌细胞排列紊乱,进而出现内膜厚度与中膜厚度比例失衡。提示高血脂和慢性炎症反应可能是动脉粥样硬化和血管重塑的共同致病因素,在二者的交互作用下动脉粥样硬化和血管重塑过程可以同时启动和进展。
脂代谢紊乱[11,12]时,低密度脂蛋白通过内膜进入动脉内皮下层被氧化修饰后可被巨噬细胞吞噬而变成泡沫细胞,释放出大量胆固醇,氧化的低密度脂蛋白一方面可通过诱导内皮细胞和平滑肌细胞增生、移行等促进血管重塑;另一方面可通过增加基质金属蛋白酶的活性,促进细胞外基质降解,从而促进血管重塑。本研究发现,高脂饮食早期即可引起低密度脂蛋白胆固醇的升高,且同步出现MMP-9升高,随后逐渐缓慢出现MMP-9/TIMP-1比值、CTX-1的升高,而脂多糖刺激并不影响血清LDL水平。提示单纯高血脂即可通过胶原降解而引发血管重塑的初始进程。
近年来研究发现炎症反应是动脉结构与功能的重要影响因素[13]。本研究发现,慢性炎症刺激可以不需要高血脂基础而独立诱导血清MMP-9、MMP-9/TIMP-1比值升高,出现胶原降解、CTX-1升高。在血脂升高时,慢性炎症反应在原有MMPs高表达的基础上,进一步促进了脂质的吞噬、氧化和细胞损伤过程,使MMPs分泌进一步增加,加速了胶原的降解和细胞的迁移、增殖、损伤、凋亡,从而导致血管重塑。
综上所述,高血脂和慢性炎症反应可能是动脉粥样硬化和血管重塑的共同致病因素,两因素同时存在的情况下对机体的影响明显增强,在二者的交互作用下动脉粥样硬化和血管重塑过程可以同时启动和进展。慢性炎症反应可通过影响胶原代谢促使血管重塑,进而促进AS的形成及进展。其可能机制为:炎症反应—炎细胞活化—释放MMPs及炎症因子—促使平滑肌细胞增殖、向内膜迁移及表型转化—加重炎症反应及进一步促进MMPs释放—胶原合成降解失衡—血管重塑。移入内膜的VSMC合成大量胶原纤维,使内膜增厚构成AS斑块的重要成分,同时合成、分泌大量细胞因子及MMPs降解中膜胶原;随着VSMC的迁移和凋亡,中膜VSMC减少,胶原合成减少,中膜萎缩变薄。提示我们在临床上对于冠心病及其他动脉粥样硬化疾病积极控制危险因素的同时,通过抑制炎症反应调节胶原代谢可能会成为今后防治AS的方法之一。
[1]Glagov S, Weisenberg E, Zarins CK, et al. Compensatory-enlargement of human atherosclerotic coronary arteries. N Engl J Med, 1987, 316: 1371-1375.
[2]LafontA, Guzman LA, Whitlow PL, et al. Restenosis after experimental angioplasty. Intimal, medial, and adventitial changes associated with constrictive remodeling. Circ Res, 1995, 76: 996-1002.
[3]Skalen K, Gustafsson M, Rydberg EK, et al. Subendothelial retention of atherogenic Lipopro-teins in early atherosclerosis . Nature, 2002, 417: 750-754.
[4]程翔,廖玉华.炎症与动脉粥样硬化.中华心血管病杂志, 2004,32: 475-477.
[5]Cecilia G, Georg W. The autoimmune concept of atherosclerosis. Curr Opin Lipidol, 2011, 22 : 327-334.
[6]Matsuo Y, TaKumi T, Mathew V , et al. Plaque characteristics and arterial remodeling in coronary and peripheral arterial sustems. Atherosclerosis, 2012, 223: 365-371.
[7]Hong YJ, Jeong Mh, Choi YH, et al. Positive remodeling is associated with vulnerable coronary plaque components regardless of clinical reswntation: virtual histology-intravasculat ultrasound analusis . Int J Cardiol,2012, 80: 1352-1355.
[8]Lan TH, Huang XQ, Tan HM. Vascular fibrosis in atherosclerosis . Cardiovasc Pathol, 2013, 22: 401-407.
[9]李晶,裘毅刚,张蓉, 等. 炎症因子在人动脉粥样硬化组织的表达分析. 中国循证心血管医学杂志,2012, 4: 25-217.
[10]黄文军,刘俊明,高霞等,血清基质金属蛋白酶-2 ( MMP-2)和MMP-9与急性冠状动脉综合征的相关研究. 中国循环杂志, 2013,28:103-106.
[11]金喆, 李敬伟, 康宁, 等. 冠状动脉血管重塑与脂代谢异常及斑块稳定性关系的初探. 天津医药, 2010, 38 : 852-855.
[12]徐瑞霞,李建军. 氧化型低密度脂蛋白胆固醇与动脉硬化. 中国循环杂志,2013, 3, 223.
[13]Park S, Lakatta EG. Role of inflammation in the pathogenesis of arterial stiffness . Yonsei Med J, 2012, 53 : 258-261.
Investigation of LPS Induced Arterial Vascular Remodeling in High Fat Diet Rabbits
HAN Qiong, LI Yan-yan, DU Fei, FENG Jin-ping.
Department of Cardiology, Tianjin Medical University, Tianjin (300051), China
Objective: To study the pathophysiological mechanism of arterial vascular remodeling in rabbits with hyperlipidaemia and chronic inf l ammation.
Inf l ammation; Atherosclerosis; Vascular smooth muscle cell; Collagen
2014-01-07)
(助理编辑:曹洪红)
300051 天津市,天津医科大学(韩琼),天津胸科医院 心内科(李燕燕、杜菲、冯津萍)
韩琼 主治医师 硕士 主要从事冠心病发病与炎症反应关系的研究 Email:hq991627qwert@163.com 通讯作者:冯津萍 Email:chlfjp@sina.com
R541
A
1000-3614(2014)06-0466-05
10.3969/j.issn.1000-3614.2014.06.018

