一贯煎治疗二甲基亚硝胺致小鼠肝纤维化的机制研究
张 媛,朱 英
(大连医科大学 附属第一医院 感染科,辽宁 大连116011)
肝硬化是指由各种致病因子所致肝内结缔组织异常增生,导致肝内弥漫性细胞外基质(extracellular matrix,ECM)过度沉积,伴随肝细胞损伤、肝功能障碍、肝脏纤维化的慢性疾病。肝纤维化逆转的关键在于肝内异常增生的病理性结缔组织的降解与损伤肝脏实质细胞的再生。在肝纤维化发生和逆转过程中有很多细胞因子发挥调控作用[1]。近年的大量研究表明,在抗肝脏纤维化的治疗中,中药方剂在综合药理治疗作用方面有着独特优势[2]。
本研究应用二甲基亚硝胺(DMN)造成小鼠肝纤维化模型,观察在造模及治疗阶段的小鼠肝功能的动态变化及应用一贯煎治疗后信号通路中相关蛋白表达情况,分析研究一贯煎在改善肝纤维化方面的作用。
1 材料和方法
1.1 研究对象
昆明小鼠205 只,雌雄不限,4 ~6 周龄,体重16 ~22 g,购于大连医科大学实验动物中心[合格证书编号:SCXK(辽)2008 -0002],于大连医科大学附属第一医院中心实验室清洁级动物房饲养,自由饮食,饮自来水,环境温度20 ~25 ℃,相对湿度60% ~80%。
1.2 主要试剂与设备
二甲基亚硝胺(Dimethylnitrosamine,DMN)为东京化成工业株式会社产品:lot. MAL05。兔抗鼠SDF-1 (ab25117)、Phospho - NF - κB (p65)(ab16502)、Wnt -1(ab135610)、CXCR4(ab2074)、ERK1 + 2(ab17942)、β - catenin(ab32572)、α -SMA(ab66133)均为abcam 公司产品。快捷性酶标羊抗鼠/兔LgG 聚合物、DAB 显色盒,柠檬酸组织抗原修复液(100 ×)均为北京迈新公司产品。3%过氧化氢去离子水,为北京中杉金桥产品。OLYMPUS-AU2700 全自动生化分析仪配套试剂。一贯煎按照原方比例和制法制备(《柳洲医话》北沙参9 g、麦冬9 g、当归9 g、生地18 g、枸杞9 g、川楝子5 g 共59 g),大连医科大学附属第一医院中药房煎制,冷藏干燥,闭光保存。肝细胞生长因子注射液(威海赛洛金药业有限公司生产,执行标准WS1 -9(X -103)-2004Z,批准文号:国药准字H20010003);OLYMPUS-AU2700 全自动生化分析仪。
1.3 肝纤维化模型制备及治疗方法
参照Jenkins 等[3]介绍的方法制备DMN 肝纤维化模型。将205 只小鼠分为模型组185 只,正常对照组20 只,模型组按DMN 10 mg/kg 剂量腹腔注射,正常对照组腹腔注射同等量生理盐水,每周连续3 d,1 次/d,共4 周。观察小鼠一般状况,于造模2 周及4 周处死模型组与正常对照组小鼠10 只检测血清生化肝功、行肝组织HE 染色及免疫组化染色。
造模4 周后将模型组小鼠随机分为一贯煎组、阳性对照组即HGF 组及空白组,一贯煎组按0.01 mL/g·d 药物稀释液灌胃给药,HGF 组应用HGF 200 μg/kg 皮下注射,空白治疗组以同体积生理盐水给予相应处理,各组均1 次/d 给药共4 周。各组于给药2 周时分别处死20 只,给药4 周时处死剩余小鼠,观察及处理因素同前。
1.4 样品的采集
小鼠麻醉后取血清,取1.0 cm ×0.8 cm ×0.3 cm 大小肝组织,10%中性福尔马林液固定24 h 后逐级酒精脱水,二甲苯透明,56 ℃石蜡包埋,用于HE 染色及免疫组化染色检测。
1.5 观察项目与方法
1.5.1 一般状况观察:包括小鼠的死亡情况、体重、进食、饮水、活动情况及毛发变化等。
1.5.2 肝功能检测:ALT、AST、ALB、TBIL、DBIL、CHE、ALP、GGT。
1.5.3 肝组织肉眼及镜下病理学改变:按文献[4]肉眼观察小鼠肝脏的外形、体积、颜色及质地的改变,HE 染色显微镜下观察肝组织切片的病理变化,重点观察肝细胞变性、坏死及肝纤维化的程度(α -SMA 蛋白检测)。
1.5.4 免疫组化检测:肝组织石蜡切片经脱蜡、水化、抗原修复、一抗二抗孵育、DAB 染色、苏木素复染、盐酸酒精分化、脱水透明后做半定量免疫组化分析,依据Image pro plus 6.0 电脑分析辅助与自动测量程序图像分析系统(Carl Zeiss)。
1.5.5 一贯煎对肝纤维化小鼠多种信号通路上相关蛋白的影响:肝组织SDF -1、Phospho -NF -κB(p65)、Wnt -1、CXCR4、ERK1 +2、β - catenin 分析,采用免疫组化法,分析方法同上。
1.6 统计学方法
所有实验数据以均值±标准差表示,采用SPSS 19.0 分析数据计量资料,用ANOVA 程序进行单因素方差分析,并用LSD 程序进行两两比较;多个样本率的比较应用行列表的卡方检验,以P <0.05 为差异有统计学意义。
2 结 果
2.1 小鼠一般情况比较
实验过程中发现腹腔给药注射DMN 后,小鼠表现焦躁,易激怒;注射药物后约5 h 逐渐趋于平静,活动减少,造模4 天后情况有所改善,在第7 天表现基本恢复正常。进食量饮水量各组小鼠没有明显差别。实验中均有死亡(各组死亡情况详见表1)。模型组小鼠毛发稀疏,有脱落,活动量少,少量有腹水症状。一贯煎治疗后上述症状有所改善,死亡率逐渐降低,且一贯煎组死亡率低于空白组(P =0.043,P <0.05)。

表1 各组小鼠死亡率Tab 2 Mortality of mice in each group
2.2 肝脏血清生化指标比较
2.2.1 模型组与正常对照组血清生化比较:ALT 在造模第2 周有显著性增高(P=0.048,P <0.05),造模第4 周较造模第2 周增高不明显(P =0.183,P >0.05);AST 在造模2 周增加不明显(P =0.223,P >0.05),在第4 周明显增高(P=0.000,P <0.05),且第4 周明显高于第2 周(P =0.000,P <0.05);ALB在造模第2 周明显降低(P=0.003,P <0.05),并且随着造模的进行在第4 周ALB 明显低于造模第2周(P=0.000,P <0.05);TBIL 在造模第2 周便有明显增高(P=0.023,P <0.05),造模第4 周较造模第2 周增高不明显(P =0.991,P >0.05);DBIL 在造模第4 周有明显升高(P=0.000,P <0.05),且在造模第4 周明显高于造模第2 周(P =0.002,P <0.05);CHE 在造模第4 周明显降低(P=0.004,P <0.05),第4 周较第2 周降低不明显(P =0.057,P >0.05);ALP 在造模第4 周有明显增高(P=0.014,P <0.05),第4 周与第2 周变化无显著性意义(P =0.09,P >0.05);GGT 在造模前后差异无显著性意义(P >0.05)。见表2。
2.2.2 治疗阶段各组血清生化比较:与空白组比较,一贯煎组ALT 在第2 周明显降低(P =0.000,P <0.05),第4 周较第2 周无明显降低(P =0.160,P >0.05);AST 在第2 周明显降低(P =0.000,P <0.05),第4 周较第2 周无明显降低(P =0.080,P >0.05);ALB 在第2 周明显增高(P = 0. 001,P <0.05),第4 周较第2 周无明显增高(P =0.066,P >0.05);CHE 在第2 周无明显升高(P =0.181,P >0.05),第4 周明显升高(P=0.000,P <0.05),且第4 周较第2 周增加(P=0.001,P <0.05);ALP 在第2 周无明显降低(P =0.202,P >0.05),第4 周时明显降低(P =0.037,P <0.05);TBIL,DBIL,GGT 在治疗前后差异无显著性意义(P >0.05)。一贯煎组与HGF 组随治疗时间分别对比各指标差异均无显著性意义(P >0.05)。见表3。

表2 模型组及正常对照组血清肝功生化指标Tab 2 Serum biochemical markers of liver function in model groups and control group
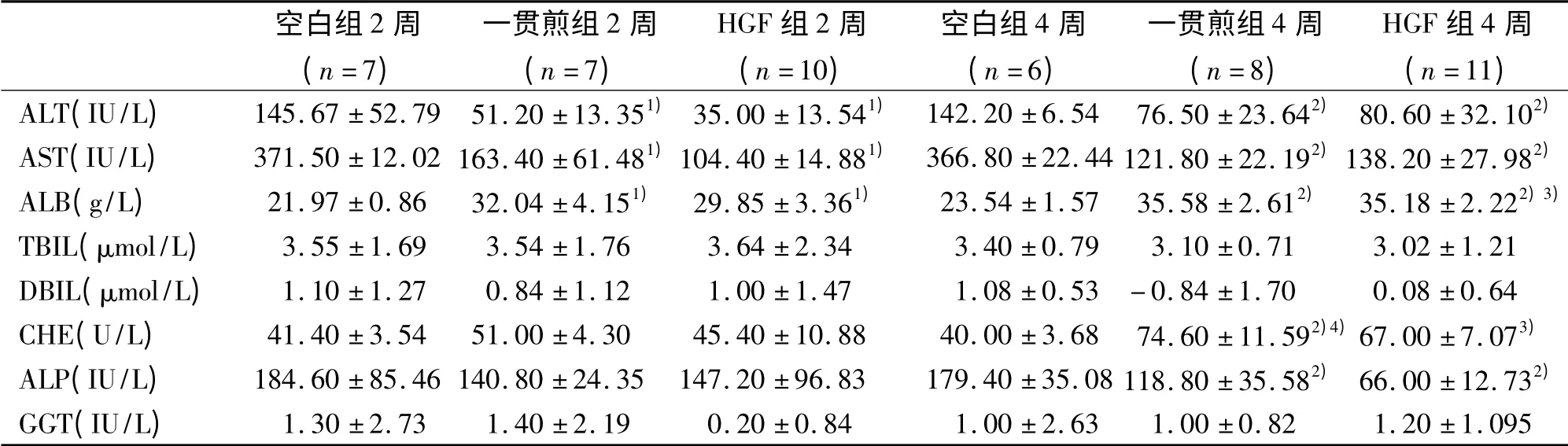
表3 空白组、一贯煎组及HGF 组血清肝功能生化指标Tab 3 Serum biochemical markers of liver function in control group,Yiguanjian group and HGF group
2.3 肝组织病理学变化
2.3.1 肉眼观察:正常对照组肝脏呈红褐色,表面光滑质软;模型组肝脏明显肿胀,色苍黄,部分肝表面呈结节状,质硬,油腻。
一贯煎组与HGF 组部分肝脏轻度肿大,黄褐色,表面尚光滑,较模型组轻,尤以一贯煎组较明显。
2.3.2 肝组织HE 染色变化:光镜下正常对照组小鼠的肝组织肝小叶结构清晰,肝细胞条索由中央静脉向四周呈放射状排列。汇管区可见极少量纤维结缔组织,偶见成纤维细胞。造模2 周时少量肝细胞肿胀胞质疏松,有较粗的纤维间隔向小叶伸展,肝窦充血扩张。造模4 周时可见大面积出血性坏死并见大量肿胀的肝细胞,汇管区明显增宽,大量淋巴细胞浸润,部分肝细胞呈结节样异常再生,有假小叶形成。
一贯煎组2 周肝细胞炎症减轻,纤维间隔致密变细,假小叶较模型组4 周时减少,可见一贯煎组及HGF 组不完全纤维间隔,一贯煎组4 周与HGF 组4周肝组织炎症明显消退。见图1。

图1 肝组织HE 染色 (×200)Fig 1 HE staining of liver tissue
2.3.3 肝组织α-SMA 蛋白表达变化:DMN 造模4周后α-SMA 表达明显多于正常对照组,主要集中在汇管区、纤维间隔及肝窦附近。一贯煎组2 周可见α-SMA 表达减少,一贯煎组4 周时α -SMA 表达明显少于模型组4 周。见图2。
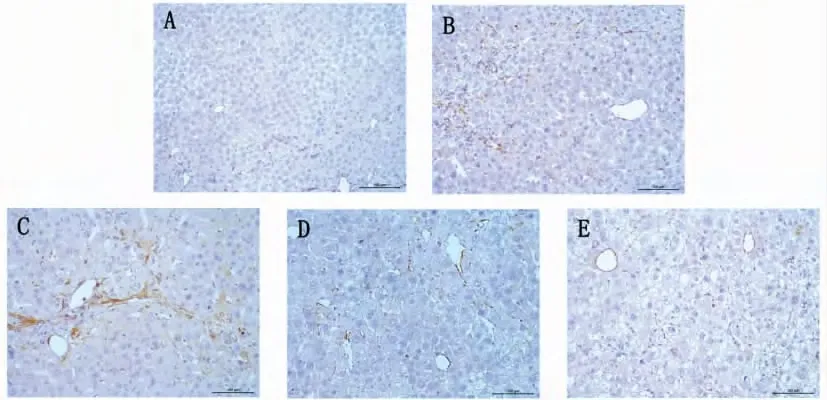
图2 肝组织α-SMA 免疫组化染色 (×200)Fig 2 Immunohistochemistry of α-SMA in liver tissue
2.4 肝纤维化小鼠信号通路相关蛋白变化
2.4.1 SDF -1 蛋白免疫组化表达变化:一贯煎组2 周表达多于空白组2 周(P =0.012,P <0.05),一贯煎4 周表达多于空白组4 周(P = 0. 009,P <0.05),一贯煎4 周表达显著多于一贯煎2 周(P =0.008,P <0.05),表达主要位于汇管区及肝窦附近的细胞间质。见图3。
2.4.2 CXCR4 蛋白免疫组化表达变化:一贯煎组2周表达显著多于空白组2 周(P=0.031,P <0.05),一贯煎4 周表达多于空白组4 周(P =0.028,P <0.05),一贯煎4 周多于一贯煎组2 周(P =0.04,P <0.05),表达主要位于汇管区及肝窦附近的细胞膜。见图4。

图3 肝组织SDF-1 免疫组化染色 (×400)Fig 3 Immunohistochemistry of SDF-1 in liver tissue
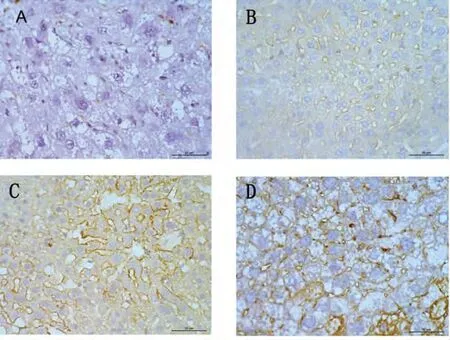
图4 肝组织CXCR4 免疫组化染色 (×400)Fig 4 Immunohistochemistry of CXCR4 in liver tissue
2.4.3 Wnt-1 蛋白免疫组化表达变化:一贯煎组2 周表达少于空白组2 周(P =0.038,P <0.05),一贯煎组4 周表达少于空白组4 周(P =0.022,P <0.05),一贯煎4 周少于一贯煎2 周(P =0.029,P <0.05),表达主要位于汇管区及肝窦附近的细胞间质。见图5。

图5 肝组织Wnt-1 免疫组化染色 (×400)Fig 5 Immunohistochemistry of Wnt-1 in liver tissue
2.4.4 β-catenin 蛋白免疫组化表达变化:一贯煎组2 周表达较空白组2 周少(P =0.041,P <0.05),且一贯煎组4 周较空白组4 周少(P =0.011,P <0.05),一贯煎2 周与一贯煎4 周比较无显著性差异(P=0.082,P >0.05),主要位于汇管区及肝窦附近的细胞质。见图6。
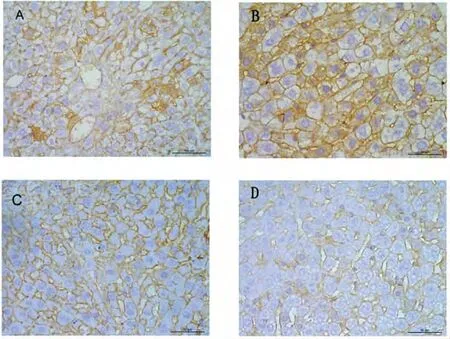
图6 肝组织β-catenin 免疫组化染色 (×400)Fig 6 Immunohistochemistry of β-catenin in liver tissue
2.4.5 NF-κB p65 蛋白免疫组化表达变化 空白组4 周阳性染色与空白组2 周比较差异有显著性意义(P=0.39,P <0.05),一贯煎组2 周表达少于空白组2 周(P=0.045,P <0.05),一贯煎组4 周与空白组4 周比较差异有显著性意义(P =0.012,P <0.05),主要位于汇管区肝窦附近细胞质。见图7。
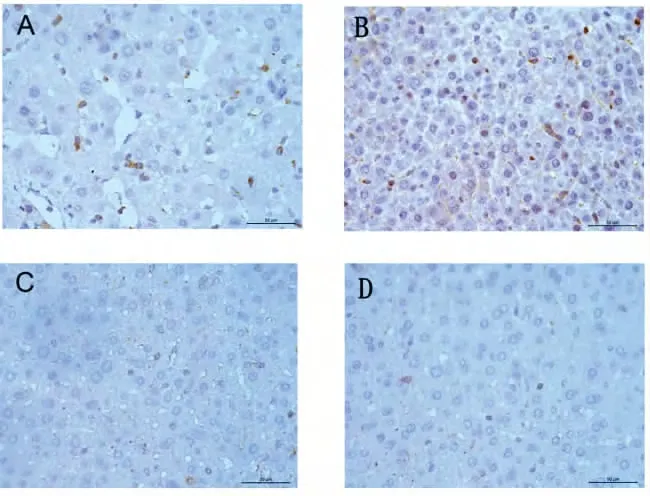
图7 肝组织NF-κB p65 免疫组化染色 (×400)Fig 7 Immunohistochemistry of NF-κB p65 in liver tissue
2.4.6 ERK1 +2 蛋白免疫组化表达变化:一贯煎组2 周细胞质阳性表达多于空白组2 周(P =0.045,P <0.05),一贯煎组4 周细胞质阳性表达多于空白组4 周(P=0.035,P <0.05),一贯煎组4 周阳性染色明显多于一贯煎组2 周(P =0.027,P <0.05),主要位于汇管区肝窦附近细胞质。见图8。

图8 肝组织ERK1 +2 免疫组化染色 (×400)Fig 8 Immunohistochemistry of ERK1 +2 in liver tissue
3 讨 论
目前肝纤维化及早期肝硬化组织重构成为现在医学研究的重要领域,现有研究显示肝脏中有干细胞参与肝细胞再生及肝脏损伤修复,同时多种来源的干细胞有向肝细胞诱导分化的迹象[5],并且很多研究探讨干细胞在肝损伤中作用机制。本课题组前期工作已经证实,在肝硬化模型的进展和逆转过程中,存在骨髓间充质干细胞向肝细胞转化[6],因此本研究将进一步探讨一贯煎促进干细胞肝向分化的作用机制。
一贯煎具备养阴功能可诱导肝脏卵圆细胞向肝细胞分化,重塑损伤的肝脏组织,改善肝功能[7]。本研究中应用一贯煎治疗肝纤维化小鼠后,肝脏生化指标ALB、CHE、ALP、GGT、TBIL、DBIL、ALT、AST均有不同程度改善,说明一贯煎具有改善肝纤维化后肝功能的作用。
基质细胞衍生因子-1(stromal cell derived factor-1,SDF-1)主要由骨髓基质细胞及不成熟的成骨细胞分泌,是一种对免疫细胞具有趋化作用且分子量较小的趋化因子蛋白[8]。当急性肝损伤后相关损伤部位的SDF-1 会分泌增加。CXCR4 是保守的7 次跨膜G 蛋白偶联受体超家族成员,广泛表达于单核细胞,淋巴细胞及所有的CD34+细胞表面,SDF-1 是已知的唯一能与CXCR4 受体结合产生效应的趋化因子[9]。本实验中一贯煎组2 周后出现阳性表达,随着治疗的进行SDF -1 及CXCR4 阳性表达增强,说明骨髓基质细胞参与肝细胞再生、肝功能恢复活动,一贯煎能诱导骨髓基质细胞参与肝细胞再生,参与肝纤维化。
经典Wnt 信号通路仅在器官发育、胚胎轴分化和细胞再生等过程中短暂发挥作用,而其异常持续活动与多种恶性肿瘤发生发展有关[10]。经典的Wnt 通路的传导模式是:细胞外的Wnt 蛋白与细胞膜上的受体Frizzled/LRP 结合启动Wnt 信号,抑制β-catenin 磷酸化。胞浆内未被磷酸化的β -catenin 蛋白可逃逸被泛素化水解系统降解的命运,继而进入细胞核内,与转录因子共同作用,激活靶基因转录[11]。β-catenin 蛋白作为Wnt 通路的重要成员,其蛋白稳定性和活性的调节是Wnt 通路中的关键事件之一,其在细胞内的异常累积是Wnt 通路激活的标志事件[12]。研究中一贯煎组及HGF 组在造模第4 周出现Wnt-1 及β-catenin 蛋白免疫组化阳性表达,值得进一步研究有无肝纤维化后肝癌发生倾向[13]。随着一贯煎治疗进行Wnt -1 及β -catenin蛋白阳性表达逐渐减弱,验证了一贯煎在通过经典Wnt 通路参与肝纤维化恢复,减少肝癌发生可能。
核因子κB (nuclear factor-κB,NF -κB)是一类转录因子,在体内各种型细胞中普遍存在。NFκB 家族蛋白在经典途径中可由多种刺激如细菌、病毒以及多种细胞因子激活由胞质进入胞核经典途径中,在未受刺激时p65/p50 组成的异源二聚体由于结合了NF-κB 抑制蛋白α(IκBα)而不能入核,当刺激发生后,NF -κB 能够入核并在核内发挥转录功能[14]。近年来的研究表明应用NF -κB 抑制剂后能有效地减慢肝纤维化进程[15]。本研究中一贯煎组及HGF 组的NF-κB p65 免疫组化表达均低于空白治疗组。说明一贯煎可以抑制NF -κB 活性,减少进一步损伤肝脏,减慢肝纤维化进程。
MAPK 在哺乳动物细胞中分为4 个亚族,即细胞外信号调节激酶(extracellular - signal regulated protenin kinase,ERK)、c - Jun 氨基末端激酶(c -Jun amino-terminal kinase,JNK)、p38 和ERK5[16]。目前认为,p38 和JNK 属于“应激诱导”的MAPK,而ERK 被认为是与细胞增殖,转化和分化相关的MAPK。ERK 是MAPK 家族的重要成员,包括两种异构体ERK1 及ERK2(分别为p44 和p42)。ERK级联反应包括典型的三个层次MAPKs 的序贯激活过程即MKKK (MAP kinase kinase kinase)→MAKK或MEK(MAP kinase kinase)→MAPK[17-18]。ERK激活对于Ras 诱导的细胞反应、转录因子(如ELKL、cEts1 和cEts2)的激活以及激酶(如P90rskl、MNKI 和MNK2)的激活是至关重要的。本研究中ERK 蛋白在应用一贯煎后阳性表达逐渐增加,说明在肝纤维化后有细胞增殖分化转化的发生。有待进一步证实参与细胞增殖分化的细胞种类,明确一贯煎有无诱导骨髓间质细胞参与肝细胞修复。
本课题研究表明,一贯煎可通过调控上述信号通路的作用,诱导骨髓干细胞向肝细胞分化,从而重构损伤肝组织,改善肝功能,为进一步应用一贯煎治疗肝纤维化的临床研究建立基础。然而本课题仍尚起步,有诸多不足,对于肝纤维化后新生肝脏细胞性质、来源以及体外鉴定有待于进一步研究。
[1] Pilat N,Unger L,Berlakovich GA. Implication for Bone Marrow Derived Stem Cells in Hepatocyte Regeneration after Orthotopic Liver Transplantation[J]. Int J Hepatol,2013,2013:310612.
[2] 王磊,刘平,慕永平,等.二甲基亚硝胺大鼠纤维化中医方证研究[J].中医杂志,2006,47(12):929 -932.
[3] Jenkins SA,Crandison A,Baxter JN,et al.A dimethylnitrosamine-induced model of cirrhosis and portal hypertension in the rat[J].J Hepatol,1985,1:489 -499.
[4] 杨玉林,贺志安. 肝脏疾病诊断指南[M]. 北京:中医药科技出版社,1996:355.
[5] Ceasare Campagnoli,Irene AG Roberts,Sailesh Kumar,et al. Identification of mesenchymal stem/progenitor cells in human first -trimester fetal blood,liver,and bone marrow[J].Blood,2001,98(8):2396 -2402.
[6] 朱英,刘平.Thy1.1 阳性肝脏卵圆细胞在大鼠肝硬化形成与消减过程中的动态表达[J]. 中华肝脏病杂志,2005,13(11):823 -827.
[7] 朱英,刘平.一贯煎对DMN 肝纤维化大鼠肝卵圆细胞增殖分化的影响[J]. 大连医科大学学报,2011,33(1):11 -16.
[8] Cheng JW,Sadeghi Z,Levine AD,et al.The role of CXCL12 and CCL7 chemokines in immune regulation,embryonic development,and tissue regeneration[J]. Cytokine,2014,69(2):277 -283.
[9] Liekens S,Schols D,Hatse S.CXCL12 -CXCR4 Axis in Angiogenesis,Metastasis and Stem Cell Mobilization[J].Curr Pharmaceut design,2010,16:3903 -3920.
[10] Kenneth C Valkenburg,Carrie R Graveel,Cassandra R Zylstra-Diegel,et al.Wnt/β-catenin Signaling in Normal and Cancer Stem Cells[J].Cancers,2011,3:2050 -2079.
[11] 尹定子,宋海云. Wnt 信号通路:调控机理和生物学意义[J].中国细胞生物学学报,2011,33(2):103 -111.
[12] 褚智君,崔燎.Wnt/β-catenin 信号通路与骨髓干细胞分化方向的关系研究[J]. 齐鲁药事,2012,31(7):417 -419.
[13] Sato N,Yamabuki T,Takano A,et al. Wnt inhibitor Dickkopf-1 as a target for passive cancer immunotherapy[J].Cancer Res,2010,70:5326 -5336.
[14] 楼希文,孙绍刚,王琛.转录因子NF -κB 的核内活性调控[J].细胞生物学杂志,2009,31(6):741 -748.
[15] 李伟伟,宋新文,王宏伟,等. 核转录因子-κB 与肝炎肝纤维化病理分期的相关性[J]. 中国免疫学杂志,2013,29:251 -254.
[16] Kyriakis J M,Avruch J. Mammalian mitogen -activated protenin kinase signal transduction pathway activated by stress and inflammation[J]. Physiol Rev,2001,81(2):807 -869.
[17] Marie Cargnello,Philippe P Roux.Activation and Function of MAPKs and Substrates,the MAPK-Activated Protenin Kinases[J]. Microbiology And Molecular Biology Rev,2011,75(1):50 -83.
[18] 龚小卫,姜勇.MAPK 的细胞内定位与激活后移位机制[J].生物化学与生物物理进展,2003,30(4):509 -513.
- 大连医科大学学报的其它文章
- 高频彩超在浆细胞性乳腺炎中的诊断价值

