胃肠道间质瘤的诊治分析
李盛波 郑勇斌 童仕伦 施强 罗海平 肖高春 郝志楠
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是胃肠道壁卡哈尔间质细胞来源的肿瘤,在胃肠道肿瘤中少见(约1%~4%)[1],但其在胃肠道间叶性肿瘤中占有重要位置。其临床症状缺乏特异性,术前确诊率较低,易延误诊治,为加深对GIST的了解,本研究回顾性分析我院自2003年1月至2013年6月收治的共72例GIST患者的临床资料,探讨分析其临床特点,以提高对GIST的认识及诊治水平。
资料与方法
一、一般资料
收集近10年来我院诊治的72例GIST患者的临床资料。其中男性37例、女性35例,男女比例为1.06∶1;年龄28~80岁,中位年龄61岁。各病例均经术后病理及免疫组织化学或再次免疫组织化学确诊。肿瘤发生部位:胃41例(56.94%)、小肠24例(33.33%),结直肠6例(8.33%,其中结肠2例,直肠4例),另外还有食管1例(1.39%)。
二、临床表现
GIST临床表现多样,本组患者以腹痛、消化道出血、腹部肿块常见,多数患者有多个伴随症状。在72例患者中,临床症状有腹痛34例(47.22%),为最常见的症状,消化道出血22例(30.56%),腹部肿块11例(15.28%),肠梗阻5例(6.94%),贫血6例(8.33%),吞咽困难1例(1.39%)。常见伴随症状有体重减轻、消瘦、黄疸、恶心呕吐、腹泻、便秘、里急后重等。病程1 d至8年,平均12.5个月。另外有2例无症状的GIST患者于体检时发现。
三、诊断
本组患者中,术前辅助检查包括超声、影像学(如CT、消化道造影等)、内镜检查并取可疑组织病理活检等。其中行消化道气钡双重造影检查19例,发现11例肠道占位性病变;行食管、胃及结直肠内镜检查56例,发现黏膜下隆起44例,超声内镜检查诊断黏膜下肿瘤9例,取活检明确诊断19例;小肠镜检查19例,发现小肠肿物8例;直肠指诊或肛镜检查发现1例;B超或CT检查45例,发现肿物29例;2例行肠系膜上动脉造影均发现小肠肿瘤;另腹腔镜或剖腹探查术中发现肿物4例。本组GIST均经病理结合免疫组织化学或再次免疫组织化学确诊,其免疫组织化学结果显示:CD117阳性率98.61%(71/72),DOG-1阳性率100.00%(18/18),CD34阳性率70.83%(51/72),α-平滑肌肌动蛋白(SMA)阳性率34.72%(25/72), S-100阳性率5.56%(4/72)。见图1~4。
四、治疗
本研究中所有患者均接受了手术治疗,除2例患者因肿瘤广泛浸润仅行姑息性手术外,其余70例均完整切除(病理证实切缘阴性),其中行腹腔镜手术19例(1例中转开腹)。行病变食管+近端胃切除术1例,胃肿瘤局部切除术13例,胃大部切除术20例,全胃切除术3例,根治性胃切除术3例,胰十二指肠切除术5例,部分小肠切除术16例,部分小肠+肝叶切除术1例,右半结肠切除术3例,部分结直肠切除术4例,腹会阴联合直肠切除术1例。伊马替尼辅助治疗21例[其中6例患者在GIST复发和(或)转移后服用]。
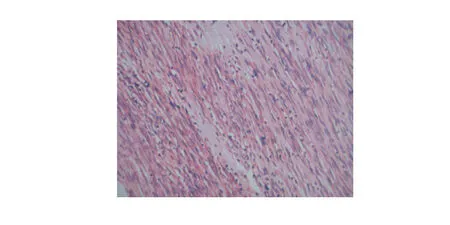
图1 梭形细胞型GIST,细胞束状排列,细胞丰富,胞质淡嗜伊红(HE染色,×100)
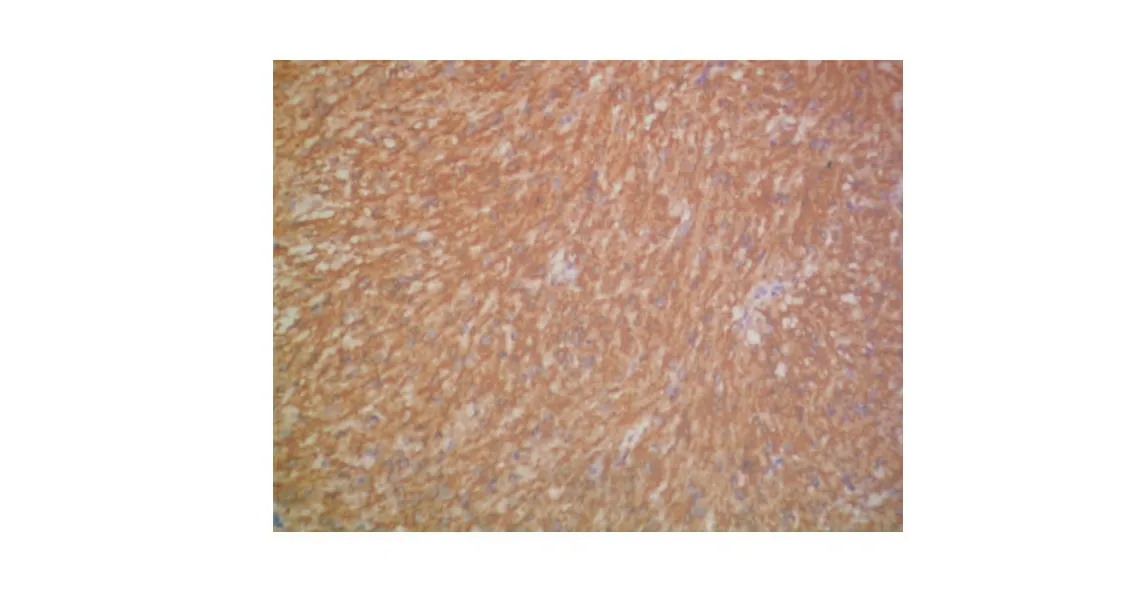
图2 CD117呈弥漫阳性,胞质着色(免疫组织化学染色,×200)
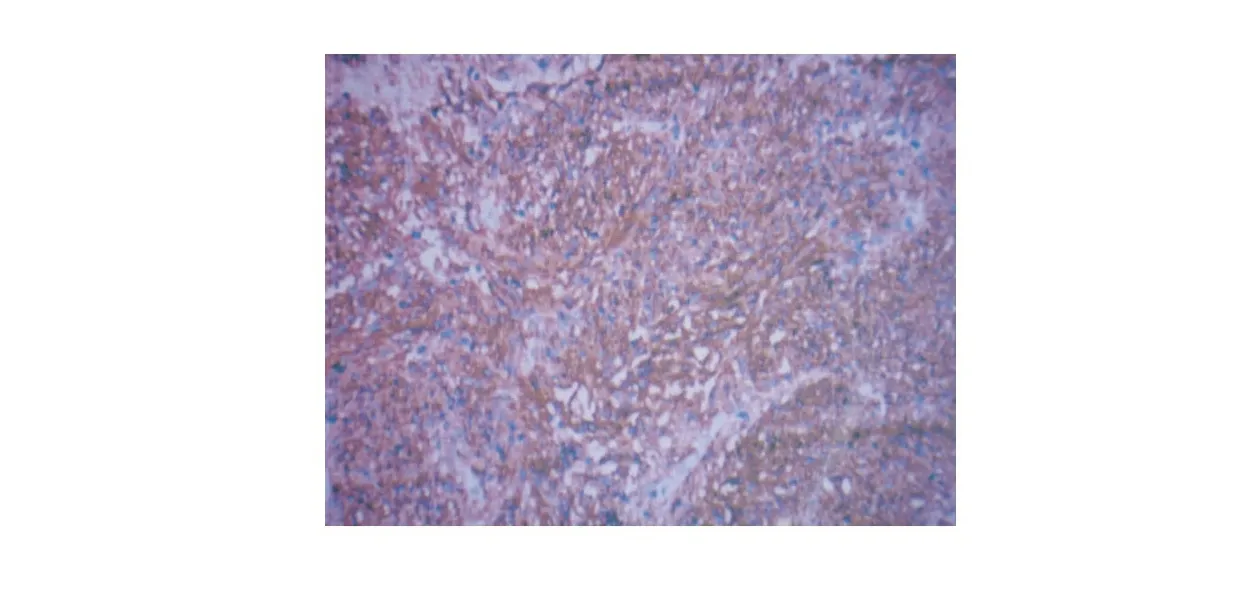
图3 DOG⁃1呈弥漫阳性,其间CD34阳性,SMA、S⁃100阴性(免疫组织化学染色,×200)
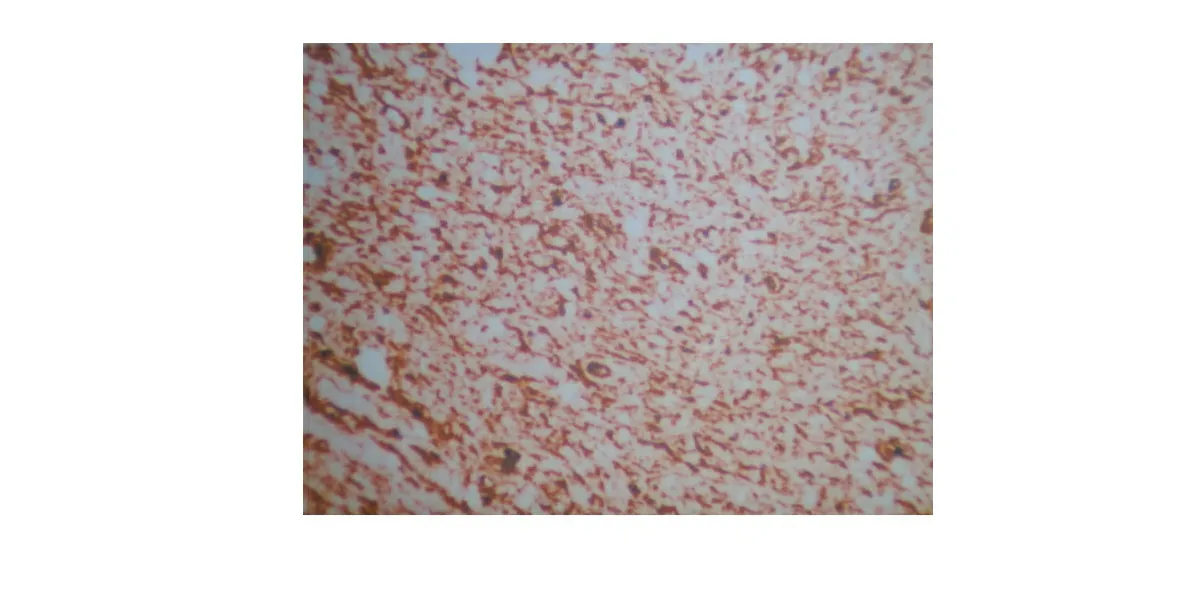
图4 GIST瘤细胞有极端空泡,CD34弥漫阳性(免疫组织化学染色,×200)
结 果
本组1例患者术后因肠瘘、感染性休克、多器官功能衰竭而死亡;无其他围手术期死亡;术后进行随访59例,随访率83.10%,随访时间6~132个月。术后复发部位有腹腔、肝脏、肺转移,术后复发转移者19例,发现复发转移时间为3~48个月,平均17个月。本组21例行伊马替尼治疗,服用时间12~60个月,其中完全缓解(CR)3例,部分缓解(PR)16例,疾病稳定(SD)2例。本组1、3、5年生存率分别为93.79%、79.54%、53.69%。
讨 论
GIST是最常见的胃肠道间叶源性肿瘤,其生物学行为及临床表现可以从良性至恶性[2]。其发病率低,年发病率约为1.5/10万[3],好发年龄为40~70岁,男女发病率无明显差异;本研究中男性37例、女性35例,男女比例1.06∶1;年龄28~80岁,其中40~70岁患者57例(79.2%),中位年龄61岁,与文献报道基本相符[4]。常见的发病部位为胃、小肠[5],此外也可发生于结直肠、食管、网膜、肠系膜及腹膜等[1]。本研究中肿瘤发生部位依次为:胃41例(56.94%)、小肠24例(33.33%),结直肠6例(8.33%),另外还有食管1例;与国内张鹏等[6]的文献报道相符。其中发生于胃部的GIST又以胃体部和胃底部常见。
GIST起病隐匿,进展缓慢,本组中病例的病程为1 d至8年,平均12.5个月。早期通常缺乏特异性症状,临床症状与肿瘤部位、生长方式、肿瘤大小等有关,多数患者在肿瘤直径>5 cm时才出现临床症状,主要有腹痛、消化道出血、腹部包块等,另外常见的伴随症状有体重减轻、消瘦、恶心呕吐、腹泻、便秘、里急后重等。本研究中腹痛34例(47.22%),为最常见的症状,消化道出血22例(30.56%),腹部肿块11例(15.28%),肠梗阻5例(6.94%),贫血6例(8.33%),吞咽困难1例(1.39%)。GIST临床表现缺乏特异性,加之发病率低,临床医师缺乏相应的警惕性,容易延误诊治。
GIST早期诊断困难,主要辅助检查有腹部超声、腹部CT、消化道钡餐造影、血管造影检查及内镜检查。B超、CT检查有助于了解肿块大小、与周围组织的关系、有无脏器转移、有无后腹膜淋巴结肿块等,可用于筛查及术前评估;气钡双重造影可显示肿瘤的大小、形态、位置及小肠黏膜受累、破坏,但对黏膜以下及腔外病变诊断能力低;数字减影血管造影(DSA)对血供丰富尤其是合并活动性出血大于0.5~1 ml/min的肿瘤有较大的诊断价值;内镜检查用于消化道的诊断可发现黏膜下肿块并取活检,但因GIST发生于胃肠道肌层,内镜下取活检常因取材表浅而呈假阴性诊断,有报道术前内镜病检准确率约为50%[7];本研究中行食管、胃及结直肠内镜检查56例,发现黏膜下隆起44例,超声内镜检查诊断黏膜下肿瘤9例,取活检明确诊断19例;需注意的是不适当的活检可能引起肿瘤破溃、出血,增加肿瘤播散可能,对部位较深的肿瘤如位于十二指肠部的进行活检需慎重。对于原发局限性GIST,不推荐常规行术前活检;行术前新辅助治疗者需行活检确诊[8]。内镜可探查肿瘤部位、起源层次、大小,是诊断黏膜下肿瘤较可靠的诊断方法。必要时可行腹腔镜探查或剖腹探查术以助于诊断。
术前可多种辅助检查联合运用以提高诊断准确率,但GIST的确诊依靠于病理组织学检查。GIST组织学结构多样,镜下GIST细胞分为梭形细胞型、上皮细胞型及混合细胞型[9];核型也较复杂,可见核异形性和分裂象。据相关文献报道[10-11],免疫组织化学检测CD117阳性率为94%~98%,DOG-1阳性率为94%~96%,两者具有高度一致性;此外CD34染色阳性率约为70%。在临床常规工作中,推荐联合采用上述3项标志物[9];对CD117阴性患者可进一步行DOG-1检测,如DOG-1仍为阴性者则应行c-kit和PDGFRA基因突变检测。α-平滑肌肌动蛋白、S-100等标志物在少数GIST细胞中低表达。此外少数非GIST肿瘤也表达CD117和(或)DOG-1[12-13],应联合采用其他标志物加以鉴别,必要时进一步行病理学检测确定是否存在c-kit或PDGFRA基因突变[9]。本组中CD117阳性率为98.61%(71/72),CD34阳性率为70.83%(51/72),DOG-1阳性率为100.00%(17/17),与文献报道大致相符。对基因突变阴性,在排除其他肿瘤的情况下,结合肿瘤原发部位及组织学形态特征,可慎重作出GIST的诊断(即野生型)。
GIST对放化疗不敏感,主要治疗手段包括手术治疗和分子靶向治疗[14]。手术切除范围根据肿瘤大小、部位、性质及患者全身情况综合考虑,对原发局限性GIST的治疗,手术切除是最佳方案,手术应尽可能完整切除肿瘤,达到切缘阴性,术中应避免肿瘤破裂和术中播散;单纯局部复发者可再次手术。由于GIST主要通过种植和血行转移(常见血行转移部位为肝脏),淋巴结转移少见,除非有明确淋巴结转移征象,术中一般无需行淋巴结清扫[15]。本研究中除2例患者因肿瘤广泛浸润未完整切除,其余70例均完整切除(病理证实切缘阴性),行病变食管+近端胃切除术1例,胃肿瘤局部切除术13例,胃大部切除术20例,全胃切除术3例,根治性胃切除术3例,胰十二指肠切除术5例,部分小肠切除术16例,部分小肠+肝叶切除术1例,右半结肠切除术3例,部分结直肠切除术4例,腹会阴联合直肠切除术1例。淋巴结清扫9例,未发现淋巴结转移。
手术结合分子靶向药物如伊马替尼或舒尼替尼的综合治疗,整体上改变了GIST的治疗模式。伊马替尼为分子靶向治疗一线药物。对原发不可切除、临界可切除但风险较大、转移或严重影响脏器功能者需先行伊马替尼新辅助治疗,肿瘤缩小后再行手术切除[8,16]。相关文献报道40%~80%的患者根治性切除术后出现腹腔内复发转移[17],目前推荐GIST中、高危患者术后常规行伊马替尼靶向辅助治疗。分子靶向药物如伊马替尼或舒尼替尼能明显改善转移性GIST疗效,延长总体生存时间[18]。对术后复发的患者行第二次手术术后复发率几乎100%,单纯手术不能改善其预后,对明确可切除病灶而无明显手术风险者行手术治疗,术后需联合靶向药物治疗;其余复发或转移GIST首选伊马替尼治疗,具备可切除条件者可考虑手术切除。然而,约14%患者开始即对伊马替尼表现出抗药性,约半数患者在治疗2年后出现继发性耐药[19],增加剂量或改换舒尼替尼可使部分耐药进展患者获益[20],但其效果有限,多预后不良[21]。本研究中对术后Fletcher分级为中高度危险、切除不完全及复发和转移的患者行分子靶向治疗,21例行甲磺酸伊马替尼治疗,服用时间12~60个月,其中完全缓解(CR)3例,部分缓解(PR)16例,疾病稳定2例。本组1、3、5年生存率分别为93.79%、79.54%、53.69%。
总之,根据GIST的发病特点和临床表现特征,及时采取有效的诊断方法,尽早诊断及行手术治疗是改善其预后的关键。手术结合分子靶向药物的综合治疗,使GIST患者的临床获益率大大增加。
1 徐文通,吴欣.胃肠道间质瘤的诊断和治疗进展.中华消化外科杂志,2012,11:302-304.
2 Ridolfini MP,Cassano A,Ricci R,et al.Gastrointestinal stromal tumors.Annali italiani di chirurgia,2011,82:97.
3 Casali PG,Blay JY.Gastrointestinal stromal tumours: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up.Annals of Oncology,2010,21(Suppl 5): v98-v102.
4 钱锋,胡新,刘佳佳,等.539 例胃肠道间质瘤的临床分析.中华消化外科杂志,2013, 12:272-275.
5 Joensuu H,Hohenberger P,Corless CL.Gastrointestinal stromal tumour.The Lancet, 2007,369:1731-1741.
6 张鹏,郑威强,陶凯雄,等.217 例胃肠间质瘤临床分析.中华胃肠外科杂志,2012,15:251-254.
7 Bauer S,Corless CL,Heinrich MC,et al.Response to imatinib mesylate of a gastrointestinal stromal tumor with very low expression of KIT.Cancer chemotherapy and pharmacology,2003,51: 261-265.
8 何裕隆.胃肠间质瘤外科诊治共识和争议.中华胃肠外科杂志,2013,16:201-203.
9 CSCO胃肠间质瘤专家委员会.中国胃肠间质瘤诊断治疗共识(2013年版).临床肿瘤学杂志,2013,18:1025-1032.
10Miettinen M,Wang ZF,Lasota J.DOG1 antibody in the differential diagnosis of gastrointestinal stromal tumors:a study of 1840 cases. Am J Surg Pathology,2009,33:1401-1408.
11Novelli M,Rossi S,Rodriguez-Justo M,et al.DOG1 and CD117 are the antibodies of choice in the diagnosis of gastrointestinal stromal tumours.Histopathology,2010,57:259-270.
12Ni S,Huang D,Chen X,et al. c-kit gene mutation and CD117 expression in human anorectal melanomas.Human Pathology, 2012,43:801- 807.
13Sah SP,McCluggage WG.DOG1 immunoreactivity in uterine leiomyosarcomas. J Clin Pathology,2013,66:40-43.
14何裕隆.如何更好地联合外科手术与靶向药物治疗胃肠间质瘤.中华胃肠外科杂志,2012,15:201-203.
15Casali PG,Jost L,Reichardt P,et al.Gastrointestinal stromal tumours: ESMO clinical recommendations for diagnosis,treatment and follow-up.Ann Oncol,2009,20(Suppl 4): iv64-iv67.
16曹晖,汪明.胃肠道间质瘤的规范化治疗.中华消化外科杂志,2011,10:405-408.
17DeMatteo RP,Lewis JJ,Leung D,et al.Two hundred gastrointestinal stromal tumors:recurrence patterns and prognostic factors for survival.Ann Surg,2000,231:51.
18Edmonson JH,Marks RS,Buckner JC,et al.Contrast of response to dacarbazine, mitomycin, doxorubicin, and cisplatin (DMAP) plus GM-CSF between patients with advanced malignant gastrointestinal stromal tumors and patients with other advanced leiomyosarcomas. Cancer investigation,2002,20:605-612.
19Blanke CD,Demetri GD,von Mehren M,et al.Long-term results from a randomized phase II trial of standard-versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT.J Clin Oncol,2008,26:620-625.
20Blanke CD,Demetri GD,von Mehren M,et al.Long-term results from a randomized phase II trial of standard-versus higher-dose imatinib mesylate for patients with unresectable or metastatic gastrointestinal stromal tumors expressing KIT.J Clin Oncol,2008,26:620-625.
21Demetri GD,van Oosterom AT,Garrett CR,et al.Efficacy and safety of sunitinib in patients with advanced gastrointestinal stromal tumour after failure of imatinib:a randomised controlled trial.Lancet,2006,368:1329-1338.

