胰腺实性假乳头状瘤的诊断和治疗(附28例报告)
王大斌 张可仞 白玉作 王维林 贾慧敏
本病临床上发病率低,从2000年以来报道约占胰腺外分泌肿瘤的6%[3]。SPTP年龄分布跨度极大,其中20%的病人为儿童[4]。据国外某研究统计,SPTP占小儿胰腺肿瘤的50%[5],北京儿童医院统计,SPTP占儿童胰腺实体瘤的33.3%[6]。
因本病目前国际上无确切诊疗指南,相关文献多以病例报道形式出现,迄今为止,国外文献发表有关SPTP的报道约686篇。本研究回顾2000~2013年于中国医科大学附属盛京医院经病理确诊病例的临床资料,予以总结并完成随访调查,探讨SPTP的临床特点,提高该病的诊断和治疗水平。
资料与方法
一、临床资料
回顾性总结分析中国医科大学附属盛京医院2000年10月至2013年3月间经手术病理证实为SPTP 28例病人的临床资料(表1),男性4例,女性24例,男女比例为1∶6,年龄9~67岁,平均年龄29岁,中位年龄27岁。其中体检中无意发现肿物者12例,外伤后腹痛检出肿物者6例(均为未成年病人),腹痛为首发症状者7例,复查意外发现者2例,肠梗阻为首发症状者1例。
二、诊疗方法
包括临床表现,术前彩超、CT影像学特点,术前检查:血糖、甲胎蛋白(AFP)、癌胚抗原(CEA),癌抗原(CA)19-9均在正常值范围,无明确诊断价值。术中所见,病理改变, CK(角蛋白),Vimentin(波形蛋白),AACT(α-抗胰蛋白酶)免疫组织化学检测结果等。同时对所有病例进行随访。

表1 临床资料总结
三、统计学分析
所得资料统计学处理采用SPSS(19.0版)统计软件分析系统,使用双向无序R×C表资料的Fisher确切概率法,P<0.05为差异有统计学意义。
因此不论是从打击商业贿赂犯罪的角度,还是从符合商业贿赂犯罪立法的国际性潮流的角度来看,都应当将商业贿赂的内容扩大到非财产性利益。
结 果
术后定期至门诊随访,除2例失访外均随诊3个月以上,最长者已随访10年。所有病人术前术后均未行放化疗治疗。CT(25例)明确诊断为SPTP 6例;诊断胰腺癌3例,诊断血肿1例,诊断间质瘤1例,诊断黏液囊腺瘤2例,诊断胰腺区肿物11例,诊断复发转移1例。影像学资料显示:显示肿瘤的部位和大小均与病理吻合,肿瘤均呈圆形或椭圆形,边缘规则,有浅分叶者2例。22例囊实性肿瘤中,平扫呈不均匀稍低密度者12例,不均匀厚壁囊肿内见分隔者7例(图1),见附壁结节者3例(图2),CT值28~44 Hu;2例实质性肿瘤呈混杂软组织密度,CT值40~64 Hu,其内均可见囊变坏死区及出血。共11例可见钙化,分别表现为肿瘤边缘的弧形钙化2例(图3),点状钙化7例(图1),内部条形钙化2例(图4)。所有病例在CT扫描时均未见胆总管扩张,3例体尾部胰管略扩张。
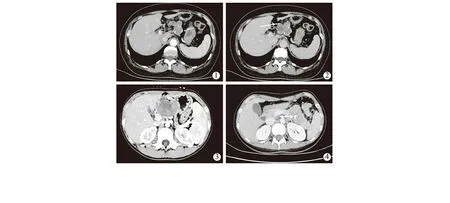
图1 53岁女性增强CT显示分隔(白色箭头) 图2 53岁女性增强CT,箭头指附壁结节及点状钙化 图3 9岁女性增强CT,箭头指弧形钙化 图4 48岁女性增强CT,箭头指内部条形钙化
彩超检查明确诊断为SPTP 4例;腹膜后肿物1例,胰腺癌1例,阴性检查1例,胰腺区肿物16例.结合病理,15例囊实混合型肿瘤中,表现为不均质低回声者9例 ,典型的液性低回声合并后方回声增强者6例,肿瘤内部的血流均不丰富;8例实质性肿瘤表现为不均质的中等稍强回声,其中1例内可见丰富的血流信号 。
所有28位病人均接受手术治疗,其中除2例病人因肿物术前合并出血,腹腔粘连严重,仅行病理活检,无法将肿物完整切除外,余26例病人均一次性完整切除肿物,手术方式分别为:肿物核除术5例;胰十二指肠切除术4例;胰尾切除术5例;胰体尾切除术5例;胰尾切除加脾脏切除术3例;病理活检2例;转移瘤切除1例;胰体切除、胰肠吻合术3例。
病理改变:肿瘤最大直径4~12 cm,平均7.2 cm。均有完整包膜,位于胰头:8例,胰体:4例,胰尾:15例;其他腹壁转移:1例。表现为囊实混合性者22例,囊内液为陈旧血液,呈咖啡色。镜下肿瘤细胞大小一致,胞质呈嗜酸性颗粒状,瘤细胞围绕纤维血管排列呈乳头状,瘤细胞核分裂少见,瘤组织有片状出血、坏死及囊性变。
免疫组织化学:CK(角蛋白):检验24例,阳性10例,阳性率41.67%;Vimentin(波形蛋白):检验23例,阳性22例,阳性率95.65%;AACT(α-抗胰蛋白酶):检验23例,阳性23例,阳性率100%。免疫组化各指标阳性率与病理结果相比较差异无统计学意义,P=0.325。
28例病人术后均未给予放疗或化学治疗,2例术后出现外伤性胰漏,给予T管引流后治愈;5例出现胰腺假性囊肿改变,其中1例经介入穿刺抽液治疗,1例经超声内镜行内引流治疗,3例保守治疗后均痊愈。
28例病人中2例失访,4例复发,均为原位复发(复发时间为术后3个月、术后7个月、术后1年和术后13个月),其中1例复发后3个月因合并心肺功能衰竭死亡,另3例均经再次手术后治愈,随访时间为3个月至10年,平均15个月。5年生存率为96.4%。
讨 论
SPTP居儿童胰腺实体瘤第二位,以亚洲人偏多[7],属低度恶性,80%肿瘤限于胰腺,20%转移SPTP年龄分布跨度极大,平均26岁,其中20%为儿童[8],男女发病比例约为1.0∶6.8,约95%发生于育龄女性,认为该肿瘤的发生与性别有关。本研究验证了本病确实存在性别差异,男女比例为1∶6,女性发病率明显高于男性。发病年龄从9~67岁,中位年龄27岁,其中10~20岁发病人群明显高于其他组人群,提示本病高发年龄组为10~20岁,青春期女性好发。
本病临床症状无明显特异性,临床表现缺乏特异性[9],多数无症状,成年人多在体检时偶然发现,偶有中上腹部不适,极少出现呕吐、恶心等症状。对于青春期儿童多由于腹痛或外伤检查时偶然发现,本研究中儿童由于外伤后腹痛检出SPTP有6例,占全部未成年病人比例超过50%,值得临床医生借鉴,如遇到外伤后腹痛患儿,需完善相关检查,避免漏诊。
SPTP的术前诊断主要是影像学检查[10],彩超及增强CT是目前最为常用的手段,表现为胰腺单发的、边界清晰囊实性肿块。动脉期实质部分不均匀强化,肝实质期渐进性强化,对周围血管多表现为推移、压迫。SPTP在影像学表现上虽很难与其他囊实性肿瘤鉴别,但即使肿瘤体积很大也很少出现胰管和胆管梗阻扩张或血管受侵表现,肿瘤周围组织多为推挤移位,其CT表现可分为两类:①囊实混合型:典型者表现为较大的圆形或椭圆形囊性肿物,壁厚薄不均,可见乳头状附壁结节。本组这种类型的共计22例(22/28)。病理上囊性区和实质区相互交错,可见数层瘤细胞围绕纤维血管形成乳头状结构。此外,囊实混合型的SPTP还可表现为厚壁的囊肿,其内多发实质性分隔。增强扫描时实质成分和分隔可见强化,飘浮在低密度的囊性部分中,称为“浮云征”[11]。这一类型肿瘤的血供不丰富,增强扫描仅轻度强化,CT值的变化在20Hu左右。实质区的强化表现为从动脉期向门脉期逐渐递增的方式。②实质型:肿瘤囊变区较小或不明显,实性成分显著,易合并出血。增强扫描肿瘤呈轻至中度强化,CT值升高30 Hu左右,肿瘤内部可见迂曲扩张的异常供血血管。肿瘤强化的方式为从动脉期到门脉期逐渐递增,这一点与其他动脉供血为主的肿瘤,如胰腺癌和胰岛细胞瘤不同。后二者肿瘤的细胞增生活跃,异型性相对明显,属于恶性度相对较高的肿瘤。
目前根据本研究,肿瘤位置于胰体尾部共19例病人,高于发生于胰头8例的比例,但肿物发生位置与年龄组经统计学分析差异无统计学意义,说明肿物发生位置与年龄无明显相关性。
SPTP一般均能手术切除,少数肿瘤侵犯周围器官及血管,也应争取连同受累器官或血管一并切除,其手术方式取决于肿瘤位置、大小、性质和手术次数。对于手术方式的选择,龙江等[12]认为:①胰头部肿瘤可行胰十二指肠切除术,如未累及十二指肠可以考虑行PPPD;②胰体或尾部的肿瘤可行远端胰腺切除和脾切除,部分肿瘤未累及脾门者,可以考虑保留脾脏;③若肿瘤较小,包膜完整,呈外生性生长,可考虑行肿瘤局部切除,但要注意基底部的完整切除和胰腺创面的修复、引流;④肿瘤切缘阴性对预防术后复发非常重要,术中应常规行胰腺切缘冰冻检查,以减少切缘的肿瘤复发;⑤SPTP淋巴结转移发生较少,无必要进行扩大的淋巴结清扫。我院共进行肿物核除术5例;胰十二指肠切除术4例;胰尾切除术5例;胰体尾切除5例,转移瘤切除术1例;病理活检2例;胰尾切除加脾脏切除术3例;胰体切除、胰肠吻合术3例。其中3例脾脏切除术因术中发现肿物包绕脾脏动静脉,无法剥离,脾脏无法保留而切脾,对于未成年病人来说,我们建议尽量保留脾脏和正常胰腺组织,因脾脏免疫功能对小儿尤为重要,且小儿胰腺较小,过多切除会影响其功能。
SPTP可发生在胰腺的任何部位,多数肿瘤体积较大,呈圆形或椭圆形,边界清楚,外有纤维包膜,剖面呈囊实性病变相间的结构,其内充满血性或胶冻样物。光镜下:肿瘤细胞形态一致,胞质透明或嗜酸性,核圆形或椭圆形,异型性不明显,核分裂象罕见,其特征性改变的是肿瘤细胞围绕血管复层排列。呈乳头状,乳头状结构和实性区相互交替,并可见不同程度出血、囊性变等改变[13]。电镜检查有些瘤细胞可见酶原颗粒,提示肿瘤为上皮源性,兼具内分泌功能。
免疫组织化学:SPTP 的组织起源尚有争议,可以源于胰腺,亦可以源于胰腺外[14]。目前文献报道称多数肿瘤的神经烯醇化酶(84%),α抗胰蛋白酶(83.0%),波形蛋白(72.0%)呈阳性反应,说明组织来源多样性,既可以向神经组织分化,也可来源于胰腺组织[8]。本研究结果显示CK(角蛋白)阳性率41.67%;Vimentin(波形蛋白)阳性率95.65%;AACT(α-抗胰蛋白酶)阳性率100%。考虑SPCT来源于胰腺上皮细胞的可能性较大。
SPTP为低度恶性肿瘤,预后良好。与成人胰腺癌不同[15],多数学者不主张术后化疗及放疗,即使局部复发再次手术远期效果亦较好。本研究中28例病人术后亦未接受放化疗治疗,除1例60岁男性复发合并心肺功能衰竭死亡外,余27例均存活至今,生存率达到96.4%。Ansari等[16]对29 例 SPTP 进行回顾分析,认为以下为肿瘤复发及死亡的高危因素:男性,高龄病人,不典型的组织学表现(肿瘤体积较大,侵袭性生长,细胞或细胞核的不典型增生,细胞有丝分裂活跃,坏死,周围侵犯或转移),不完整的切除。此结论于本次研究得到证实。
故本研究认为对于SPTP病人,术前术后的辅助放疗或化疗无治疗意义,但须密切定期随访,如有复发,再次手术效果仍较好。
SPTP是一种良性肿瘤或低度恶性肿瘤,好发于青春期女性,尤其是10岁至20岁年龄段,此病存在性别差异,男女比例可达1∶6。肿物可发生于胰腺所有部位。起病隐匿,多于体检中无意发现,但对于未成年人来说,腹部外伤为发现SPTP的不可忽视的原因之一,应予以重视。CT及彩超对SPTP有诊断意义,CT影像学特点尤为突出:年轻女性胰腺区较大的圆形或椭圆形囊实混合性肿物,其内可见乳头状附壁结节及分隔,伴囊壁钙化或点状钙化时,应首先考虑为SPTP。手术切除肿瘤仍为SPTP的主要治疗方式,预后良好。即使复发,可行再次手术,效果仍然良好,本次研究中3例复发病人均通过再次手术得以治愈。如为高危病人,需注意其复发及预后不良可能。定期按时随访复诊是十分必要的。
1 Frantz VK.Tumors of the pancreas.In:Atlas of tumor pathology,section VII,fascicles 27 and 28.Washington,DC:US Armed Forces Institute of Pathology,1959.
2 Oliveira Lima S,Rocha Santana V,Correia Leao S,et al.Solid-pseudopapillary tumor of pancreas in a young woman:a case report and literature review.Rev Med Chil,2012,140:1179-1184.
3 Papavramidis T,Papavramidis S.Solid pseudopapillary tumours of the pancreas:review of 718 patients reported in english literature.J Am Coll Surg,2005,200:965-972.
4 Laje P,Bhatti TR,Adzick NS,et al.Solid pseudopapillary neoplasm of the pancreas in children:a 15-year experience and the identification of a unique immunohistochemical marker.J Pediatr Surg,2013,48:2054-2060.
5 Park JY,Kim SG,Park J.Solid pseudopapillary tumor of the pancreas in children:15-year experience at a single institution with assays using an immunohistochemical panel.Ann Surg Treat Res,2014,86:130-135.
6 李振东,李索林,周俊恒,等.小儿胰腺乳头状囊性实性肿瘤三例报告.中华小儿外科杂志,2002,23:428-430.
7 Morikawa T,Onogawa T,Maeda S,et al.Solid pseudopapillary neoplasms of the pancreas:an 18-year experience at a single Japanese Institution.Surg Today,2013,43:26-32.
8 Suzuki S,Hatori T,Furukawa T,et al.Clinical and pathological features of solid pseudopapillary neoplasms of the pancreas at a single institution.Dig Surg,2014,31:143-150.
9 Cai H,Zhou M,Hu Y,et al.Solid-pseudopapillary neoplasms of the pancreas:clinical and pathological features of 33 cases.Surg Today,2013,43:148-154.
10Casadei R,Santini D,CalculliL,etal.Pancreatic solid-cystic papillary tumor:Clinical features,imaging findings and operative management.J Pancreas(Online),2006,7:137-144.
11姜天娇,段峰,杨青,等.胰腺实性假乳头状瘤的SCT诊断价值.医学影像学杂志,2009,9:344-347.
12龙江,傅德良,杨峰,等.胰腺实性假乳头状瘤的诊断和外科治疗.中华普通外科杂志,2008,23:20-22.
13娄欣,张全武,肖艳景,等.胰腺实性假乳头状瘤的临床病理特征.肿瘤基础与临床,2011,24:50-51.
14Basu A,Jha A.Solid and cystic tumor arising from an extrapancreatic site—a case report.Nepal Med Coll J,2003,5:107-108.
15Santini D,Poli F,Lega S.Solid-papillary tumors of the pancreas:histopathology.JOP,2006,7:131-136.
16Ansari D,Elebro J,Tingstedt B,et al.Single-institution experience with solid pseudopapillary neoplasm of the pancreas.Scand J Gastroenterol,2011,46:1492-1497.

