一氧化氮对绿熟和粉红期番茄采后抗氧化相关酶的影响
李 洁,温昕晔,张 辉,高 晶,郭 芹,张玉丽,吴忠红,吴 斌,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052;2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐830091;3.新疆大学化学与化工学院,新疆乌鲁木齐830046)
一氧化氮对绿熟和粉红期番茄采后抗氧化相关酶的影响
李 洁1,温昕晔1,张 辉1,高 晶3,郭 芹3,张玉丽2,吴忠红2,吴 斌2,*
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐830052;2.新疆农业科学院农产品贮藏加工研究所,新疆乌鲁木齐830091;3.新疆大学化学与化工学院,新疆乌鲁木齐830046)
以“申冠油”番茄果实为试材,采用不同浓度一氧化氮(20、40、60μL·L-1NO)在空气条件下处理绿熟期和粉红期的番茄果实3h,在16℃和相对湿度为85%的条件下贮藏20d。分析NO处理对番茄果实中过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)等抗氧化相关酶活性及丙二醛(MDA)和可溶性糖含量变化的影响。实验结果表明:NO处理能促进绿熟期和粉红期番茄中CAT、POD、SOD活性的增加和绿熟期番茄中APX酶活性的增加,降低了绿熟期番茄中MDA含量,延缓果实中可溶性糖的流失,且60μL·L-1NO处理效果较好。但NO处理对粉红期番茄中APX活性和MDA含量无显著影响,这可能与NO对绿熟期和粉红期这两种不同成熟度番茄中作用方式不一样有关。
一氧化氮,番茄,采后,抗氧化相关酶
一氧化氮(NO)是一种具有水溶性和脂溶性的气体小分子。自1987年生物体内源合成机制被发现及其生理特性被证实以来,NO就引起科学界的关注[1]。迄今为止,人们已经发现NO可控制许多植物的生理过程,如生长[2]、成熟[3]和抗病性[4]。NO可在果实内生成,随着果实成熟度的增加而减少,未成熟果中NO含量比成熟果中高,NO和它的衍生物(N2O)可抑制乙烯合成来延缓组织衰老进程,提高果蔬贮藏过程中抵御逆境的能力,从而改善果蔬采后的贮藏品质。NO还可诱导草莓超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和抗坏血酸过氧化物酶(APX)活性的增加,减少丙二醛(MDA)的含量[5]。
番茄(Lycopersicon esculenturn)是新疆地区优势明显的红色产业[6],由于日照时间长,昼夜温差大等独特的自然条件,番茄中可溶性固形物和番茄红素含量较高。此外,番茄果实风味独特、营养丰富,受到越来越多消费者的青睐。研究表明,NO处理对植物的成熟衰老有抑制作用[3],这可能是NO的化学特性改变了乙烯合成及信号转导途径相关酶的活性或基因的表达。针对不同成熟度番茄果实中最各组分含量及作用机理不同,而且目前NO处理不同成熟度番茄的相关报道较少。因此,本实验以新疆鲜食番茄为研究试材,分析NO对绿熟期和粉红期番茄果实抗氧化酶活性的影响,筛选NO处理绿熟期和粉红期番茄的适宜浓度,为阐明NO对不同成熟度番茄的作用方式不同的可能机理提供依据,并为后期工作的开展及应用研究提供参考。
1 材料与方法
1.1 材料与仪器
实验材料 番茄品种为“申冠油”,采自新疆乌鲁木齐安宁渠番茄种植基地,采后立即运往冷库预冷12h后进行处理;NO气体(纯度99.9%) 广州世源气体有限公司、甲硫氨酸、核黄素、硫代巴比妥酸、愈创木酚、氮蓝四唑(Nitrotetrazolium Blue chloride,NBT)、乙二胺四乙酸(Ethylene Diamine Tetraacetic Acid,EDTA)等 均为分析纯。
UV-2600紫外分光光度计 日本岛津公司;Himac CR-20B2大型台式冷冻离心机 日本日立公司;IKA MS3 basic旋涡混合器 浙江纳德科技有限公司;FW-80高速万能粉碎机 北京永光明医疗仪器厂。
1.2 实验方法
1.2.1 处理与取样方法
1.2.1.1 实验处理 将预冷过的绿熟期(Mature green Stage,MG)和粉红期(Pink Stage,PS)番茄,选取大小均一、无病虫害、无机械损伤的果实去果蒂备用。随后将番茄果实置于密封的气调箱内,用浓度为99.9% NO气体进行以下熏蒸处理:a.对照(CK):在有氧条件下维持3h;b.NO处理:在有氧条件下,通入NO气体,使NO浓度为20、40、60μL·L-1,熏蒸3h。处理时,根据密封的气调箱内净体积(箱内体积-样品体积),样品体积采用排水法计算,用微量气相进样针吸取NO气体后注入密封的气调箱内,且箱内安有风扇,能有效的将NO气体混匀。处理完后装入厚度为0.03mm的保鲜袋内并装箱,置于16℃和相对湿度85%的条件下贮藏。每个处理重复三次,每次重复40个样品。
1.2.1.2 取样方法 处理好的番茄取第0d的样品,在贮藏过程中根据表型观察取样,并进行生理指标测定。
1.3 生理指标测定
1.3.1 酶液的提取 准确称取1.0g样品,加4.0mL 0.05mol·L-1磷酸缓冲液(pH7.8,内含0.2mmol·L-1EDTA),浸提30min,12000r/min 4℃离心20min,上清液为待测液。
1.3.2 过氧化物酶(POD)活性的测定 参照文献Kang等[7]的方法略有改进。取酶液0.2mL,依次加入0.2%愈创木酚1mL,0.1%H2O21.5mL,混匀后迅速比色,测OD470值在120s内的变化量,每分钟变化0.01为一个酶活力单位(U),酶活性以U·g-1mf表示。
1.3.3 超氧化物歧化酶(SOD)活性的测定 参照文献Wang等[8]的方法。取酶液1.0mL,依次加入0.06mmol·L-1核黄素0.1mL,14.4mmol·L-1甲硫氨酸0.1mL,2.36mmol·L-1EDTA 0.1mL,2.25mmol·L-1NBT 0.1mL,以缓冲液代替酶液照光做最大光还原测定,日光灯下反应20min。反应结束后,用紫外可见分光光度计测定OD560吸光值,每分钟变化0.01为一个酶活力单位(U),酶活性以U·g-1mf表示。
1.3.4 过氧化氢酶(CAT)活性的测定 参照文献Beers等[9]的方法略有改进。取酶液50μL,0.1mol·L-1H2O21.5mL,混匀后迅速比色,测OD240值在180s内的变化量,每分钟变化0.01为一个酶活力单位(U),酶活性以U·g-1mf表示。
1.3.5 抗坏血酸过氧化物酶(APX)活性的测定 参照Rahnama等[10]的方法。取酶液50μL,加入2.5mL 0.05mol·L-1磷酸缓冲液(内含0.1mmol·L-1EDTA,0.1mmol·L-1AsA和0.1mmol·L-1H2O2),混匀后迅速比色,测OD240值在180s内的变化量,每分钟变化0.01为一个酶活力单位(U),酶活性以U·g-1mf表示。
1.3.6 丙二醛(MDA)含量测定 参照陈德碧等[11]的方法。取酶液1.0mL,转入具塞试管中,再加入3mL 0.6%硫代巴比妥酸(溶于10%三氯乙酸),混匀后于100℃沸水中反应15min,冰浴冷却后,测定450、532、600nm处的OD值,单位用μmol·g-1mf表示。
1.3.7 可溶性糖含量测定 采用蒽酮比色法,取提取液1mL置于试管中,加入蒽酮乙酸乙酯试剂0.5mL和5mL浓硫酸,摇匀,于沸水浴中保温1min,冷却后在630nm波长处比色。
1.4 数据统计与作图
使用SPSS 13.0对数据进行分析,使用Sigma Plot 10.0软件作图。
2 结果与分析
2.1 NO处理对绿熟和粉红期番茄果实POD活性的影响
POD是一类比较复杂的酶,它可与CAT共同清除衰老过程中产生的H2O2。由图1可知,在绿熟期番茄贮藏过程中,POD活性总体呈下降趋势。20、40、60μL·L-1NO处理的绿熟期番茄果实POD活性均高于对照果(p<0.05)。贮藏第11d后60μL·L-1NO处理果POD活性高于20、40μL·L-1NO处理样品。结果表明:NO处理显著提高了绿熟期番茄果实POD活性。
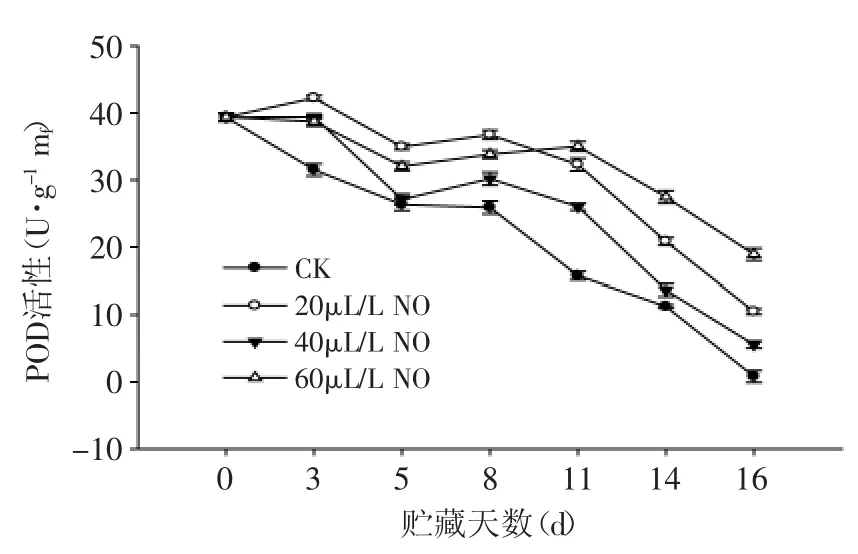
图1 NO处理对绿熟期番茄POD活性的影响Fig.1 Effect of NO on the POD activity of tomato at mature green stage
由图2可知,在贮藏过程中,粉红期番茄果实中POD活性呈下降趋势。贮藏前5d果实中POD活性急剧下降,后期呈缓慢下降趋势。20、40、60μL·L-1NO处理果POD活性变化趋势与对照果一致,但均比对照果高,且第8d后60μL·L-1NO处理果POD活性高于20、40μL·L-1NO处理(p<0.05),结果表明:在贮藏过程中NO处理显著增加了粉红期番茄果实POD的活性。
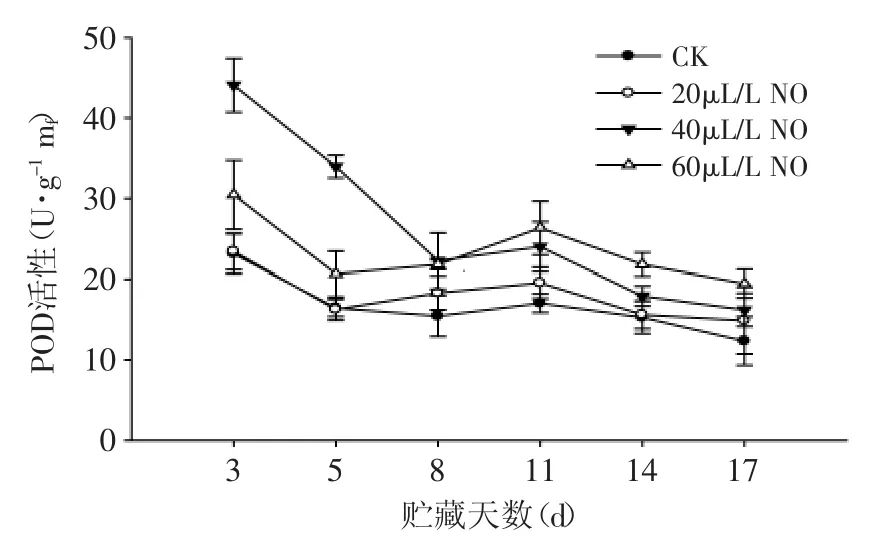
图2 NO处理对粉红期番茄POD活性的影响Fig.2 Effect of NO on the POD activity of tomato at pink stage
2.2 NO处理对绿熟和粉红期番茄果实SOD活性的影响
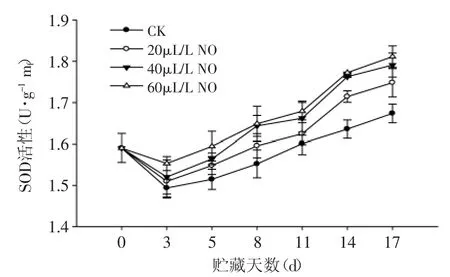
图3 NO处理对绿熟期番茄SOD活性的影响Fig.3 Effect of NO on the SOD activity of tomato at mature green stage
SOD可催化超氧阴离子发生歧化反应,生成H2O2和在维持机体自由基产生和清除的动态平衡中起重要作用。由图3可知,在绿熟期番茄贮藏过程中SOD活性总体呈上升趋势。20、40、60μL·L-1NO处理果SOD活性与对照果的变化趋势相似,且NO处理果SOD活性均高于对照果(p<0.05)。结果表明:NO处理促进了绿熟番茄中SOD活性的增加,提高果实清除超氧阴离子自由基的能力。
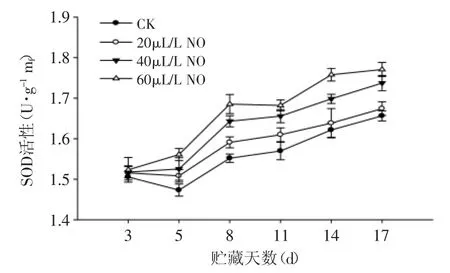
图4 NO处理对粉红期番茄SOD活性的影响Fig.4 Effect of NO on the SOD activity of tomato at pink stage
由图4可知,在粉红期番茄果实贮藏过程中,SOD活性总体呈上升趋势。20、40、60μL·L-1NO处理果SOD活性与对照果的变化趋势相似,且60μL·L-1NO处理果SOD活性高于20、40μL·L-1NO处理果和对照果(p<0.05),结果表明:60μL·L-1NO处理显著提高了SOD的活性。
2.3 NO处理对绿熟和粉红期番茄果实CAT活性的影响
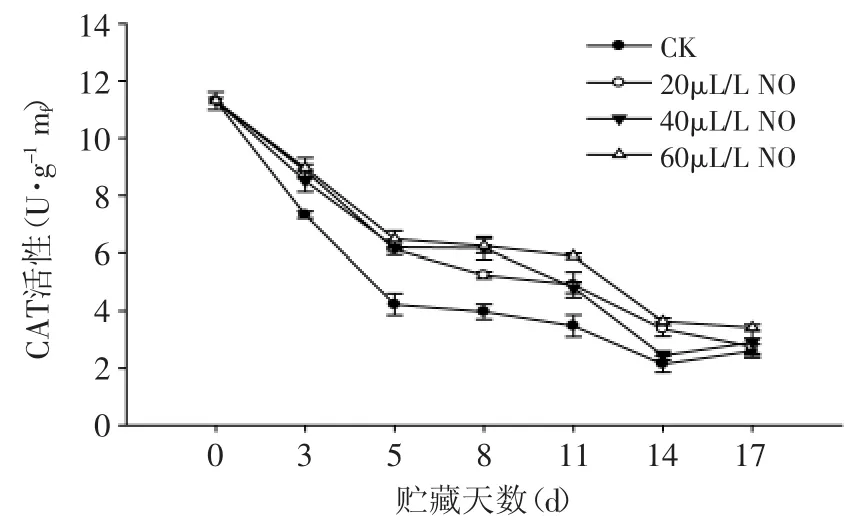
图5 NO处理对绿熟期番茄CAT活性的影响Fig.5 Effect of NO on the CAT activity of tomato at mature green stage
果实代谢过程中所产生的H2O2,可导致细胞进行破坏性的氧化作用,而CAT可有效清除高浓度H2O2。绿熟期番茄果实CAT活性在整个贮藏过程中呈下降趋势(图5),这可能是由于果实中H2O2浓度较低影响的。而60μL·L-1NO处理果CAT活性高于20、40μL·L-1NO处理果和对照果(p<0.05),表明:NO处理可诱导番茄CAT活性的显著增加,提高番茄果实清除H2O2的能力。
由图6可知,在贮藏过程中,粉红期番茄果实中CAT活性呈下降趋势。20、40、60μL·L-1NO处理果CAT活性变化趋势与对照一致,且60μL·L-1NO处理果CAT活性高于20、40μL·L-1NO处理果和对照果(p<0.05)。结果表明:60μL·L-1NO处理能增加CAT的活性。
2.4 NO处理对绿熟和粉红期番茄果实APX活性的影响
植物叶绿体和胞质中,直接负责清除H2O2的关键酶就是APX,它对H2O2的亲和力远大于CAT[12]。由图7可知,绿熟期番茄果实中20、40、60μL·L-1NO处理和对照果APX活性在整个贮藏期间总体呈上升趋势,60μL·L-1NO处理果APX活性高于对照果及20、40μL·L-1NO处理果(p<0.05)。结果表明:NO处理显著促进了APX活性的增加,60μL·L-1NO处理效果较好。
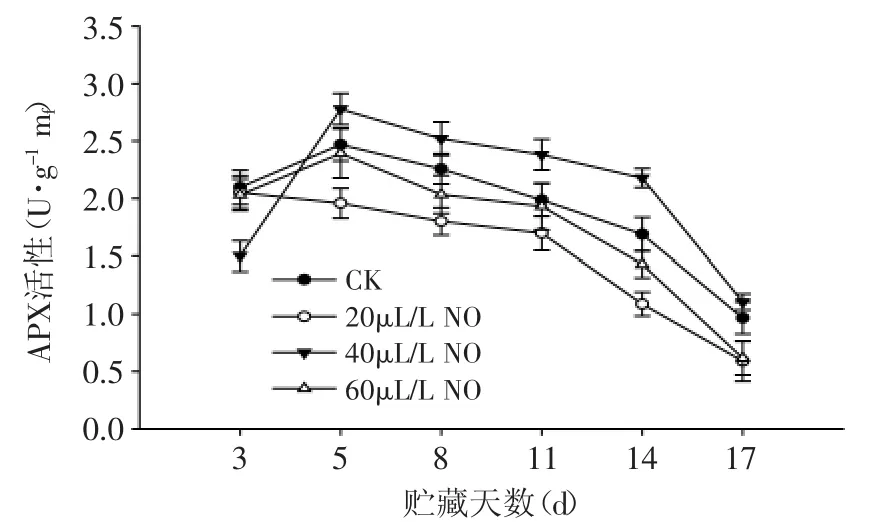
图8 NO处理对粉红期番茄APX活性的影响Fig.8 Effect of NO on the APX activity of tomato at pink stage
粉红期番茄果实中APX含量在整个贮藏期间总体呈下降趋势(图8),20、40、60μL·L-1NO处理中APX活性的变化趋势和对照果相似。结果表明:NO处理对粉红期番茄果实中APX影响不大,不能明显促进APX活性的增加。
2.5 NO处理对绿熟和粉红期番茄果实MDA含量的影响
由图9所知,在绿熟期番茄果实的贮藏过程中,MDA的含量总体呈上升趋势。20、40、60μL·L-1NO处理果的MDA含量变化趋势与对照果相似,但MDA含量均低于对照果。40μL·L-1NO处理果MDA含量低于20、60μL·L-1NO处理果(p<0.05)。结果表明:NO处理可以有效的抑制番茄果实中MDA含量的增加,且40μL·L-1NO处理效果较好,能显著延缓果实的衰老。
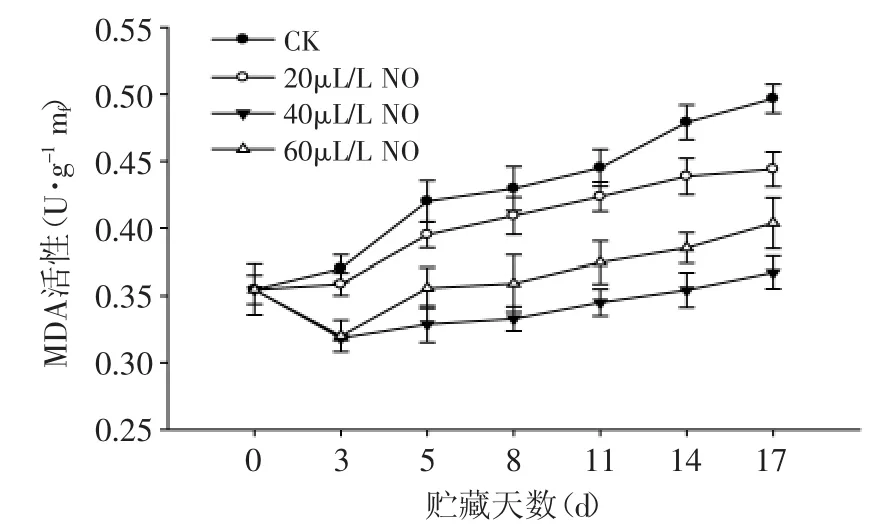
图9 NO处理对绿熟期番茄MDA含量的影响Fig.9 Effect of NO on the MDA content of tomato at mature green stage
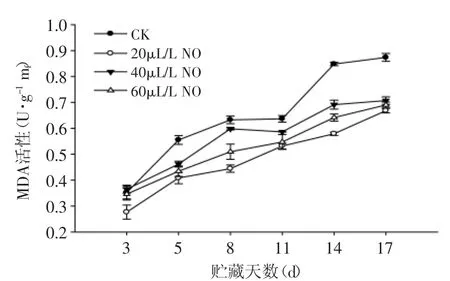
图10 NO处理对粉红期番茄MDA含量的影响Fig.10 Effect of NO on the MDA content of tomato at pink stage
在粉红期番茄果实的贮藏过程中,MDA的含量总体呈上升趋势与绿熟期相似。20、40、60μL·L-1NO处理果的MDA的含量均低于对照果(图10),且20μL·L-1NO处理果MDA的含量低于60、40μL·L-1NO处理果。结果表明:NO处理虽能减少粉红期番茄果实中MDA含量的累积,但与绿熟期番茄相比,粉红期番茄果实中MDA含量明显高于绿熟期,NO处理对粉红期MDA含量影响不大。
2.6 NO处理对绿熟和粉红期番茄可溶性糖含量的影响
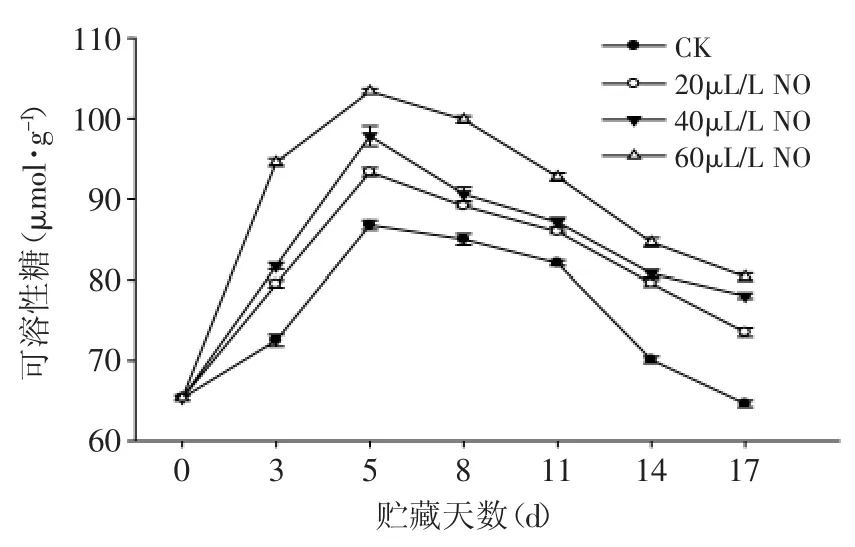
图11 NO处理对绿熟期番茄可溶性糖含量的影响Fig.11 Effects of NO on soluble sugar content of tomato at mature green stage
由图11可知,绿熟期番茄在整个贮藏过程中可溶性糖的含量总体呈先上升后下降趋势。贮藏第0d番茄中可溶性糖的含量为64.74μmol·g-1,在第5d可溶性糖含量达到最大值。20、40、60μL·L-1NO处理果的可溶性糖含量变化趋势与对照果相一致,且60μL·L-1NO处理果可溶性糖含量高于20、40μL·L-1NO处理果和对照果(p<0.05)。结果表明:NO处理可以显著减缓番茄果实中可溶性糖的流失,且60μL·L-1NO处理效果较好。
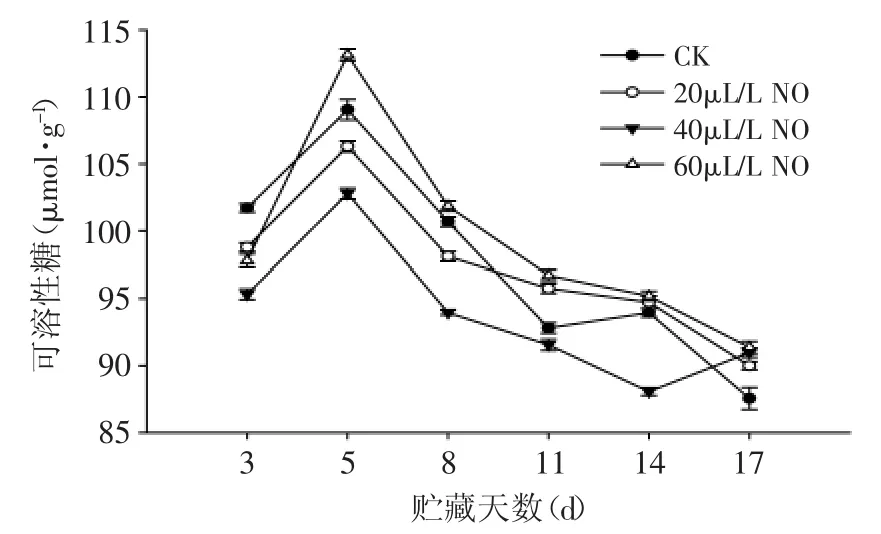
图12 NO处理对粉红期番茄可溶性糖含量的影响Fig.12 Effect of NO on soluble sugar content of tomato at pink stage
粉红期番茄在贮藏过程中,可溶性糖含量总体呈先上升后下降趋势(图12)。20、40、60μL·L-1NO处理果的可溶性糖含量变化趋势与对照果相似,贮藏第5d后,60μL·L-1NO处理果可溶性糖含量高于20、40μL·L-1NO处理果和对照果(p<0.05)。结果表明:60μL/L NO处理可明显减缓番茄果实中可溶性糖含量的流失。
3 讨论
本实验结果表明:NO处理促进了绿熟期和粉红期番茄中POD和SOD活性的增加,从而增强了果实清除ROS能力,提高了番茄果实的抗病性,与席钰芳和弓德强等[14-15]在桃和番荔枝中研究一致。Beligni等[16]报道了NO可促进果实CAT活性的增加,与我们的研究一致。有研究表明,NO通过影响CAT、SOD和POD的活性调节内源H2O2和的含量[17-18],也可能是SOD 、 POD、CAT和APX都是含金属离子的蛋白,可能是NO的靶酶,NO可与其结合形成硝酰化复合物而调节酶活性,间接地调控生物体内的ROS水平。绿熟期番茄中APX活性与粉红期番茄不一样,这可能是不同成熟度的番茄,NO的作用方式不一样。也有报道表明,NO处理对草莓和桃中SOD活性无显著影响[5,19]。
MDA是脂质过氧化的主要产物之一,H2O2和O2-·的累积激发了MDA的产生,促进了细胞膜脂过氧化,加速了果实的衰老[20]。本实验研究表明,NO处理有效延缓了绿熟期番茄中MDA含量的增加,这可能是未成熟果实中內源NO含量较高,与外源NO共同作用减少自由基对膜脂的伤害。推测是NO处理提高了SOD、POD活性,从而在一定程度上清除了降低了自由基对果实膜脂的伤害,这与张少颖[21]和徐福乐[22]的研究一致。这也可能与NO诱导了谷胱甘肽(glutathione,GSH)、还原性抗坏血酸酶(Ascorbic acid,AsA)、这类非酶类清除剂活性的增加,从而防止等活性氧自由基的累积引起的MDA的大量产生以及膜脂过氧化导致的果实衰老。NO处理的粉红期番茄中MDA的含量随着贮藏时间的延长不断上升,虽然粉红期NO处理果MDA含量比对照果低,但与绿熟期番茄相比MDA含量较高。这些研究表明NO处理对MDA含量的不同可能与果实本身品种和成熟度有关。
4 结论
用60μL·L-1NO处理能显著提高绿熟期和粉红期番茄CAT、POD、SOD活性和绿熟期番茄中APX的活性,减少绿熟期番茄中MDA含量,延缓果实可溶性糖的流失和衰老。但NO处理粉红期番茄果实中APX活性含量较低,MDA含量较大,推测可能是NO对绿熟期和粉红期这两种不同成熟度番茄中作用方式不一样。
[1]MILLA A H,DAY D A.Nitric oxide inhibits the cytochrome oxidase but not the alternative oxidase of plant mitochondria[J]. FEBS Letters,1996,398(3):155-158.
[2]Šírová J,Sedlárˇová M,Piterková J,et al.The role of nitric oxide in the germination of plant seeds and pollen[J].Plant Science,2011,181(5):560-572.
[3]MANJUNATHA G,LOKESH V,NEELWAME B.Nitric oxide in fruitripening:trendsand opportunities[J].Biotechnology Advances,2010,28(4):489-499.
[4]ZHENG Y,SHEN L,YU M,et al.Nitric oxide synthase as a postharvest response in pathogen resistance of tomato fruit[J]. Postharvest Biology and Technology,2011,60(1):38-46.
[5]朱树华.一氧化氮对草莓和肥城桃果实成熟衰老的调控机理[D].泰安:山东农业大学,2006.
[6]韩泽群,姜波.加工番茄产量组合预测模型研究[J].中国农学通报,2013,29(3):161-165.
[7]TIAN S P,LI B Q,XU Y.Effect of O2and CO2concentration on physiology and quality of litchi fruit in storage[J].Food Chemistry,2005,91(4):659-663.
[8]WANG Y,TIAN S,XU Y.Effects of high oxygen concentration on pro-and anti-oxidant enzymes in peach fruits during postharvest periods[J].Food Chemistry,2005,91(1):99-104.
[9]BEERS R F,SIZER I W.A spectrophotometric method for measuring the breakdown of hydrogen peroxide by catalase[J]. Journal of Biological Chemistry,1952,195(1):133-140.
[10]RAHNAMA H,EBRAHIMZADEH H.The effect of NaCl on antioxidant enzyme activities in potato seedlings[J].Biologia Plantarum,2005,49(1):93-97.
[11]陈德碧.水杨酸对枇杷采后品质和衰老的影响[D].重庆:西南大学,2008.
[12]张维静,陆海,杜希华.抗坏血酸过氧化物酶在植物抵抗氧化胁迫中的作用[J].山东师范大学学报,2008,23(4):113-115.
[13]孙存普,张建中,段绍瑾.自由基生物学导论[M].北京:中国科学技术出版社,1999.
[14]席钰芳,应铁进,郑永华.振动胁迫对桃果实衰老的影响[J].园艺学报,1997,26(4):263-264.
[15]弓德强,马蔚红,王松标,等.低温冷藏对芒果品质及膜脂过氧化的影响[J].中国农学通报,2008,24(3):401-404.
[16]BELIGNI M V,FATH A,PAUL C B,et al.Nitric oxide acts as an antioxidant and delays programmed cell death in barley aleurone layers[J].Plant Physiology,2002,129(4):1642-1650.
[17]CLARK D,DUMER J,NAVARRE D A,et al.Nitric oxide inhibition of tobacco catalase and ascorbate peroxidase[J]. Molecular Plant-microbe Interactions,2000,13(12):1380-1384.
[18]刘建新,胡浩斌,王鑫.外源一氧化氮供体对铺胁迫下黑麦草幼苗活性氧代谢、光合作用和叶黄索循环的影响[J].环境科学学报,2009,29(3):626-633.
[19]张阔,秦文,李正国,等.草酸对桃贮藏期抗性相关酶活性的诱导[J].食品科学,2010,31(22):492-495.
[20]曹丽军,赵彩平,刘航空,等.不同耐贮性桃果实膜脂过氧化相关酶活性变化[J].西北农业学报,2013(1):18.
[21]张少颖,任小林,饶景萍.NO处理对采后番茄活性氧代谢影响[J].园艺学报,2005,32(5):818-822.
[22]徐福乐.外源一氧化氮处理对番茄采后生理的影响及保鲜效果研究[D].北京:中国农业科学院,2008.
Effect of nitric oxide on the antioxidant enzymes of tomato fruit at mature green and pink stage during storage
LI Jie1,WEN Xin-ye1,ZHANG Hui1,GAO Jing3,GUO Qin3,ZHANG Yu-li2,WU Zhong-hong2,WU Bin2,*
(1.College of Food Science and Pharmaceutical Science,Xinjiang Agricultural University,Urumqi 830052,China;2.Institute of Agro-products Storage and Processing,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China;3.College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi 830046,China)
Effects of nitric oxide(NO)on the antioxidant enzymes of postharvest tomato fruit were investigated in this study.Tomato fruits harvested at mature green and pink stage were fumigated with 20,40,60μL·L-1NO,then stored at 16℃with 85%relative humidity(RH)for 20d.Changes in these levels of superoxide dismutase(SOD),peroxidases(POD),catalase(CAT)and ascorbate peroxidase(APX),respectively,were measured during storage.Results indicated that NO treatment induced the increase in the activities of SOD,POD,CAT activities of tomato fruit at mature green and pink stage.NO treatment induced the APX activity,reduced MDA content,and delayed the losing of soluble sugar of tomato fruits at mature green stage.The concentration of 60μL·L-1NO had the better effect on tomato fruits.However,there was no significant influence on the APX activity and MDA content of tomato fruits at pink stage.
nitric oxide;tomato;postharvest;antioxidant enzymes
TS255.3
A
1002-0306(2014)06-0329-06
2013-07-08 *通讯联系人
李洁(1990-),女,硕士研究生,研究方向:果蔬贮藏与加工。
国家自然基金(31260407);自治区科学基金项目(2013211A038)。

