大孔树脂纯化血管紧张素酶抑制肽VLPVPR的工艺优化
李 艳,孙海燕,周丽珍,刘 冬
(深圳职业技术学院,深圳市发酵精制检测系统重点实验室,广东深圳518055)
大孔树脂纯化血管紧张素酶抑制肽VLPVPR的工艺优化
李 艳,孙海燕,周丽珍,刘 冬*
(深圳职业技术学院,深圳市发酵精制检测系统重点实验室,广东深圳518055)
考察大孔树脂(AB8,D101,DM130,HPD100B,HPD826)对血管紧张素酶抑制肽VLPVPR的吸附性能及纯化效果,确立纯化VLPVPR的较优工艺。结果表明,HPD100B最适于VLPVPR的纯化。最优纯化工艺为:温度20℃,pH9.8,上样流速为3mL/(cm2·min),上样量达到180mL,洗脱液乙醇溶液浓度为60%,洗脱流速为0.25mL/(cm2·min),洗脱体积为45mL。此条件下,VLPVPR的解吸率达93.1%,纯度为28.8%,血管紧张素酶抑制率IC50为4.1μmol/L。
血管紧张素酶抑制剂,VLPVPR,大孔树脂,纯化
血管紧张素酶抑制肽是一类能通过抑制血管紧张素转化酶活性从而达到降低血压的小分子多肽,其主要来源于天然动植物及微生物蛋白质,具有降压效果明显、无毒副作用等特点[1-4]。目前,日本是血管紧张素酶抑制肽研究最多的国家,主要从乳清蛋白及鱼类蛋白中提取。我国起步较晚,吴建平等[5]在对大豆降血压肽的研究及酶系选择和参数优化方面做了许多研究。
VLPVPR(Val-Leu-Pro-Val-Pro-Arg)[6]是通过构建的基因工程菌E.coli BL21(pGEX-4T-2-AHP),重组的6拷贝串联肽以融合蛋白GST-AHP形式由乳糖诱导表达,采用胰蛋白酶水解GST-AHP得到的血管紧张素酶抑制肽单体。肽分离的一般思路是先去除分子量较大、不水解的蛋白质,再根据分子量大小,采用凝胶过滤分离得到目的短肽。如果ACE抑制肽结构相近,则需根据电荷、分子极性差异等性质结合离子交换层析、疏水层析和RP-HPLC等其他分离方法来达到分离目的。刘冬等[7]在对利用基因工程技术生产降血压肽研究中,采用亲和层析法对GST-AHP进行分离,GST-AHP吸附量达3.86mg/mL,回收率达到96.5%,并通过RP-HPLC法对降血压肽进行纯化,可实现降血压肽的完全分离,重组降血压肽KVLPVP的IC50为4.6μmol/L,对ACE为竞争性抑制剂,动物实验表明,给药剂量为300ug/kg(体重)时,AHP对高血压大鼠具有显著降压效果,而对血压正常大鼠无显著的降血压作用。由于凝血酶和亲和层析剂价格昂贵而导致操作成本过高,从而阻碍了VLPVPR的产业化前景。大孔树脂[8-10]有物理化学稳定性高、比表面积大、吸附量大、选择性好、吸附速度快、价钱便宜等优点,近年来广泛应用于活性成分的分离纯化。本文拟考察大孔树脂对VLPVPR的纯化效果,通过静态吸附解吸实验和动态吸附解吸实验,选择适宜的树脂,并对其分离纯化工艺条件进行优化。
1 材料与方法
1.1 材料与仪器
血管紧张素抑制肽VLPVPR溶液 自制;大孔树脂 见表1,沧州宝恩化工有限公司;三氟乙酸(TFA) 色谱纯,日本东京化学工业株式会社;乙腈(ACN) 色谱纯,天津协和昊鹏色谱科技有限公司;VLPVPR标准品(纯度大于95%) 西安美联多肽合成有限公司;血管紧张素转化酶马尿酸(HA)、马尿酰组氨酰亮氨酸(HHL)、血管紧张素转化酶(ACE)美国Sigma公司;其他试剂 均为国产分析纯。
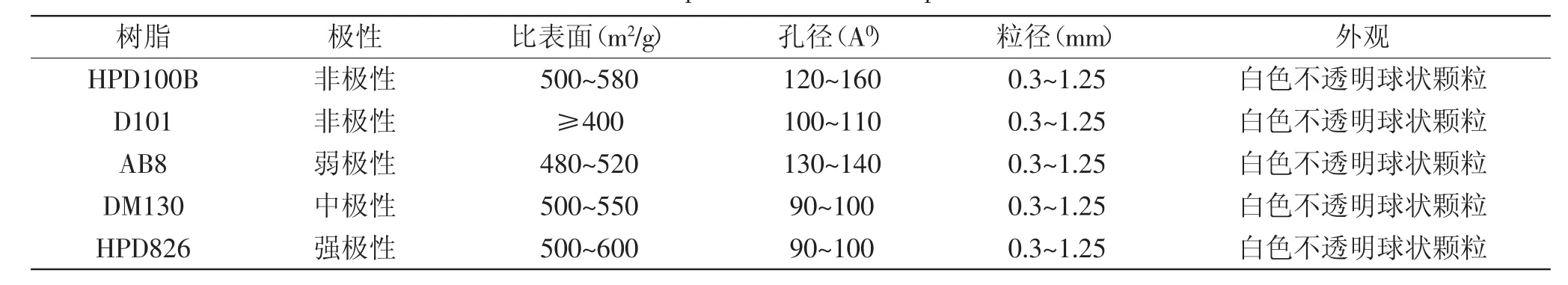
表1 大孔树脂的性能指标Table.1 The performance of macroporous resin
HEQ-X 100型振荡培养箱 哈尔滨市东联电子技术开发有限公司;Prominence LC-20AT高效液相色谱仪 日本岛津公司;层析柱(C16/40)、ÄKTA explorerTMGE Healthcare公司。
1.2 实验方法
1.2.1 标准曲线的制备 采用RP-HPLC法测定血管紧张素抑制肽VLPVPR含量。具体方法如下:色谱柱:ZORBAX Eclipse XDB-C18(250mm×4.6mm,5μm);流动相组成:A相为100%水+0.05%(v/v)TFA,B相为100%ACN+0.05%(v/v)TFA;进样体积为20μL,流速1mL/min,柱温35℃,洗脱浓度为11.5%(B相)50min,检测波长为199nm。
1.2.2 血管紧张素抑制肽VLPVPR溶液的制备 参考卢真保[11]的方法,利用已构建的E.coli BL21工程菌进行高密度发酵,发酵液经4000r/min离心10min,收集菌体。每克湿菌体置于3mL含有2mol/L EDTA的1×PBS缓冲液中,加溶菌酶至终浓度20000U/mL,室温放置30min后超声破碎30min,4℃12000r/min离心10min,取上清液进行胰蛋白酶水解,酶解温度为37℃,pH8.0,酶浓度为90U/mL样品,酶解时间为4h,再12000r/min离心15min取上清液,过0.45μm膜。
1.2.3 树脂预处理 树脂用95%乙醇浸泡24h,使之充分溶胀,去除上层漂浮的杂质和破碎的树脂,过滤,再浸泡于0.1mol/L的NaOH 30min,用蒸馏水充分漂洗至中性,过滤,再浸泡于0.1mol/L的HCl 30min,用蒸馏水充分漂洗至中性,减压抽干,备用。
1.2.4 大孔树脂静态吸附与解吸
1.2.4.1 静态解吸实验 将充分吸附后的树脂用蒸馏水洗涤至无溶液残留,用滤纸吸干水分,加入50mL乙醇溶液,20℃,置于摇床以100r/min的速率振荡12h,测定溶液中VLPVPR的浓度。吸取0.5mL检测VLPVPR浓度。根据以下公式,计算各种树脂对VLPVPR的解吸量及解吸率,考察洗脱液的浓度(60%、80%、95%)对树脂洗脱性能的影响。
M2=C2×V2
M(%)=(M2/M1)×100
式中,M2:VLPVPR解吸量(mg);C2:解吸液中VLPVPR浓度(mg/L);V2:解吸液体积(L);M:VLPVPR解吸率(%)。
1.2.4.2 静态吸附实验 分别准确称取1.0g AB8、D101、DM130、HPD100B、HPD826经预处理的干树脂置于100mL锥形瓶中,加入样品溶液50mL,一定温度下,置于摇床上以100r/min的速率振荡一定时间,测定溶液中VLPVPR的浓度。根据以下公式,计算各种树脂对VLPVPR的吸附量及吸附率,考察树脂种类(HPD100B、D101、AB8、HPD826、DM130)、pH(4、6、8、9.8、12)及温度(20、30、40、50℃)对树脂吸附性能的影响。
M1=(C0-C1)×V1
X(%)=(C0-C1)/C0×100
式中,M1:树脂对VLPVPR吸附量(mg);C0:吸附前溶液中VLPVPR浓度(mg/L);C1:吸附后溶液中VLPVPR浓度(mg/L);V1:溶液体积(L);X:树脂对VLPVPR吸附率(%)。
1.2.5 大孔树脂动态吸附及解吸
1.2.5.1 动态吸附实验 将预处理好的大孔树脂(10.0g)湿法装入到层析柱中,待树脂自然沉降均匀后以2mL/(cm2·min)压实填料,用60mL蒸馏水平衡,流速为1mL/(cm2·min)。将样品溶液以一定的流速上柱,测定流出液中VLPVPR的浓度及纯度,计算VLPVPR的动态吸附率,考察样品溶液流速(2、3、4mL/(cm2·min))及上样量(2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32VB,其中VB为树脂柱中树脂体积)对树脂吸附性能的影响,确定最佳吸附工艺条件。取10mL洗脱液,冻干,称重。纯度计算公式如下:纯度(%)=m2/m1×100,其中,m1为10mL洗脱液冻干后质量(mg),m2为10mL洗脱液中VLPVPR的质量(mg)。
1.2.5.2 动态解吸实验 对吸附饱和的树脂进行洗脱实验,以一定流速一定浓度一定量的乙醇溶液进行洗脱,收集洗脱液,测定洗脱液中VLPVPR的浓度及纯度,计算VLPVPR的动态解吸率,考察洗脱溶剂浓度(40%、50%、60%、70%、80%,v/v)、流速(0.125、0.25、0.5、1mL/(cm2·min))和体积(5、10、15、20、25、30、35、40、45mL)对树脂解吸性能的影响,确定最佳解吸工艺条件。
1.2.6 血管紧张素转化酶体外抑制活性的测定方法
通过RP-HPLC法测定马尿酸的含量来评估样品对ACE活性的抑制率。具体条件如下:色谱柱:VYDAC 238EV54 C18(250mm×4.6mm,5μm);流动相:A相为100%ACN添加0.1%(v/v)TFA,B相为5%(v/v)ACN添加0.1%(v/v)TFA;洗脱梯度:A相30%~40%10min;流速:0.8mL/min;检测波长:228nm;柱温:30℃;进样量:20μL。计算公式如下[12]:
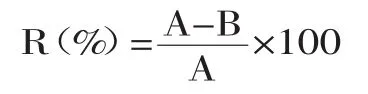
式中:R:样品对ACE的抑制率(%);A:空白对照组中马尿酸的峰面积;B:添加VLPVPR组中马尿酸的峰面积。
在HHL和ACE酶的反应体系中分别加VLPVPR至终浓度为0、3、6、9、12、15μmol/L,测定抑制率,以VLPVPR浓度为横坐标,抑制率为纵坐标做曲线,从曲线查得IC50。
2 结果与分析
2.1 标准曲线的绘制
VLPVPR标准品色谱图见图1。以液相相应面积为横坐标,以VLPVPR浓度为纵坐标,绘制标准曲线(见图2)。

图1 VLPVPR液相色谱图Fig.1 HPLC of VLPVPR
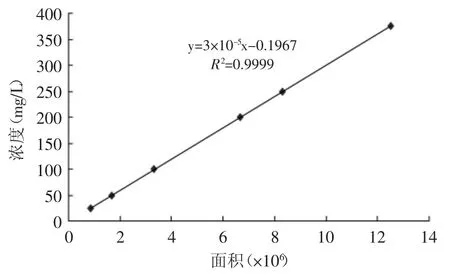
图2 VLPVPR标准曲线Fig.2 Standard curve of VLPVPR
2.2 树脂筛选结果与分析
2.2.1 不同时间树脂静态吸附实验 实验结果见图3。结果表明,HPD100B与D101,有较高的吸附率,AB8与DM130次之,HPD826吸附率最低。五种树脂均可作为VLPVPR的吸附树脂,HPD100B更适合用来吸附VLPVPR。
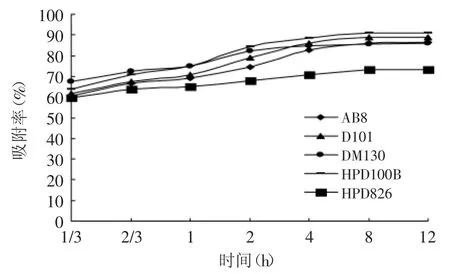
图3 树脂吸附曲线Fig.3 Adsorption curve of different resins
树脂与目标物质的极性和空间结构是影响吸附性能的重要因素。由于相似相溶原理,极性相近有利于树脂与目标物质之间的吸附,大的孔径有利于目标物质在树脂颗粒内部的扩散,大的比表面则增强目标物质与树脂的吸附能力。
实验所用的树脂分为氢键、中极性、非极性和弱极性三种类型。VLPVPR非极性功能团较多,理论上有利于被非极性树脂吸附,实验结果与理论一致,非极性树脂HPD100B与D101对VLPVPR有较高的吸附率。HPD100B的吸附率高于D101,这可能是因为HPD100B的孔径和比表面大于D101,更有利于VLPVPR在树脂颗粒内部自由进出,并增强树脂与VLPVPR间的吸附能力。
2.2.2 不同树脂静态解吸实验结果及分析 用不同浓度的乙醇溶液对吸附饱和的树脂进行解吸,结果见表2。
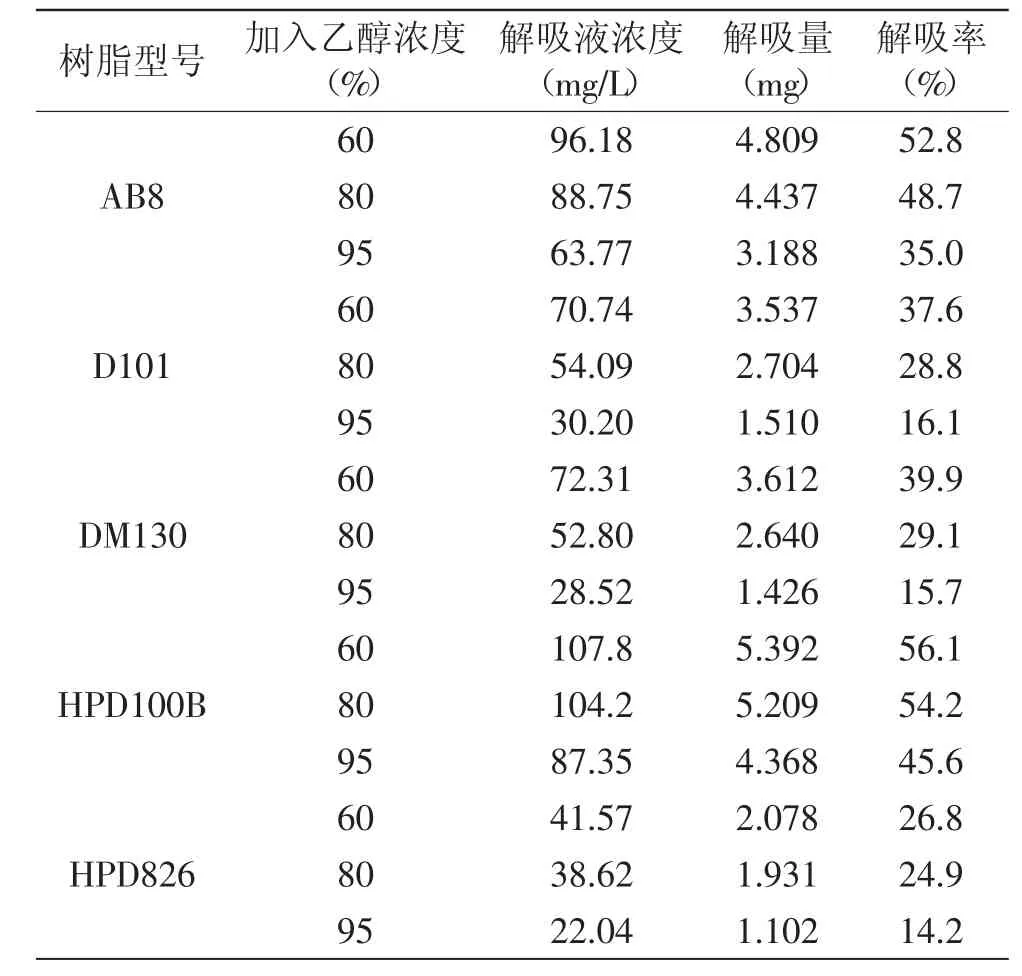
表2 各种树脂非流动态解吸数据Table.2 Desorption data of different resins under static condictions
实验结果表明,乙醇溶液浓度的增加,五种树脂的解吸率均递减,即乙醇浓度越高,越不利于解吸,这可能是因为VLPVPR的溶解度随乙醇溶液的浓度增加而降低。浓度为60%的乙醇进行解吸时,HPD100B与AB8对VLPVPR的解吸率较高,均达到50%以上,D101与DM130次之,HPD826最低。
综合静态吸附与解吸实验可知,五种树脂中HPD100B对VLPVPR有较高的吸附率和解吸率,故确定HPD100B为分离纯化VLPVPR的最佳树脂。
2.3 静态吸附条件优化
2.3.1 样品pH对树脂吸附效果的影响 pH影响VLPVPR电离程度,会改变VLPVPR分子极性,因此改变大孔树脂对VLPVPR的吸附能力。pH会影响VLPVPR的溶解度,pH越接近等电点,VLPVPR的溶解度越低。吸附过程中,pH接近VLPVPR等电点时,VLPVPR在溶液中的溶解度下降,有利于VLPVPR向树脂转移。不同pH下VLPVPR吸附曲线见图4。结果表明,当pH为9.8时,VLPVPR与树脂间吸附力最强,吸附效果最好,这可能与VLPVPR在该pH下分子极性最弱有关(VLPVPR理论等电点为9.78)。
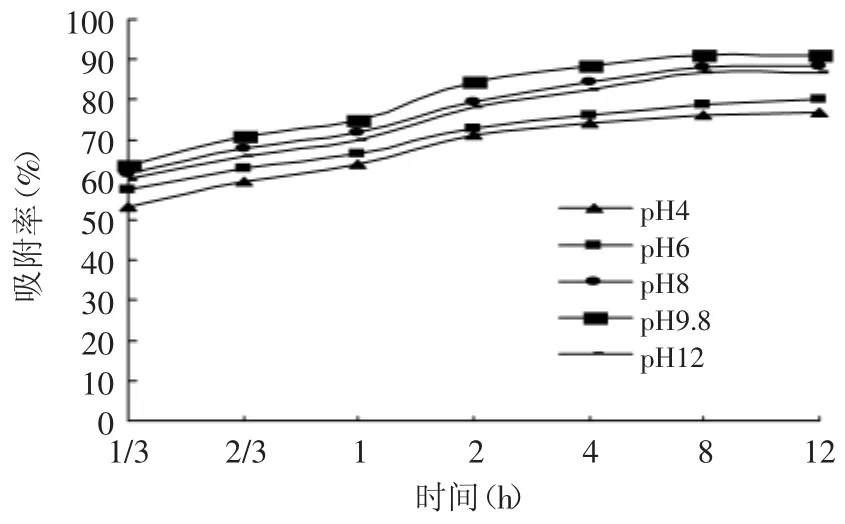
图4 不同pH吸附曲线Fig.4 Adsorption curve of different pH
2.3.2 温度对树脂吸附效果的影响 不同温度下VLPVPR吸附曲线见图5。
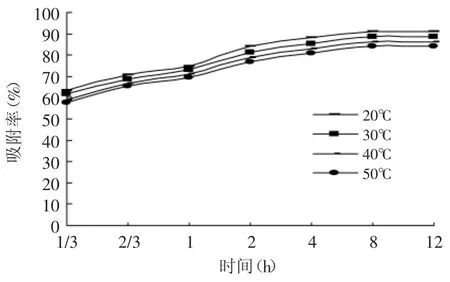
图5 不同温度吸附曲线Fig.5 Adsorption curve of different temperatrue
结果表明,随着温度的升高,HPD100B对VLPVPR的吸附率逐渐降低。HPD100B是非极性树脂,其与VLPVPR间的吸附主要是通过分子间作用力实现的。温度升高,VLPVPR自身分子动能上升,热运动加剧,其与树脂间的作用力的减弱,故吸附过程应选择低温操作。故选择20℃温度。
2.4 动态吸附及解吸条件的优化
2.4.1 动态吸附条件优化
2.4.1.1 上样流速对VLPVPR吸附率与纯度的影响流速对树脂吸附的影响主要是由于影响溶质向树脂表面扩散,从而影响了吸附效果。流速过高,溶质分子来不及扩散到树脂的内表面,就会发生漏过。不同上样流速下VLPVPR吸附率与纯度结果如表3所示。
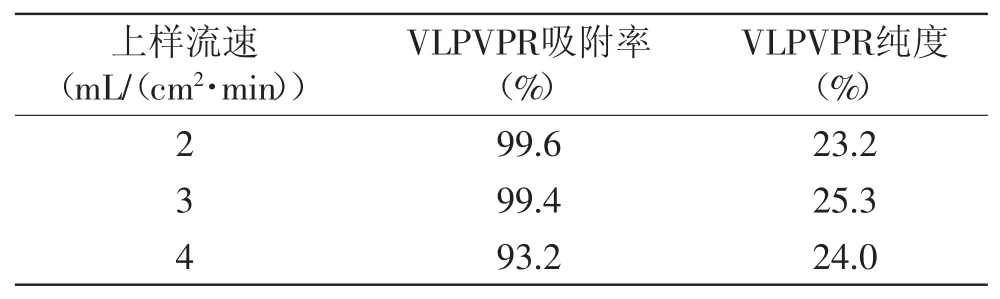
表3 上样流速对VLPVPR吸附率与纯度的影响Table.3 Influence of material different flow rate on VLPVPR yield and purity
结果表明上样流速越慢,越有利于VLPVPR的吸附,原因在于低流速下,VLPVPR与树脂间有充足的接触时间,提高吸附率。从表3可以看出,上样流速为2、3mL/(cm2·min)时VLPVPR几乎没有漏吸,因为样品中VLPVPR含量很低,而树脂的吸附量很大,流速快可以缩短生产周期。继续升高上样流速至4mL/(cm2·min)时,VLPVPR的吸附率和脱液中VLPVPR的纯度均降低,因此,选择上样流速3mL/(cm2·min)为最佳的流速。
2.4.1.2 上样体积对VLPVPR吸附率与纯度的影响VLPVPR吸附透过曲线见图6。图6表明,当吸附体积达到32VB时,流出液中VLPVPR的浓度达到最大,HPD100B树脂对VLPVPR具有较强的吸附。当上样液体积为12VB时,流出液未检测到VLPVPR,故选择12VB即180mL为上样体积,以防止VLPVPR漏吸。
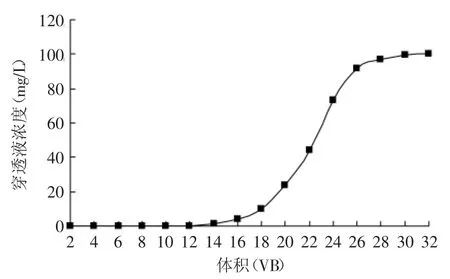
图6 流动态吸附透过曲线Fig.6 The dynamic curve of adsorption
2.4.2 动态解附条件优化
2.4.2.1 解吸剂浓度对VLPVPR解吸率和纯度的影响 不同浓度的乙醇溶液对VLPVPR解吸率和纯度影响见表4。结果表明,随着乙醇浓度的增加,VLPVPR的纯度呈现上升的趋势;当乙醇浓度达到60%时,VLPVPR的纯度最高;继续增大乙醇浓度,VLPVPR的纯度有所降低。随着乙醇浓度的增加,VLPVPR的解吸率呈现上升的趋势;当乙醇浓度达到60%后,VLPVPR的解吸率最高,继续增大乙醇浓度VLPVPR的解吸率降低。
一方面,乙醇溶液浓度不同,乙醇溶液的极性也不同,不同极性的乙醇溶液将影响VLPVPR与HPD100B的分子间作用力。另一方面,随着乙醇溶液浓度的增加,VLPVPR在乙醇溶液中的溶解度减小。正是这两种作用的相互竞争造成了VLPVPR的解吸率先上升,当乙醇浓度超过60%解吸率降低。另外,乙醇浓度超过60%时,VLPVPR的纯度也下降,说明了高浓度的乙醇洗脱会带来更多的杂质。综合考虑以上因素,选择60%的乙醇溶液作为分离VLPVPR的洗脱剂。
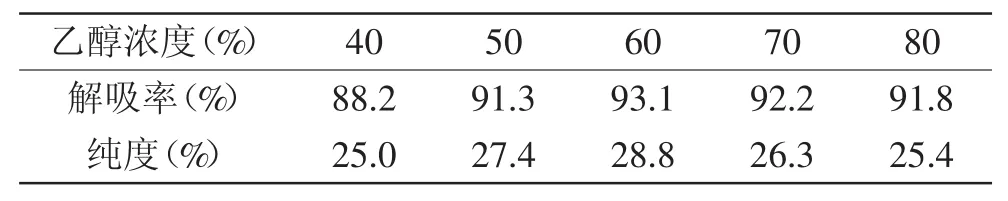
表4 乙醇浓度对VLPVPR分离效果的影响Table.4 Effect of alcohol concentration on yield and purity of VLPVPR
2.4.2.2 解吸剂流速对VLPVPR解吸率和纯度的影响 不同流速下VLPVPR解吸率和纯度的实验结果见表5。结果表明,随着洗脱流速的增大,VLPVPR的解吸率及纯度均呈现下降的趋势。其原因可能是洗脱速度增大,洗脱液与树脂的作用时间缩短,洗脱液对VLPVPR的溶解还未达到饱和时就达到动态平衡,从层析柱流出,因此有部分VLPVPR被吸附在树脂上而没有被洗脱下来。另外,流速过快,VLPVPR与杂质在树脂中来不及分开而一起洗脱流出。在流速为0.125、0.25mL/(cm2·min)时,VLPVPR解吸率与纯度相差很小。考虑低流速洗脱时间长,故选择0.25mL/(cm2·min)为洗脱流速,解吸率为93.1%。
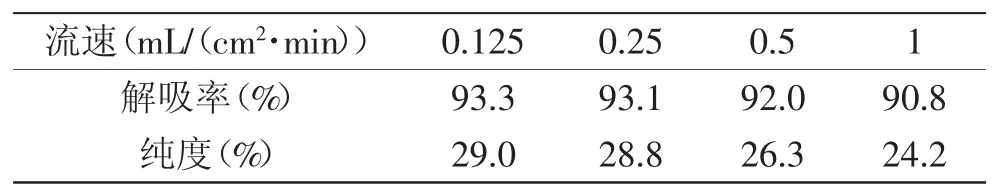
表5 不同乙醇流速对VLPVPR解吸率和纯度的影响Table.5 Effect of different alcohol flow rate on yield and purity of VLPVPR
2.4.2.3 解吸剂体积对VLPVPR吸附率的影响 绘制动态解吸曲线,由图7可知,采用60%的乙醇溶液进行洗脱时,洗脱峰集中,对称,无明显拖尾现象,采用3VB即45mL可将VLPVPR完全洗脱下来。
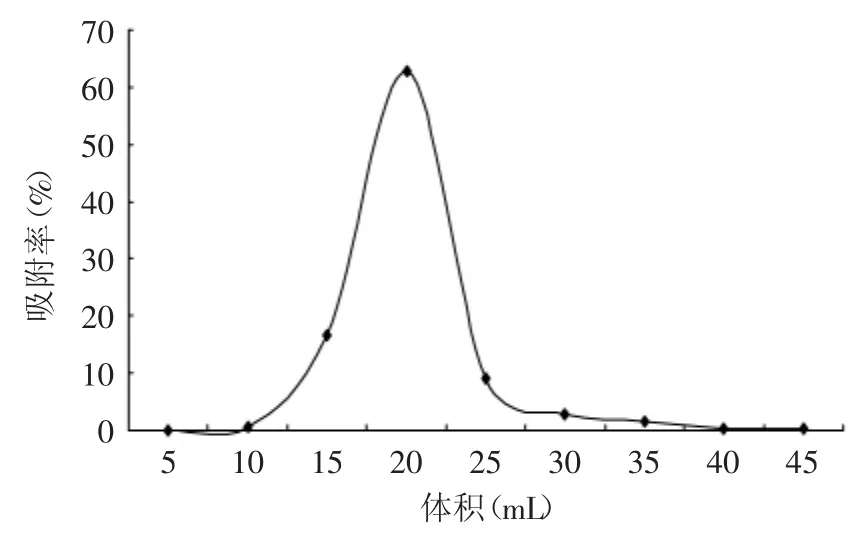
图7 动态解吸曲线Fig.7 The desorptiom curve of dynamic state
2.5 血管紧张素转化酶体外抑制活性的测定
马尿酸标准品色谱图见图8,马尿酸的保留时间为4.1min。以VLPVPR浓度为横坐标,以ACE活性抑制率为纵坐标,绘制曲线(见图9),VLPVPR的解析率达93.1%,纯度为28.8%。当ACE活性抑制率为50%时,VLPVPR的浓度为4.1μmol/L,即IC50为4.1μmol/L。纯化前的VLPVPR溶液因浓度太低,无法测定其血管紧张素转化酶体外抑制活性。
图8 马尿酸标准品液相色谱图Fig.8 Chromatography of hippuric acid standard
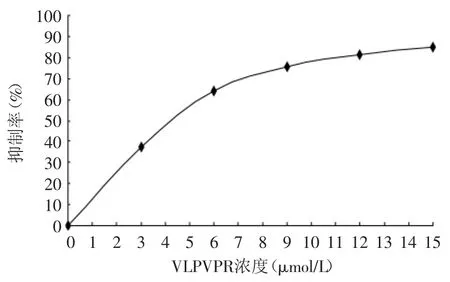
图9 重组VLPVPR对ACE的抑制率Fig.9 Inhibitory rate of recombinant VLPVPR on ACE
3 结论
本实验通过静态吸附解吸实验确定HPD100B对VLPVPR吸附率大,解吸率高,适用于VLPVPR的分离纯化。大孔树脂价钱便宜,广泛应用于活性成分的分离纯化中,利于VLPVPR的产业化应用。结合静态吸附解吸结果,通过动态吸附实验确定VLPVPR最优的纯化工艺条件为:温度20℃,pH为9.8,上样流速为3mL/(cm2·min),上样量为180mL,洗脱液乙醇溶液浓度为60%,洗脱流速为0.25mL/(cm2·min),洗脱体积为45mL。采用最优纯化条件,VLPVPR的解吸率达93.1%,纯度为28.8%,ACE酶抑制活性IC50为4.1μmol/L。
[1]Yamamoto N,Ejiri M,Mizuno S.Biogenic peptides and their potential use[J].Curr Pharm Des,2003,9(16):1345-1355.
[2]李世敏,刘冬,孙海燕,等.玉米活性多肽降血压作用及其机制的研究[J].营养学报,2007,29(2):186-188.
[3]Fujita H,Yokoyama K,Yoshikawa M.Classification and antihypertensive activity of angiotensin I-converting enzyme inhibitory peptides derived from food proteins[J].J Food Sci,2000,65(4):564-569.
[4]Fitz Gerald RJ,Meisel H.Milk protein-derived peptide inhibitors of angiotensin I-converting enzyme[J].BrJ Nutr,2000,84(1):33-37.
[5]吴建平,丁霄霖.大豆降压肽的研制(Ⅰ)—生产高活性ACEI肽酶系的筛选[J].中国油脂,1998,23(2):49-51.
[6]Liu D,Sun H,Zhang LJ,et al.High-level expression of milkderived antihypertensive peptide in Escherichia coli and its bioactivity[J].J Agric Food Chem,2007,55(13):5109-5112.
[7]Liu D,Li SM,Zhang LJ,et al.Construction of angiotensinconverting enzyme inhibitory peptide gene and expression of the fusion protein in E.coli[J].ACS National Meeting,2004:211-221.
[8]曹增梅,黄和.大孔树脂纯化番石榴多酚的工艺优化[J].食品工业科技,2013,34(7):215-218.
[9]邵盈盈,李向荣.大孔树脂纯化蓝莓总黄酮及其抗氧化活性研究[J].食品工业科技,2013,34(7):73-76.
[10]冀德富,郭东艳.HPD100大孔树脂纯化叶下珠总多酚的工艺研究[J].中华中医药杂志,2013,28(1):240-242.
[11]卢真保,刘冬,李世敏,等.胰蛋白酶水解工程菌表达产物制备重组降血压肽[J].现代食品科技,2008,24(5):412-414.
[12]刘力生.高血压[M].北京:人民卫生出版社,2003.
Optimization of purification process of angiotensin converting enzyme inhibitor peptide VLPVPR with macroporous resin
LI Yan,SUN Hai-yan,ZHOU Li-zhen,LIU Dong*
(Shenzhen Polytecnic,Shenzhen Key Laboratory of Fermentation,Purification and Analysis,Shenzhen 518055,China)
To separate and purify angiotensin converting enzyme inhibitor peptide VLPVPR,the absorption capability and purification effect of VLPVPR on macroporous resin were evaluated.Adsorption and desorption experiments were carried out to screen the suitable macroporous resin for VLPVPR.HPD100B was the best macroporous resin for purification of VLPVPR.The optimization condition were temperature 20℃,pH9.8,feeding rate 3mL/(cm2·min),feeding volume 180mL,ethanol concertration 60%,elute rate 0.25mL/(cm2·min)and elute volume 45mL.The desorption ratio was 93.1%,the purity ratio was 28.8%and the inhibition ratio(IC50)of the ACE was 4.1μmol/L.
angiotensin converting enzyme inhibitor peptide;VLPVPR;macroporous resin;purification
TS201.1
B
1002-0306(2014)06-0206-06
2013-06-21 *通讯联系人
李艳(1982-),女,博士研究生,助理研究员,研究方向:生物活性物质功效及应用。
广东省科技计划项目(2011B010500006);广东省高等职业院校珠江学者岗位计划资助项目(2011)。

