水貂源肺炎雷伯菌的分离鉴定及致病性测定
(山东省邹平县畜牧兽医局,山东邹平 256200)
水貂源肺炎雷伯菌的分离鉴定及致病性测定
王 剑,韩耀东,杨 广
(山东省邹平县畜牧兽医局,山东邹平 256200)
[目的]为鉴定引发某养殖场水貂死亡的主要致病菌。[方法]从送检病貂获取的两株优势菌进行形态学和培养特征观察、生化试验、细菌16S-23S rRNA ISR基因的PCR鉴定、药物敏感试验、致病性试验。[结果]16S-23S rRNA ISR基因的PCR序列分析显示两分离株与已知的Kpn相应序列的同源性为99.9%。药物敏感试验表明分离菌株对阿米卡星、头孢曲松、头孢他啶高度敏感。致病性试验表明两菌株对小鼠均有较强的致病性,半数致死量分别为4.9×106cfu/mL、3.1×106cfu/mL。[结论]确诊分离到的两株优势菌是肺炎克雷伯菌,且该菌是导致水貂死亡的主要致病菌。
水貂;肺炎克雷伯菌;分离鉴定;致病性
肺炎克雷伯菌(Klebsiella pneumoniae)属于肠杆菌科、克雷伯菌属,被列为条件致病菌,是目前公认的导致动物和人类发病的克雷伯氏菌[1-2],可引起支气管炎、肺炎、泌尿系统和创伤感染、败血症、脑膜炎、腹膜炎等[3]。现已从禽类[4]、两栖类、鱼类[5]、水貂[6]等多种动物体内分离到这种细菌,因此,该菌作为人畜共患病病原应当引起重视。
我国毛皮动物养殖业发展迅猛,水貂在山东地区的养殖规模逐渐扩大,养殖密度的不断提高导致各种疾病频发,条件致病菌越来越成为水貂细菌病的主要病原[8-9]。肺炎克雷伯的感染率日益升高,已经成为仅次于大肠杆菌的重要条件致病菌[10]。且随着抗生素的滥用,其耐药性逐渐增强,增加了临床治疗难度。
对2013年8—9月份山东诸城市水貂养殖户送检的颈部脓肿及肺部出血死亡的病貂,进行细菌分离并获得了两株优势菌,通过实验室检查及分子生物学诊断确诊分离到的两株优势菌是肺炎克雷伯菌。随后我们对分离细菌进行了药物敏感试验、致病性试验,结果表明本菌对多种抗菌药物产生了耐药性,且致病性较强。
1 材料和方法
1.1 材料
1.1.1 病料。2013年9月诸城市水貂养殖户送检的颈部脓肿及肺部出血死亡的病貂两只。
1.1.2 实验动物。40只体重为20-25g的洁净级昆明小白鼠购自山东泰邦生物制品有限公司。
1.1.3 主要试剂。PCR反应所用试剂(10×PCR Buffer、dNTPs、Taq酶)、pEASY-T1 cloning
vector 购自大连宝生物工程公司(Takara);SanPrep柱式DNA胶回收试剂盒、细菌DNA提取试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒均购自生工生物工程(上海)有限公司;DNA Marker DL2000购自北京全式金生物技术有限公司;微量生化发酵管和药敏纸片购自杭州天河微生物有限公司;普通营养琼脂、LB普通液体培养基、绵羊血(5%)琼脂培养基由本实验室自行配制;麦康凯琼脂培养基购自青岛高科园海博生物技术有限公司。
1.2 方法
1.2.1 细菌的分离培养。无菌取2只病死水貂的颈部脓肿液、肺脏,按常规方法将病料划线接种于普通琼脂平板、麦康凯琼脂平板、绵羊血琼脂平板,37℃培养24h后观察结果。挑取典型菌落进行纯培养并进行革兰染色、芽孢染色,显微镜下观察细菌形态特征。
1.2.2 生化鉴定。采用细菌生化鉴定管对纯培养物进行生化鉴定,接种后的发酵管置于37℃恒温培养箱中,培养18~24h,统计生化试验结果。
1.2.3 16S-23S rRNA ISR基因的PCR鉴定。将2个分离株于普通LB液体培养基中培养过夜,用细菌基因组DNA提取试剂盒提取细菌全基因组。根据文献[12]设计16S rRNA 3'-23S rRNA 5'间序列PCR扩增的通用引物。PCR产物主带胶回收后与pEASY-T1载体连接,连接产物转化入E.coli 感受态DH5α,37℃温箱培养12h,挑取单菌落增菌过夜培养,提取质粒,经BamHI /XhoI双酶切鉴定后得到的阳性克隆送生工生物(上海)公司测序。将2株分离菌的16S-23S rRNA ISR基因测序结果通过NCBI的Blast检索系统进行检索。
1.2.4 药物敏感试验。将分离纯化的2株菌接种于普通LB液体培养基进行摇菌,24h后取菌液进行平板涂布,将药敏片平铺于培养基表面,37℃培养24h后测量各种抗菌药物的抑菌环直径。按照倪语星等[11]的判定标准进行结果判定。
1.2.5 半数致死量(LD50)测定。测定2株分离株对小白鼠的LD50,分离菌在37℃摇床摇菌18h后,分别将菌液作10-1-10-10稀释后,采用平板涂布计数法测定菌液细菌数。将菌液作10-1,10-2,10-3,10-4稀释后经腹腔注射接种小白鼠(雌雄各半,随机分组),每稀释度4只,0.2 mL/只,对照组注射等量培养18h的LB液体培养基。攻毒后连续观察7d,采用Karber法计算LD50并观察小鼠死亡情况,剖检病死小鼠,采集脏器按照上述方法进行细菌鉴定。
2 结果
2.1 分离培养结果及细菌形态观察
分离获得的2株菌在普通琼脂培养基、绵羊血琼脂培养基及麦康凯琼脂培养基上可见直径约1-2mm具有黏性的菌落,用接种环挑之易拉成丝,生长丰盛。在普通琼脂培养基上呈圆形隆起、湿润、边缘整齐的乳白色大菌落。在绵羊血琼脂上形成单一灰白色、表面光滑、黏稠的小菌落,不溶血。麦康凯琼脂上菌落呈粉红色。2株分离菌革兰染色阴性,具有明显荚膜,无芽孢,菌体两端钝圆的中等大小的短杆菌,初步判定为K.pneumoniae,2株菌分别命名为KP-ZC1,KP-ZC2。
2.2 生化试验结果
对2株分离菌的纯培养物进行常规生化鉴定,2株菌鉴定结果一致,鉴定结果见表1。参照肠杆菌科细菌鉴定手册,分离的2株细菌符合Kpn的生化特性。

表1分离菌株的生化鉴定结果
2.3 16S-23S rRNA ISR基因的PCR扩增及测序结果
提取2株分离菌的基因组DNA,对其16S-23S rRNA ISR基因序列进行扩增,结果显示在941bp(主带)和1200bp左右处出现目的条带,与预期
相符(图1a)。主带纯化后的目的片段与pEASTT1载体连接转化后获得的阳性重组质粒进行PCR鉴定(图1b)。测序结果表明KP-ZC1,KP-ZC2与K.pn KCTC 2242(GenBank CP002910 )同源性为99.9%。证明两株分离菌均属于肺炎克雷伯菌。
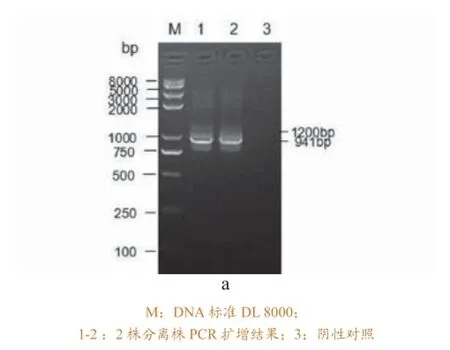
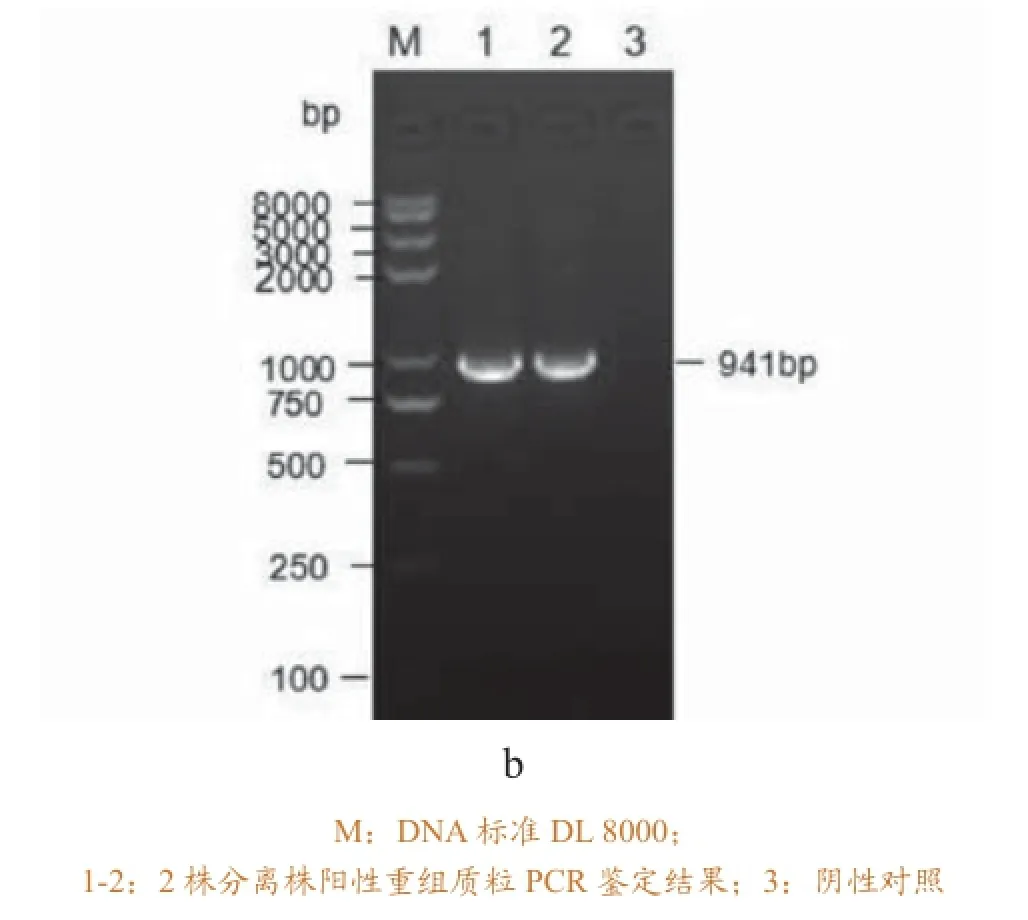
2.4 药物敏感试验结果
分别测量2株分离菌的抑菌环直径,取其平均值2株菌的药敏结果相似(表2)。结果表明分离株对阿米卡星、头孢曲松、头孢他啶高度敏感。
2.5 分离株的致病情况及LD50测定结果
剖检对照组死亡小鼠可见其肝脏肿胀出血,脾脏充血,肠道出现弥漫性出血,对照组7d内无异常,对小鼠内脏器官进行细菌分离,分离到K.pn,证明小鼠感染的细菌是K.pn且其致病性较强。平板涂布计数测得KP-ZC1、KP-ZC2原菌液数分别为1.54×1010cfu/mL、1.72×1010cfu/mL,LD50采用Karber法计算。公式如下:LD50=Lg-1[Xm-i×(Σp-0.5)],Xm为最大剂量组对数值,i为相邻两组对数剂量的差值,Σp为各组动物死亡率之和。计算可知两个分离株对小鼠的半数致死量分别为4.9×106cfu/mL,3.1×106cfu/mL(表3)。
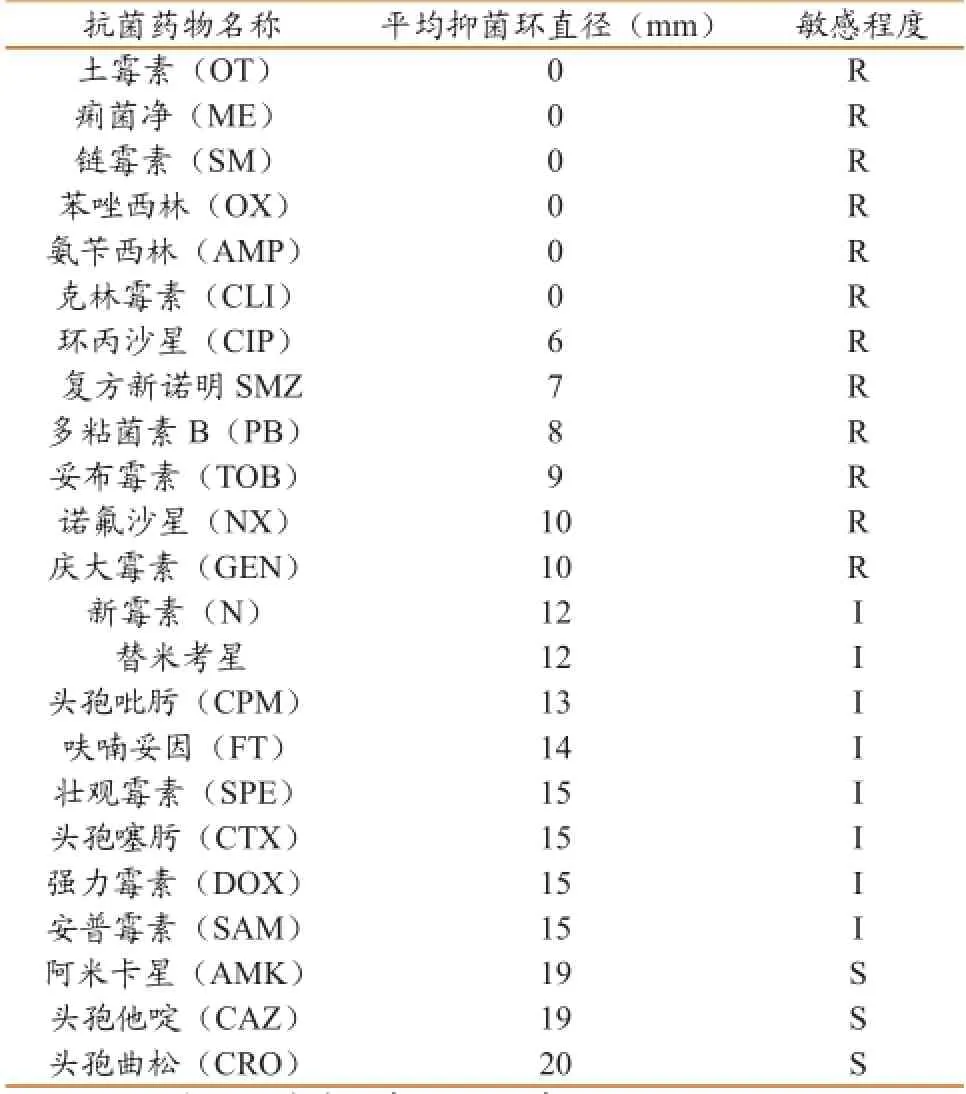
表2 2株分离菌株的药物敏感性(平均值)
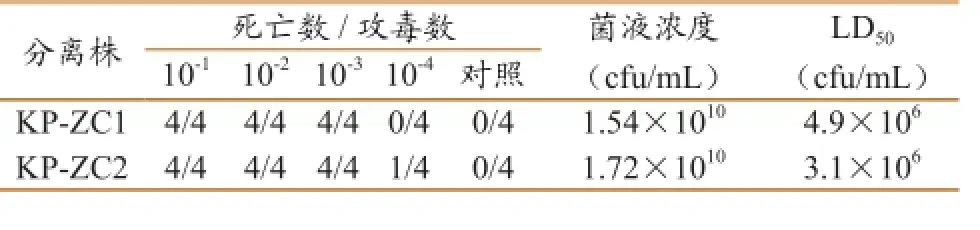
表3分离株对小白鼠的LD50
3 讨论
近年来,肺炎克雷伯氏菌引起人和动物疾病的报道在迅速增加,该菌导致了家兔的肠炎[13]、肺炎,雏鸡肝脏坏死,大熊猫的腹泻、肝炎,猪腹泻等,并引起水貂、麝鼠、竹鼠、牛等大量死亡[14-15],对水貂等毛皮动物的报道较少,其危害日益加剧,应引起足够重视。
16S-23S rRNA ISR序列是位于16S rRNA基因与23S rRNA基因间的区间序列,由16S-t RNA spacer、tRNA、tRNA-23S rRNA spacer 3部分组
成[16]。国外研究已经证实16S-23S rRNA ISR序列的进化率要强于16S rRNA基因10倍[17],因此,16S-23S rRNA ISR更适合区分不同细菌的特点。本研究在传统细菌鉴定方法的基础上又对两株优势菌进行了16S-23S rRNA ISR基因序列分析,更进一步证实了实验的准确性,因此应用基因测序方法鉴定临床上容易混淆的疾病准确性强,值得借鉴。
本文分离到的两株优势菌从培养特性、形态特征、生化特性、致病性等都与肺炎克雷伯菌相似。基因测序结果表明,两株分离菌同源性与相应的K.pn同源性高达99.9%,证明两株优势菌均为肺炎克雷伯菌。药物敏感试验结果表明分离菌株对阿米卡星、头孢曲松、头孢他啶高度敏感,对新霉素、大观霉素、安普霉素、替米考星等中度敏感,而对链霉素、土霉素等等不敏感,这可能与抗生素的滥用有关,因此建议水貂养殖户在疫情发生时,应当根据药敏试验结果选择最适药物进行治疗,避免盲目投药,错过最佳治疗时机。选择敏感实验动物小白鼠对分离菌株进行致病性实验,该菌可引起小白鼠肺炎,肝脏、脾脏、肠道出血等症状,确定分离到的两株优势菌是导致水貂死亡的主要病原菌,其半数致死量分别为4.9×106cfu/mL、3.1×106cfu/ mL,表明从肺部分离到的肺炎克雷伯菌致病性较强,这可能与该菌的致病机理有关,它是呼吸道感染的重要病原体,当机体抵抗力下降时,便经呼吸道进入肺部而引起大叶或小叶融合性实变,引起重症肺炎。
[1] Brisse S and Duijkeren E. Identification and antimicrobial susceptibility of 100 Klebsiella animal clinical isolates[J]. Vet Microbiol,2005,105(3/4):307-312.
[2] 贾艳,韩文瑜,杨洋,等. 肺炎克雷伯氏菌致病机制研究进展[C].中国畜牧兽医学会家畜传染学分会.第六届理事会第二次会议暨教学专业委员会会议论文集,大庆,2006:105-108.
[3] 贾艳. 猪源肺炎克雷伯菌菌毛致病的分子基础及其免疫相关抗原表位的筛选[D].长春:吉林大学,2007.
[4] 彭远义,刘华英,王豪举,等. 鸡肺炎克雷伯菌的生物学特性研究[J].西南农业大学学报,1995,17(4):330-333.
[5] 徐海圣,舒妙安.中华鳖肺炎克雷伯菌病的病原研究[J].浙江大学学报(理学版),2002,29(6):702-706.
[6] 胡本钢,杜崇涛,雷连成,等.貂源肺炎克雷伯菌的分离与鉴定[J].中国预防兽医学报,2011,33(8):598-600.
[7] Elsheikh L E,Karlsson K A,Bergman R,et al. Induction of protective immune response by vaccination against Pseudomonas pneumonia of mink[J]. Zentralbl Veterinarmed B,1998,35(4):256-263.
[8] Abe C,Homma J Y,Noda H,et al. Comparison of the effects of a multicomponent vaccine and a formalinkilled cell vaccine on protection against enzootic of hemorrhagic pneumonia due to Pseudomonas aeruginosa in mink[J]. Zentralbl Bakteriol A,2001,249(3):413-417.
[9] 钟世勋,崔国林,朱瑞良,等. 山东部分地区毛皮动物肺炎克雷伯菌的分离鉴定及系统发育分析[J].中国预防兽医学学报,2013,35(4):285-289.
[10] 倪语星,王金良,徐英春.抗微生物药物敏感性实验规范[M].北京:上海科学技术出版社,2002:78-79.
[11]石磊,沈宜,顾大勇,等.奇异变形杆菌、洛菲氏不动杆菌16S rRNA 3'-23S rRNA 5'间序列的克隆及测序[J].重庆医科大学学报,2006,31(6):783-786.
[12]王孝友,杨睿,沈克飞,等.兔肺炎克雷伯菌的分离与鉴定[J].中国兽医杂志,2012,48(2):43-44.
[13] 马磊,颜其贵,万莉,等.竹鼠肺炎克雷伯氏菌的分离鉴定[J].中国人兽共患病学报,2011,27(9):825-827.
[14] 朱瑞良,牛钟相,刘思当,等.山东省牛“猝死病”病原学研究[J].中国预防兽医学报,2002,24(3):210-212.
[15] Christensen H,Jorgensen K,Olsen JE. Differentiation of Campylobacter coli and C. jejuni by length and DNA sequence of the 16S-23S rRNA internal spacer region[J]. Microbiol,1999,145(1):99-105.
[16] Gurtler V,Stanisich VA. New approaches to tying and identification of bacteria using the 16S-23Sr DNA spacer region[J]. Microbiol,1996,142(1):3-16.
Isolation,Identif cation and Virulence Determination of Klebsiella pneumoniae from mink
Wang Jian,Han Yaodong
(Zouping Animal Husbandry and Veterinary Bureau,Zouping,Shandong 256200)
[Objective]To identify the main bacterial pathogens causing mink deaths in a mink farm.[Method]Two dominant bacterial isolates got from the dead minks submitted were subjected to culture and morphological observation,biochemical tests,drug susceptibility test,pathogenicity test and 16S-23S rRNA ISR sequencing.[Result]Results revealed that 16S-23S rRNA ISR gene of the two isolates shared 99.9% homology with K.pneumoniae
train. Drug sensitive test indicated that the bacterial isolates were highly sensible to sulbactam and ceftriaxone. Pathogenicity tests showed that the isolates could cause high morbidity or mortality in healthy mice and its median lethal dose was 4.9×106cfu/mL and 3.1×106cfu/mL respectively.[Conclusion]The two isolates belonged to Klebsiella peneumoniae and were the main pathogen causing mink deaths.
Mink;Klebsiella pneumoniae;Isolation and Identif cation;Virulence
S852.612;S858.92
:B
:1005-944X(2014)10-0066-04
杨广

