线粒体动力学在心血管系统疾病中的研究进展
杨广鑫,吴钟凯
线粒体动力学在心血管系统疾病中的研究进展
杨广鑫,吴钟凯
线粒体作为真核生物中一种高度动态化的细胞器,其动力学平衡是诸多生理活动的基础。近年来,关于线粒体动力学的研究取得了重大进展。但是线粒体动力学改变在心血管相关疾病的发生、发展过程中扮演的角色尚不明确。本文对近年来线粒体动力学与心血管系统研究的最新进展作一综述。
线粒体;动力学;心血管系统疾病;进展
线粒体(mitochondria)作为真核生物进行能量代谢的主要场所,在真核生物的诸多生理病理活动中扮演着极其重要的角色。线粒体在真核细胞内主要通过氧化磷酸化及合成三磷酸腺苷(adenosine triphosphate,ATP)为各种生命活动提供能量支持及保证[1]。作为一种高度动态变化的细胞器,其通过不断的融合、分裂维持整个线粒体网络的稳态,该过程被称之为线粒体动力学[2]。线粒体在融合及分裂之间的动态平衡是维持生物体众多生理活动的基础,如细胞分裂、细胞凋亡、细胞自噬和衰老等,同时也在ATP生成、Ca2+缓冲、自由基清除、线粒体DNA遗传等过程中起到重要作用[3]。
线粒体动力学的研究可以追溯到1968年Thomas和Wilkie[4]关于酵母菌的研究。随着细胞亚显微结构观测技术的发展,关于线粒体动力学的研究取得了长足的进步[5-6]。近年来,关于线粒体动力学和心血管系统关系的研究也取得了很大的进展[7]。心肌细胞因其高耗能性而具有高密度的线粒体分布,同时线粒体ATP的合成也随着心肌耗能水平变化而发生适应性改变[8]。以线粒体融合-分裂为代表的线粒体动力学改变在心肌细胞的能量代谢过程中起着关键的作用[9]。
1 线粒体动力学及其分子基础
线粒体对不断变化的生理、病理环境会做出迅速而准确的反应,可以相互融合成长链结构、环状结构或者网络结构,同时也可以分裂成更小的杆状结构[10]。随着细胞亚显微结构研究技术的发展,在几乎所有真核生物细胞内均发现线粒体始终处于一个融合-分裂的动态平衡过程中。哺乳动物细胞中的线粒体动力学改变由一组高度进化保守的线粒体融合蛋白及线粒体分裂蛋白所调控。其中,线粒体融合蛋白包括线粒体融合蛋白1(mitofusins1,Mfn1)、Mfn2、视神经萎缩症蛋白1(optic atrophy 1,OPA1),线粒体分裂蛋白包括动力相关蛋白1(dynamin-related protein 1,Drp1)、线粒体分裂蛋白1(mitochondrial fission protein 1,hFis1)、线粒体分裂因子(mitochondrial fission factor,MFF)、线粒体动力学蛋白(mitochondrial dynamics proteins of 49 and 51 kDa,MiD49/51)等。线粒体在细胞内的移动和重分布同时也依靠MMK复合体(miro/milton/kinesin complex)及微
1.1 线粒体融合 哺乳动物细胞内线粒体融合是在各自线粒体内外膜共同协调下完成的,该过程由线粒体融合蛋白及OPA1主导[2]。其中Mfn1和Mfn2共同促进了线粒体外膜的融合,同时OPA1在线粒体内膜的融合过程中起到了重要作用(图1A)。
1.1.1 线粒体融合蛋白 Hales和Fuller[12]关于果蝇的研究中首次发现线粒体融合相关基因。在随后的研究中发现,该基因编码了一种具有三磷酸酶(guanosine triphosphatase,GTPase)活性的跨膜蛋白,该蛋白在哺乳动物中被命名为Mfn1和Mfn2[13]。虽然Mfn1、Mfn2在几乎所有组织中均有表达,但其在不同组织中的表达水平不同,其中心肌组织中表达含量明显高于其他组织。而在心肌组织中,两者的表达含量也有所区别,Mfn2的含量要明显高于Mfn1[14]。
Mfn1及Mfn2是位于线粒体外膜具有GTPase活性的跨膜蛋白,其N-末端面向细胞质,包含有GTPase结构域,C-末端跨膜区两侧各有1个疏水集团,为七肽重复序列(heptad repeat region,HR)1/2(图2)。在线粒体外膜融合过程中,2个相邻线粒体外膜上的Mfn1(Mfn2)相互连接,进而引起线粒体外膜融合[14-15]。同时,Ishihara等[16]研究发现,Mfn1比Mfn2具有更高的GTPase活性,因此其在外膜融合的过程中具有更高的活性(图1A)。
1.1.2 OPA1 OPA1最早是Jones和Fangman[17]在关于酵母菌的研究中发现。在随后的研究中发现,OPA1在全身各处均有表达,其中在视网膜、脑、睾丸、肝脏、胰腺、心肌及骨骼肌中的表达水平明显高于其他组织[18]。OPA1是位于线粒体内膜具有GTPase活性的跨膜蛋白,其N-末端跨膜区具有线粒体膜插入序列(mitochondrial import sequence,MIS)、疏水集团(HR)、GTPase结构域,C-末端具有GTPase效应结构域(GTPase effector domain,GED)(图2)。Cipolat等[19]研究发现,OPA1在线粒体内膜融合过程中需要Mfn1的参与。在线粒体融合过程中,OPA1保证了线粒体内膜结构的稳定性,避免线粒体自噬的发生(图1A)[20]。
1.2 线粒体分裂 关于线粒体分裂过程的研究目前尚不够明确,已报道的研究表明线粒体分裂具体可以被分为线粒体膜收缩、细胞质内Drp1富集到线粒体、线粒体外膜形成分裂复合体等过程[2](图1B),其中Drp1、hFis1、MFF等均起到了重要作用。
1.2.1 Drp1 Drp1由Yoon等[21]首次报道,并在哺乳动物、果蝇、酵母菌等中均有广泛表达。Drp1由GTPase结构域、中央结构域、GED构成[21](图2)。在高等真核生物细胞中,大多数Drp1广泛分散在整个细胞质中,只有少部分被发现组装于线粒体上[22]。在激活情况下,Drp1在GTPase的促进下,聚集在线粒体断裂点。在此过程中,GED起到调节及定位于线粒体外膜的作用[23]。研究认为,Drp1聚集于线粒体后,在三磷酸鸟苷驱动下组装成螺旋结构,这种自组装结构能够驱使线粒体膜收缩及三磷酸鸟苷水解,进而引起Drp1螺旋内部的构象变化,完成膜的分裂[24]。由于Drp1不具有跨膜结构域,因此其结合到线粒体外膜需要有对应受体,但其对应受体是否为hFis1尚不明确[25]。研究指出,MFF可能作为哺乳动物Drp1受体在线粒体分裂过程中起到重要作用[26],同时Palmer等[27]认为MiD49/51也具有相似的作用。
1.2.2 hFis1 hFis1由James等[28]首次进行报道。hFis1是由152个氨基酸构成的小分子蛋白质,hFis1通过C-末端跨膜结构域(transmembrane domain,TMD)锚定于线粒体外膜上[29],其N-末端暴露于细胞质[30],形成一种超螺旋的三角形四肽折叠结构域(图2)。hFis1在细胞内的高表达会导致线粒体片段化,进而引起Drp1介导的细胞色素C释放和细胞凋亡[31]。与此相反,抑制hFis1表达可以防止细胞凋亡的发生[31]。而hFis1在线粒体因衰老导致的线粒体自噬过程中亦扮演着重要角色[32]。有研究指出,关于hFis1在Drp1介导的线粒体分裂中的作用尚不明确,在hFis1敲除模型中,Drp1介导的线粒体分裂依然可以发生[21,31,33]。而Suzuki等[34]发现,在hFis1高表达情况下,线粒体片段化及Drp1介导的线粒体分裂均未发生。以上观点表明,hFis1在线粒体分裂过程中扮演着重要的角色,但并不是线粒体分裂发生的唯一途径,同时还存在着其他途径能导致线粒体分裂的发生。
1.2.3 MFF MFF由Gandre-Babbe和van der Bliek[26]在对果蝇的研究中首次发现,其在心脏、肾脏、肝脏、脑、胃和肌肉中的表达含量明显高于其他组织。
MFF以C-末端TMD锚定于线粒体外膜,同时包含2个短的N-末端重复结构,这种结构可能作为Drp1的结合位点而起作用(图2)[26]。Otera等[35]研究指出,MFF具有将Drp1聚集到线粒体外膜,进而发生线粒体分裂的功能,同时该行为并不受到hFis1的影响或调节。
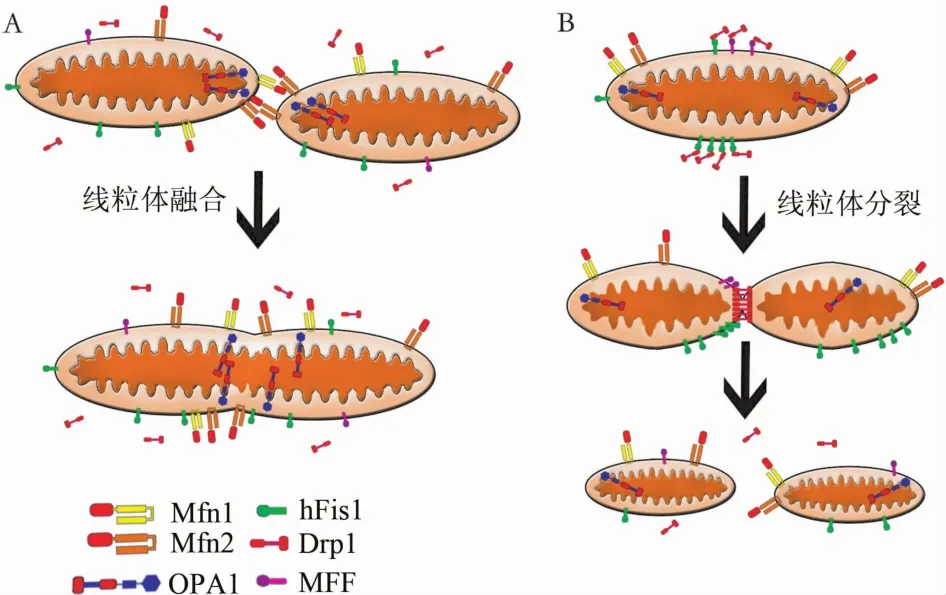
图1 线粒体融合及分裂

图2 正常生理状态下线粒体及线粒体动力学相关蛋白
2 线粒体动力学与心血管系统
近年来,随着在大鼠心肌细胞系H9c2、小鼠心肌细胞系HL-1、血管平滑肌细胞等心血管细胞系中关于线粒体动力学研究的开展,线粒体动力学在心血管系统中的重要作用逐渐受到公众的认识。2.1 线粒体动力学与成人心肌 在成人心肌中,线粒体仅为1~2μm长,并且分成肌纤维间线粒体、肌膜下线粒体及核周线粒体3种[36]。肌纤维间线粒体沿着肌原纤维整齐排列,为肌原纤维收缩及钙信号传导提供ATP;肌膜下线粒体位于肌膜下,主要与离子通道及信号传导相关;核周线粒体位于细胞核周围,为核转录提供支持。
早在1972年,成人心肌中的线粒体融合及分裂的现象便被报道[37]。同时,巨大线粒体现象在扩张性心肌病等心脏系统疾病中多次被观测到[38-39]。而在正常的成人心肌中亦可以观测到形态细长的线粒体,这种线粒体可能是由线粒体融合而成的,但其具体机制目前尚不明确[40]。
2.2 线粒体动力学改变与心肌细胞凋亡 线粒体动力学在心肌细胞凋亡过程中扮演着至关重要的角色[41]。其中,关于Mfn2的研究表明,其与心肌细胞具有密切关系,但在不同报道中,其在心肌细胞凋亡过程中扮演的角色出现较大出入。如Jahani-Asl等[42]研究指出,Mfn2具有防止细胞凋亡的保护功能。同时,在非心肌细胞的研究中发现,Mfn2具有介导细胞凋亡的作用[43]。研究表明,在血管平滑肌细胞中,Mfn2具有抗细胞增殖、促进细胞凋亡的作用,而使Mfn2沉默能够阻止细胞凋亡的发生[26]。综上所述,Mfn2在不同条件下扮演着不同的角色,其在心肌细胞凋亡过程中起到的作用尚需进一步探讨。
2.3 线粒体动力学改变与心肌细胞缺血再灌注损伤 心肌缺血时,心肌中线粒体处于缺氧、钠和钙超载、酸中毒等条件下。当再灌注发生时,内环境突然改变、线粒体膜电位变化、钙离子的运输等均导致了线粒体通透性转换孔(mitochondrial permeability transition pore,mPTP)的突然开放,进而导致了ATP耗竭和心肌细胞死亡的发生[44]。通过药理学干预[45]或基因沉默技术[46]干预mPTP开放可以明显减轻缺血再灌注损伤。因此,防止线粒体mPTP开放导致的线粒体功能障碍可以有效地预防心肌的缺血再灌注损伤。线粒体动力学也成为心肌缺血再灌注损伤新的治疗方向[47]。
Brady等[48]在HL-1细胞系上的研究表明,线粒体动力学改变发生在心肌缺血再灌注损伤过程中,其中缺血2 h将导致90%的心肌细胞中线粒体产生片段化的现象,而线粒体的这种变化于再灌注5 h后仍十分明显。通过p38有丝分裂原活化蛋白激酶抑制剂的作用,可以促进片段化线粒体的恢复。这表明p38有丝分裂原活化蛋白激酶在心肌缺血再灌注损伤中可能起到重要作用,也为心肌缺血再灌注损伤的预防提供了新的思路。
Chen等[49]关于H9c2细胞系的研究显示,在缺血条件下的心肌细胞内,OPA1表达明显下降,进而导致了线粒体片段化现象的发生。同时,Ong等[40]在HL-1细胞系上的研究指出,Drp1在线粒体片段化的过程中扮演着重要的角色,并在小鼠心肌梗死模型得到了验证,但其机制尚不明确。Hom等[50]指出,钙超载可在新生及成年大鼠的心肌细胞中导致线粒体片段化,同时钙离子通过活化钙调磷酸酶促进了Drp1的去磷酸化,进而也导致了线粒体片段化的发生[51]。Wang等[52]指出,在心肌缺血再灌注损伤过程中,微小RNA-499表达含量的下降导致了钙调磷酸酶的活化,进而促进了Drp1的去磷酸化,引起了线粒体片段化的发生。同时Qin等[53]发现,微小RNA-499在心肌缺血再灌注损伤过程中发生了明显变化。以上研究表明,Drp1引起的线粒体片段化在心肌缺血再灌注损伤中不容忽视。
2.4 线粒体动力学改变与血管内皮细胞改变 在关于糖尿病的研究中发现,高血糖导致了大鼠冠状动脉及视网膜血管内皮细胞的线粒体片段化,线粒体活性氧族大量生成,异常的线粒体膜电位降低了氧的消耗,增加了细胞凋亡的倾向[54-55]。同时Makino等[56]研究表明,高血糖诱导产生的线粒体片段化和线粒体功能障碍与OPA1的糖基化修饰相关。
2.5 线粒体动力学改变与心力衰竭 Chen等[49]关于大鼠心力衰竭模型的研究中表明,OPA1在心力衰竭组的表达明显低于对照组,同样在人类扩张性心肌病及缺血性心肌病样本中也得到了验证。而OPA1减少导致的线粒体片段化与心力衰竭发生之间的相关性尚无定论。同时,关于心力衰竭患者的研究发现,Mfn2及Drp1表达发生了明显降低,这也为新型抗心力衰竭治疗提供了方向[15]。
3 线粒体动力学与心血管系统保护
线粒体动力学改变与诸多心血管系统生理病理性改变息息相关,深入探讨线粒体动力学在心血管系统中的作用机制为保护心血管系统提供了新的方向[57]。Ong等[40]研究指出,通过对HL-1心肌细胞系进行Mfn1、Mfn2转染及Drp1k38A(Drp1显性失活突变)转染,可以使心肌细胞中线粒体延长,延迟mPTP的开放,减轻心肌缺血再灌注损伤。Papanicolaou等[58]研究发现,Mfn2基因缺失的成年小鼠模型中,核周线粒体中度增大、Drp1表达降低、mPTP开放延迟,而在急性心肌缺血再灌注损伤条件下,心肌梗死面积较对照组明显减小。线粒体分裂抑制剂-1在大鼠心肌缺血再灌注损伤模型中,通过对Drp1的调节,可以减轻心肌损伤,减小心肌梗死面积[40,59]。
综上所述,通过对线粒体动力学与心血管系统疾病的回顾,表明线粒体动力学调节将为心血管系统疾病提供新的研究方向、药物作用靶点及心肌保护方案,为公共健康事业提供新的思路和策略,具有重要的理论及现实意义。
[1]Campello S,Scorrano L.Mitochondrial shape changes:orchestrating cell pathophysiology[J].EMBO Rep,2010,11(9):678-684.
[2]Liesa M,Palacín M,Zorzano A.Mitochondrial dynamics in mammalian health and disease[J].Physiol Rev,2009,89(3):799-845.
[3]Griparic L,van der Bliek AM.The many shapes of mitochondrialmembranes[J].Traffic,2001,2(4):235-244.
[4]Thomas DY,Wilkie D.Recombination of mitochondrial drug-resistance factors in Saccharomyces cerevisiae[J]. Biochem Biophys Res Commun,1968,30(4):368-372.
[5]Kimberg DV,Loeb JN.Effects of cortisone administration on rat livermitochondria.Support for the concept ofmitochondrial fusion[J].JCell Biol,1972,55(3):635-643.
[6]Mannella CA.Structure and dynamics of themitochondrial innermembrane cristae[J].Biochim Biophys Acta,2006,1763(5/6):542-548.
[7]Ong SB,Hausenloy DJ.Mitochondrialmorphology and cardiovascular disease[J].Cardiovasc Res,2010,88(1):16-29.
[8]Sauvanet C,Duvezin-Caubet S,di Rago JP,et al.Energetic requirements and bioenergeticmodulation ofmitochondrial morphology and dynamics[J].Semin Cell Dev Biol,2010,21(6):558-565.
[9]Chen L,Knowlton AA.Mitochondrial dynamics in heart failure[J].Congest Heart Fail,2011,17(6):257-261.
[10]Chen H,Chomyn A,Chan DC.Disruption of fusion results in mitochondrial heterogeneity and dysfunction[J].JBiol Chem,2005,280(28):26185-26192.
[11]Liu X,Hajnóczky G.Ca2+-dependent regulation of mitochondrial dynamics by the Miro-Milton complex[J].Int J Biochem Cell Biol,2009,41(10):1972-1976.
[12]Hales KG,Fuller MT.Developmentally regulatedmitochondrial fusion mediated by a conserved,novel,predicted GTPase[J].Cell,1997,90(1):121-129.
[13]Santel A,Fuller MT.Control of mitochondrial morphology by a human mitofusin[J].JCell Sci,2001,114(Pt 5):867-874.
[14]Santel A,Frank S,Gaume B,et al.Mitofusin-1 protein is a generally expressed mediator of mitochondrial fusion in mammalian cells[J].JCell Sci,2003,116(Pt 13):2763-2774.
[15]Givvimani S,Pushpakumar S,Veeranki S,et al.Dysregulation of Mfn2 and Drp-1 proteins in heart failure[J].Can J Physiol Pharmacol,2014,92(7):583-591.
[16]Ishihara N,Eura Y,Mihara K.Mitofusin 1 and 2 play distinct roles in mitochondrial fusion reactions via GTPase activity[J].JCell Sci,2004,117(Pt 26):6535-6546.
[17]Jones BA,Fangman WL.Mitochondrial DNA maintenance in yeast requires a protein containing a region related to the GTP-binding domain of dynamin[J].Genes Dev,1992,6(3):380-389.
[18]Alexander C,Votruba M,Pesch UE,et al.OPA1,encoding a dynamin-related GTPase,ismutated in autosomal dominant optic atrophy linked to chromosome 3q28[J].Nat Genet,2000,26(2):211-215.
[19]Cipolat S,Martins de Brito O,Dal Zilio B,et al.OPA1 requiresmitofusin 1 to promote mitochondrial fusion[J]. Proc Natl Acad Sci USA,2004,101(45):15927-15932.
[20]Twig G,Elorza A,Molina AJ,et al.Fission and selective fusion governmitochondrial segregation and elimination by autophagy[J].EMBO J,2008,27(2):433-446.
[21]Yoon Y,Pitts KR,Dahan S,et al.A novel dynamin-like protein associates with cytoplasmic vesicles and tubules of the endoplasmic reticulum in mammalian cells[J].JCell Biol,1998,140(4):779-793.
[22]Smirnova E,Griparic L,Shurland DL,et al.Dynaminrelated protein Drp1 is required for mitochondrial division inmammalian cells[J].Mol Biol Cell,2001,12(8):2245-2256.
[23]Smirnova E,Shurland DL,Ryazantsev SN,et al.A human dynamin-related protein controls the distribution of mitochondria[J].JCell Biol,1998,143(2):351-358.
[24]Lackner LL,Nunnari JM.The molecular mechanism and cellular functions of mitochondrial division[J].Biochim Biophys Acta,2009,1792(12):1138-1144.
[25]Yoon Y,Krueger EW,Oswald BJ,et al.The mitochondrial protein hFis1 regulatesmitochondrial fission in mammalian cells through an interaction with the dynamin-like protein DLP1[J].Mol Cell Biol,2003,23(15):5409-5420.
[26]Gandre-Babbe S,van der Bliek AM.The novel tail-anchored membrane protein Mff controls mitochondrial and peroxisomal fission in mammalian cells[J].Mol Biol Cell,2008,19(6):2402-2412.
[27]Palmer CS,Osellame LD,Laine D,et al.MiD49 and MiD51,new components of the mitochondrial fission machinery[J].EMBO Rep,2011,12(6):565-573.
[28]James DI,Parone PA,Mattenberger Y,et al.hFis1,a novel component of the mammalian mitochondrial fission machinery[J].JBiol Chem,2003,278(38):36373-36379.
[29]Mozdy AD,McCaffery JM,Shaw JM.Dnm1p GTPasemediated mitochondrial fission is a multi-step process requiring the novel integralmembranecomponentFis1p[J]. JCell Biol,2000,151(2):367-380.
[30]SuzukiM,Neutzner A,Tjandra N,et al.Novel structure of the N terminus in yeast Fis1 correlates with a specialized function in mitochondrial fission[J].J Biol Chem,2005,280(22):21444-21452.
[31]Lee YJ,Jeong SY,Karbowski M,et al.Roles of the mammalian mitochondrial fission and fusion mediators Fis1,Drp1,and Opa1 in apoptosis[J].Mol Biol Cell,2004,15(11):5001-5011.
[32]Yoon YS,Yoon DS,Lim IK,et al.Formation of elongated giantmitochondria in DFO-induced cellular senescence:involvement of enhanced fusion process through modulation of Fis1[J].JCell Physiol,2006,209(2):468-480.
[33]Wasiak S,Zunino R,McBride HM.Bax/Bak promote sumoylation of DRP1 and its stable association with mitochondria during apoptotic cell death[J].JCell Biol,2007,177(3):439-450.
[34]Suzuki M,Jeong SY,Karbowski M,et al.The solution structure of human mitochondria fission protein Fis1 reveals a novel TPR-like helix bundle[J].JMol Biol,2003,334(3):445-458.
[35]Otera H,Wang C,Cleland MM,et al.M ff is an essential factor for mitochondrial recruitment of Drp1 during mitochondrial fission in mammalian cells[J].J Cell Biol,2010,191(6):1141-1158.
[36]Hoppel CL,Tandler B,Fujioka H,et al.Dynamic organization ofmitochondria in human heart and in myocardial disease[J].Int JBiochem Cell Biol,2009,41(10):1949-1956.
[37]Tandler B,Hoppel CL.Possible division of cardiac mitochondria[J].Anat Rec,1972,173(3):309-323.
[38]Kraus B,Cain H.Giantmitochondria in the humanmyocardium--morphogenesis and fate[J].Virchows Arch B Cell Pathol Incl Mol Pathol,1980,33(1):77-89.
[39]Tandler B,Dunlap M,Hoppel CL,etal.Giantmitochondria in a cardiomyopathic heart[J].Ultrastruct Pathol,2002,26(3):177-183.
[40]Ong SB,Subrayan S,Lim SY,et al.Inhibiting mitochondrial fission protects the heart against ischemia/reperfusion injury[J].Circulation,2010,121(18):2012-2022.
[41]Gillies LA,Kuwana T.Apoptosis regulation at the mitochondrial outermembrane[J].JCell Biochem,2014,115(4):632-640.
[42]Jahani-Asl A,Cheung EC,Neuspiel M,et al.Mitofusin 2 protects cerebellar granule neurons against injury-induced cell death[J].JBiol Chem,2007,282(33):23788-23798.
[43]Huang P,Yu T,Yoon Y.Mitochondrial clustering induced by overexpression of themitochondrial fusion protein Mfn2 causesmitochondrial dysfunction and cell death[J].Eur J Cell Biol,2007,86(6):289-302.
[44]Halestrap AP.Mitochondria and reperfusion injury of the heart--a holey death but not beyond salvation[J].JBioenerg Biomembr,2009,41(2):113-121.
[45]Hausenloy DJ,Duchen MR,Yellon DM.Inhibiting mitochondrial permeability transition pore opening at reperfusion protects against ischaemia-reperfusion injury[J].Cardiovasc Res,2003,60(3):617-625.
[46]Lim SY,Davidson SM,Hausenloy DJ,et al.Preconditioning and postconditioning:the essential role of the mitochondrial permeability transition pore[J].Cardiovasc Res,2007,75(3):530-535.
[47]Calo L,Dong Y,Kumar R,et al.Mitochondrial dynamics:an emerging paradigm in ischemia-reperfusion injury[J]. Curr Pharm Des,2013,19(39):6848-6857.
[48]Brady NR,Hamacher-Brady A,Gottlieb RA.Proapoptotic BCL-2 family members and mitochondrial dysfunction during ischemia/reperfusion injury,a study employing cardiac HL-1 cells and GFP biosensors[J].Biochim Biophys Acta,2006,1757(5/6):667-678.
[49]Chen L,Gong Q,Stice JP,et al.Mitochondrial OPA1,apoptosis,and heart failure[J].Cardiovasc Res,2009,84(1):91-99.
[50]Hom J,Yu T,Yoon Y,et al.Regulation of mitochondrial fission by intracellular Ca2+in rat ventricular myocytes[J].Biochim Biophys Acta,2010,1797(6/7):913-921.
[51]CereghettiGM,Stangherlin A,Martins de Brito O,et al. Dephosphorylation by calcineurin regulates translocation of Drp1 tomitochondria[J].Proc Natl Acad Sci USA,2008,105(41):15803-15808.
[52]Wang JX,Jiao JQ,LiQ,etal.miR-499 regulatesmitochondrial dynamics by targeting calcineurin and dynamin-related protein-1[J].NatMed,2011,17(1):71-78.
[53]Qin H,Chen GX,Liang MY,et al.The altered expression profile of microRNAs in cardiopulmonary bypass canine models and the effects ofmir-499 on myocardial ischemic reperfusion injury[J].JTransl Med,2013,11(1):154.
[54]Yu T,Robotham JL,Yoon Y.Increased production of reactive oxygen species in hyperglycemic conditions requires dynamic change of mitochondrial morphology[J].Proc Natl Acad Sci USA,2006,103(8):2653-2658.
[55]Trudeau K,Molina AJ,Guo W,et al.High glucose disrupts mitochondrial morphology in retinal endothelial cells:implications for diabetic retinopathy[J].Am J Pathol,2010,177(1):447-455.
[56]Makino A,Suarez J,Gawlowski T,etal.Regulation ofmitochondrialmorphology and function by O-GlcNAcylation in neonatal cardiac myocytes[J].Am JPhysiol Regul Integr Comp Physiol,2011,300(6):R1296-R1302.
[57]LimongelliG,Masarone D,D′Alessandro R,et al.Mitochondrial diseases and the heart:an overview ofmolecular basis,diagnosis,treatment and clinical course[J].Future Cardiol,2012,8(1):71-88.
[58]Papanicolaou KN,Khairallah RJ,Ngoh GA,et al.Mitofusin-2 maintains mitochondrial structure and contributes to stress-induced permeability transition in cardiacmyocytes[J].Mol Cell Biol,2011,31(6):1309-1328.
[59]Sharp WW,Fang YH,Han M,et al.Dynamin-related protein 1(Drp1)-mediated diastolic dysfunction inmyocardial ischemia-reperfusion injury:therapeutic benefits of Drp1 inhibition to reduce mitochondrial fission[J].FASEB J,2014,28(1):316-326.
The recent developments of mitochondrial dynamics in cardiovascular diseases
YANG Guangxin,WU Zhongkai
(The Second Department of Cardiac Surgery,the First Affiliated Hospital of Sun Yat-sen University,Guangzhou Guangdong 510080,China)
Mitochondria are dynamic organelles capable of changing their shape by undergoing either fission or fusion.In recent years,the research ofmachinery formitochondrial dynamics has made a great progress.However,the functional role ofmitochondrial dynamics in the cardiovascular diseases remains unclear.This article summarized the developments of mitochondrial dynamics in cardiovascular diseases.
Mitochondrial;Dynamics;Cardiovascular diseases;Developments
·综 述·
R54;R329.2+4
A
2095-3097(2014)04-0202-06
10.3969/j.issn.2095-3097.2014.04.003
510080广东广州,中山大学附属第一医院心外二科(杨广鑫,吴钟凯)
吴钟凯,E-mail:wuzhongkai@hotmail.com管的共同作用[11]。
2014-05-03 本文编辑:徐海琴)

