化学抑制剂Woodward′s Reagent K对来源于Erwinia rhapontici NX-5蔗糖异构酶的抑制动力学
王彦媛,李 莎,姚 忠,徐 虹
(南京工业大学食品与轻工学院,南京211800)
化学抑制剂Woodward′s Reagent K对来源于Erwinia rhapontici NX-5蔗糖异构酶的抑制动力学
王彦媛,李 莎,姚 忠,徐 虹
(南京工业大学食品与轻工学院,南京211800)
从重组大肠杆菌E.coliBL21 (pET22b-palⅠ)中纯化得到来源于ErwiniarhaponticiNX-5的蔗糖异构酶(sucrose isomerase,SIase,EC 5.4.99.11),以纯酶为对象考察其酶活力抑制动力学。结果表明:SIase纯比酶活1 512.77 U/mg,动力学常数Km=260 mmol/L,Vmax=39.41 μmol/(L·s)。以化学抑制剂Woodward′s Reagent K (WRK)对重组蔗糖异构酶进行抑制反应,反应体系中随着WRK浓度的升高,SIase与底物蔗糖的亲和力常数Km增大,最大反应速度Vmax在一定范围内保持稳定。通过对SIase的抑制动力学分析可得到,WRK对SIase的抑制类型为可逆的竞争性抑制,这可能与WRK与蔗糖的结构类似,与可竞争性的结合SIase的活性中心有关。
蔗糖异构酶;抑制动力学;化学抑制剂Woodward′s Reagent K
蔗糖异构酶(sucrose isomerase,SIase,EC 5.4.99.11)是催化蔗糖异构化,生成异麦芽酮糖(6-O-α-D-吡喃葡糖基-D-果糖,isomaltulose)和海藻酮糖(1-O-α-D-吡喃葡糖基-D-果糖,trehalulose)的关键酶(图1)。作为蔗糖的同分异构体,异麦芽酮糖和海藻酮糖除具有与蔗糖类似的物理性质和口感外,还有低热量、不致龋齿、不吸湿、耐酸解的特点,被美国 FDA 确定为普遍公认安全食品(GRAS),是很好的蔗糖替代品[1-4]。
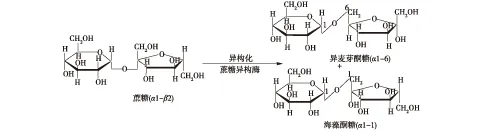
图1 蔗糖异构酶生物催化蔗糖反应式Fig.1 Transformation from sucrose to isomaltulose by sucrose isomerase
SIase催化蔗糖异构化的产物组成比例随着产酶微生物来源和催化条件的不同而存在差异,这与SIase的催化机制息息相关。2007 年 Ravaud等[5]获得了来源于红色精朊杆菌的SIase晶体结构 (PDB:3GBD),并初步解析了SIase水解和异构化蔗糖的两步催化机制,提出SIase的活性中心是由D214、E268和D342组成。目前,国内外对SIase的研究主要涉及酶学性质、基因的克隆表达[6-8],对SIase的抑制动力学研究未见报道。SIase在酶法合成系列功能性甜味剂方面具有良好的产业化应用前景,因而对其催化机制及其特性的研究具有重要意义。
化学抑制剂Woodward′s Reagent K(N-ethyl-5-phenylisoxazolium-3′-sulfonate,WRK )是一种可以与羧基结合的化学修饰剂,可作为酶的化学抑制剂,与活性位点的Glu或Asp结合生成复合物,而发挥对酶的抑制作用[9-11],此外WRK与SIase最适底物蔗糖具有相似的主体结构 (图2),可作为一种结构类似物酶抑制剂。
本文通过考察WRK对来源于ErwiniarhaponticiNX-5的SIase的抑制动力学,旨在为研究SIase的构效关系提供实验依据,并为酶催化特异性机制的认识和酶分子改造奠定基础。
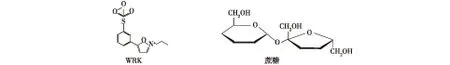
图2 WRK和蔗糖的结构Fig.2 Structure of WRK and sucrose
1 材料与方法
1.1 材料与仪器
蔗糖异构酶(SIase)由笔者所在实验室构建的重组菌株E.coliBL21(pET22b-palⅠ) 发酵产生,并经纯化得到;Woodward′s Reagent K(N-ethyl-5-phenylisoxazolium-3′-sulfonate,WRK),Fluka公司。
Spectrumlab752S型紫外可见分光光度计(上海棱光有限公司),Universal 320R型台式离心机(Hettich Zentrifugen),PowerPac Basic电泳仪(Bio-Rad公司),JY92-II型超声细胞粉碎机 (宁波新芝生物技术研究所),Agilent 1200高效液相色谱系统(Agilent公司),KF-5 L型发酵罐 (高百特发酵机(上海)有限公司),HVE-50型全自动灭菌锅(日本HIRAYAMA公司),PHSJ-4A型精密pH计(上海雷磁仪器厂)。
1.2 实验方法
1.2.1 菌体培养及SIase纯酶的获得
重组菌构建[12]、培养基及培养条件参照文献[13]。
蔗糖异构酶的纯化方法参照文献[12],其纯度经由质量分数12%的SDS-PAGE电泳检测[14]。
1.2.2 蛋白浓度的测定
参照Bradford法[15],以牛血清蛋白为标准蛋白绘制标准曲线。
1.2.3 酶活测定
酶活定义:在30 ℃、pH 6.0的最适反应条件下,每分钟催化生成1 μmol 异麦芽酮糖所需的酶量定义为一个酶活力单位(U)。
酶催化反应体系与转化方法:20 μL SIase纯酶液用pH 6.0的磷酸缓冲液(PBS)稀释至100 μL,加入50 g/L的底物蔗糖溶液400 μL,在30 ℃、pH 6.0条件下反应15 min,转化反应结束后,将转化液于沸水浴中灭活5 min[16]。
异麦芽酮糖含量的测定方法:采用高效液相色谱法(安捷伦1200型液相色谱系统),色谱条件为色谱分离柱 Rezex RCM-monosaccharide Ca2+column (Phenomenex,USA)、流动相为纯水、流速为0.5 mL/min、检测器为示差折光检测器(Shodex R101)、进样量为20 μL、柱温为80 ℃。
以异麦芽酮糖的标准样品作色谱分析的标准曲线。
1.2.4 SIase催化蔗糖异构化的反应动力学
以不同浓度蔗糖溶液 (292、585、877、1 169、1 462和1 754 mmol/L)为底物进行酶催化反应,反应体系及转化条件同1.2.3。测定反应结束时异麦芽酮糖的生成量,计算SIase纯酶液催化蔗糖异构化生成异麦芽酮糖的反应速率Vs(Vs=c(异麦芽酮糖)/t),此催化反应符合单底物的Michaelis-Menten方程。根据双倒数作图法,以1/Vs对1/c(蔗糖) 作图,可求得SIase的米氏常数(Km)和最大反应速率(Vmax)。
1.2.5 不同WRK浓度下SIase的酶活随处理时间的变化
20 μL SIase纯酶液反应体系中加入终浓度分别为2、4和8 mmol/L的WRK,终体积100 μL,处理温度30 ℃,处理时间分别为5、10、15、20、25、30和40 min,经处理后的酶液以146 mmol/L的蔗糖溶液为底物,反应体系及转化条件同1.2.3,测定此时异麦芽酮糖的生成量,以无抑制剂存在的条件下测得的酶活为100%,计算相对酶活力。
1.2.6 WRK对SIase的抑制效应分析
测定不同SIase酶量经不同浓度WRK处理后的催化反应速率,处理体系中WRK的终浓度分别为2、4和8 mmol/L,酶浓度依次为3.077、3.846、4.615、6.154和7.692 μmol/L,按照总体积100 μL计算酶液及抑制剂的加入量,30 ℃温育10 min,以146 mmol/L蔗糖溶液为底物,反应体系及转化条件同1.2.3,测定反应结束时异麦芽酮糖的生成量,计算抑制剂存在条件下的反应速率Vs,以反应速率Vs对酶浓度c(酶)作图。
1.2.7 WRK对SIase的抑制类型和抑制常数分析
将20 μL纯化过的SIase纯酶液在不同WRK浓度(2、4和8 mmol/L)的体系中温育10 min(总体积100 μL),处理后的酶液用于其抑制动力学的测定,SIase经抑制剂处理后降低了酶的活性,降低反应体系中底物浓度(分别为73、146、219、292和365 mmol/L)以便于实验结果的测定,反应体系及转化条件同1.2.3,测定反应结束时异麦芽酮糖的含量,计算SIase催化蔗糖异构化反应速率Vs,根据双倒数作图法,以1/Vs对1/c(蔗糖) 作图,可求得不同浓度WRK对SIase抑制后的的米氏常数(Km)和最大反应速率(Vmax),并计算不同浓度WRK对SIase的抑制常数(KI)。
2 结果与讨论
2.1 蔗糖异构酶SIase的纯化
重组E.coliBL21(pET22b-palⅠ) 菌株在最适条件下发酵所得菌体经洗涤、超声破碎、离心后取上清液即为粗酶液,过Ni-NTA柱纯化,洗脱液经超滤除盐浓缩后,用质量分数12%的SDS-PAGE电泳检测其纯度,结果见图3。由图3可知,SIase已纯化至电泳纯,其蛋白相对分子质量在6.5×104左右,所得SIase酶液的蛋白质量浓度为1.3 mg/mL,比酶活为1 512.77 U/mg。
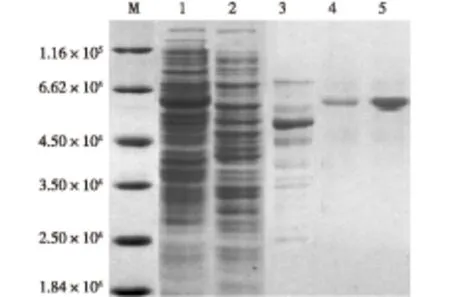
M为标准蛋白;1—粗酶液;2—穿透液;3—洗杂液;4—Ni-NTA活性洗脱液;5—浓缩后酶液图3 纯化后SIase的SDS-PAGE电泳Fig.3 SDS-PAGE analysis of protein purification
2.2 SIase催化蔗糖异构化的反应动力学
分别配置不同浓度的蔗糖(292~1 754 mmol/L)溶液,考察SIase催化不同浓度蔗糖生成异麦芽酮糖的情况,计算蔗糖异构化反应速率Vs,以1/Vs对1/cs作图,如图4。计算可得Km和Vmax值分别为260 mmol/L和39.41 μmol/(L·s)。与之前报道的其他来源的SIase相比,E.rhaponticiNX-5来源的SIase与蔗糖的结合能力优于E.rhaponticiNCPPB 1578来源的SIase (Km=280 mmol/L)[17],但明显低于K.sp.LX-3[18]和P.Rubrum[19]来源的SIase,其Km值分别为54.6和32 mmol/L。
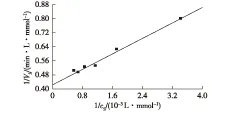
图4 SIase催化蔗糖异构化反应动力学Fig.4 Kinetics of sucrose isomerization catalyzed by SIase
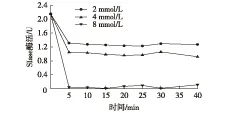
图5 WRK处理对SIase酶活力的影响Fig.5 Effects of WRK concentration on inhibition of SIase activities
2.3 不同WRK浓度下SIase的酶活随处理时间的变化
测定不同WRK浓度,不同处理时间时SIase的酶活力,以SIase的酶活力对时间作图,0 min为未经抑制剂处理的SIase所具有的酶活,结果见图5。由图5可知:在所选浓度范围内,WRK对SIase的催化活力有显著的抑制作用。在相同处理时间下,随WRK浓度升高,SIase的活力逐渐下降,对酶活力的抑制作用增强;当WRK浓度为8 mmol/L,处理时间为10 min时,SIase几乎丧失活力,WRK的抑制作用达到最高。不同浓度的WRK对SIase酶活力的抑制作用在处理10 min后基本稳定。因此,在以后的抑制动力学测定实验中,抑制剂对SIase的处理时间均为10 min。
2.4 WRK对SIase的抑制效应分析
不同WRK终浓度下对不同酶液量的体系进行预处理后,测定反应速率Vs,以反应速率Vs对酶浓度c(酶)作图,结果见图6。由图6可知:加入不同浓度WRK后,SIase酶的活力均随酶液量的增加而增大,且酶活力与酶液量呈明显的线性关系。随着WRK浓度的提高,直线的斜率逐渐降低,表明WRK对SIase的抑制作用是可逆的[20]。此抑制作用下导致酶活力下降的原因是抑制剂浓度的增加,而不是减少有效酶量。
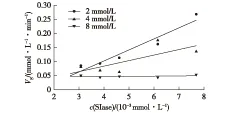
图6 WRK浓度对蔗糖转化速率与酶液量的影响Fig.6 Effects of WRK concentration on velocity of sucrose isomerization Vs and c(SIase)
2.5 WRK对SIase的抑制类型和抑制常数分析
经不同浓度的WRK处理后的SIase酶液,测定在不同底物浓度下SIase催化生成异麦芽酮糖的量,计算蔗糖异构化的反应速率Vs,以1/Vs对1/cs作图,结果见图7。由图7可知:不同抑制剂浓度的3条直线相交于Y轴,表明在SIase反应过程中WRK仅影响该酶促反应的米氏常数,Vmax在一定范围内保持不变;而米氏常数随抑制剂浓度增大而增大。由此可以推断WRK是 SIase的一种竞争性抑制剂[21-22]。
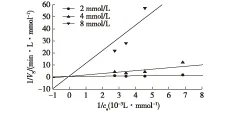
图7 WRK对SIase的竞争性抑制动力学Fig.7 Kinetics of SIase competitively inhibited by WRK
当竞争性抑制剂存在时,酶催化反应速率与底物浓度的关系满足式(1)。
(1)
式中,cI、cs分别为抑制剂和底物浓度。
表1为不同浓度WRK对SIase处理后,求得的米氏常数Km和最大反应速率Vmax以及由式(1)求得的不同WRK浓度下的抑制常数KI值。加入竞争性抑制剂后,Km与Vmax均发生了变化,且Km随抑制剂浓度的增加而增大,而Vmax在一定范围内维持稳定。KI值随WRK浓度升高而减小,符合竞争性抑制的特点。推测是由于WRK具有与蔗糖相似的结构,当其与蔗糖同时存在时,WRK具有相对于蔗糖较小的相对分子质量(253.27),易于进入酶的催化中心区域,可竞争性的占据底物结合部位,因此降低了SIase与底物蔗糖结合的能力,但当底物浓度足够大时能与酶活性位点重新结合发生催化反应。
3 结论与展望
1)重组蔗糖异构酶经过一步Ni-NTA柱纯化,可得到电泳纯的SIase,其质量浓度为1.3 mg/mL,比酶活为1 512.77 U/mg。
2)研究得到SIase的动力学常数Km=260 mmol/L,Vmax=39.41 μmol/(L·s),对SIase的抑制动力学开展研究,以WRK为化学抑制剂,通过其对SIase的抑制动力学研究,阐明了 WRK是SIase的竞争性抑制剂,初步分析认为这与WRK与该酶最适底物蔗糖的结构类似有关。
3)为进一步研究WRK对SIase的抑制作用,计划开展Erwiniarhapontici来源SIase的晶体结构及WRK与SIase的共结晶结构解析研究,用以深入认识SIase的催化机制,并从结构角度进一步解析WRK对SIase的作用机制。
[1] Low N H,Sporns P.Analysis and quantitation of minor di- and trisaccharides in honey using capillary gas chromatography[J].J Food Sci,1988,53(2):558-561.
[2] Maki Y,Ohta K,Takazoe I,et al.Acid production from isomaltulose,sorbitol,and xylitol in suspensions of human dental plaque[J].Caries Res,1983,17(4):335-339.
[3] Lina B A,Jonker D,Kozianowski G.Isomaltulose (palatinose):a review of biological and toxicological studies[J].Food Chem Toxicol,2002,40(10):1375-1381.
[4] 李莎,徐虹.微生物来源蔗糖异构酶的研究进展及应用[J].化工进展,2011,30(6):1326-1331.
[5] Ravaud S,Robert X,Watzlawick H,et al.Trehalulose synthase native and carbohydrate complexed structures provide insights into sucrose isomerization[J].J Biol Chem,2007,282(38):28126-28136.
[6] Macgregor E A,Janecek S,Svensson B.Relationship of sequence and structure to pecificity in the α-amylase family of enzymes[J].Biochim Biophys Acta,2001,1546:1-20.
[7] 李莎,任贲,林璐,等.大黄欧文菌中蔗糖异构酶基因的克隆表达及应用[J].南京工业大学学报:自然科学版,2011,33(1):84-89.
[8] Ren B,Li S,Xu H,et al.Purification and characterization of a highly selective sucrose isomerase fromErwiniarhaponticiNX-5[J].Bioprocess Biosyst Eng,2011,34(5):629-637.
[9] 肖彦羚,周治,姚忠,等.WRK对枯草芽孢杆菌NX-2产出的γ-谷氨酰转肽酶的不可逆抑制动力学[J].高校化学工程学报,2010,24(1):87-92.
[10] Kumar A,Rao M.A novel bifunctional peptidic aspartic protease inhibitor inhibits chitinase A fromSerratiamarcescens:kinetic analysis of inhibition and binding affinity[J].Biochim Biophys Acta,2010,1800(5):526-536.
[11] Paoli P,Fiaschi T,Paolo C,et al.Mechanism of acylphosphatase inactivation by Woodward′s Reagent K[J].Biochem J,1997,328:855-861.
[12] Li S,Cai H,Qing Y J,et al.Cloning and characterization of a sucrose isomerase fromErwiniarhaponticiNX-5 for isomaltulose hyperproduction[J].Appl Biochem Biotechnol,2011,163(1):52-63.
[13] 任贲,李莎,徐虹,等.蔗糖异构酶基因在EscherichiacoliBL21(DE3)中的表达及重组菌的细胞固定化[J].食品与发酵工业,2010,36(6):1-6.
[14] Ausubel F,Brent R,Kingston R E,et al.Short protocols in molecular biology[M].3rded.New York:John Wiley & Sons Inc.,1995.
[15] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[16] 林璐,李莎,朱宏阳,等.固定化细胞生物催化合成异麦芽酮糖[J].食品与发酵工业,2008,34(3):29-32.
[17] Cheetham P J,Imber C E,Isherwood J.The formation of isomaltulose by immobilizedErwiniarhapontici[J].Nature,1982,299:628-631.
[18] Zhang D H,Li X Z,Zhang L H.Isomaltulose synthase fromKlebsiellasp.strain LX3:gene choning and characterization and engineering of thermostability[J].Appl Environ Microbiol,2002,68:2676-2682.
[19] Hyeon C L,Jin H K,Sang Y K.Isomaltose production by modification of the fructose-binding site on the basis of the predicted structure of sucrose isomerase from "Protaminobacterrubrum"[J].Appl Environ Microbiol,2009,74:5183-5194.
[20] 刘伟,薛超彬,张静静,等.单宁酸对甜菜夜蛾幼虫生长发育及酚氧化酶活性的抑制作用[J].植物资源与环境学报,2010,19(1):32-37.
[21] 郑挺,黄时绵,周博,等.多羟基苯甲醛席夫碱的合成及其α-葡萄糖苷酶抑制活性[J].中国药物化学杂志,2011,21(5):370-375.
[22] Zhou R,Cheng L.Competitive inhibition of phosphoglucose isomerase ofapple leaves by sorbitol 6-phosphate[J].J Plant Physiol,2008,165(9):903-910.
(责任编辑 荀志金)
Inhibition kinetics of sucrose isomerase from Erwinia rhapontici NX-5 by Woodward′s Reagent K
WANG Yanyuan,LI Sha,YAO Zhong,XU Hong
(College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211800,China)
Sucrose isomerase (SIase,EC5.4.99.11) fromErwiniarhaponticiNX-5 was purified from the extract of recombinantE.coliBL21 (pET22b-palⅠ) culture,and the inhibition kinetics of the pure SIase was studied with chemical inhibitor Woodward′s Reagent K(WRK).Results show that SIase had the high specific activity of 1 512.77 U/mg,as well as the Michaelis-Menten constants ofKm=260 mmol/L andVmax=39.41 μmol/(L·s).Kmincreased as the concentration of inhibitor increased,butVmaxkept stable within limits.The inhibition of SIase by WRK was reversible and competitive,probably caused by the similar structure of WRK and sucrose.
sucrose isomerase;inhibition kinetics;Woodward′s Reagent K
10.3969/j.issn.1672-3678.2014.06.012
2013-03-26
国家高技术研究发展计划(863计划)(2012AA021503);国家自然科学基金(31371732);教育部博士点基金(20103221110006);江苏省普通高校研究生科研创新计划(CXZZ12_0418)
王彦媛(1987—),女,河北衡水人,硕士研究生,研究方向:生物化工;徐 虹(联系人),教授,E-mail:xuh@njtech.edu.cn
Q5
A
1672-3678(2014)06-0062-05

