注射用白蛋白结合型紫杉醇联合卡铂一线治疗老年晚期肺鳞癌39例临床观察
许菊青 樊卫飞 蒲晓麟 王琳 王峻
白蛋白结合型紫杉醇(nab-P)为一种新型的紫杉醇,与微小白蛋白相结合,并以白蛋白作为载体,去除了溶剂型紫杉醇中溶剂相关的不良反应,提高了使用紫杉醇化疗时的安全性,患者用前不需要接受预处理[1]。nab-P可以更好地到达肿瘤微环境,优先被肿瘤细胞摄入。能够在避免药物不良反应增加的基础上提高紫杉醇剂量。国外研究已表明,nab-P联合卡铂(nab-PC)在晚期肺鳞癌的治疗中具有优势,≥70岁的老年人总生存期延长[2]。本研究总结了39例老年晚期肺鳞癌患者接受nab-PC作为一线治疗的临床资料,报道如下。
1 资料与方法
1.1 临床资料收集2010年2月至2012年2月在我科诊治的39例老年晚期肺鳞癌患者,其中男36例,女3例,年龄65~83岁,平均(69.8±3.5)岁,均未手术,既往未接受过化疗。采用nab-PC一线治疗方案。1.2入选标准组织学/细胞学诊断确诊的初治肺鳞癌患者,所有患者均未接受手术及放化疗等抗肿瘤治疗;AJCC癌症分期(第7版)临床分期为ⅢB或Ⅳ期;至少有1个可测量的病灶;年龄≥65岁;预计生存时间≥3月;ECOG评分0~2分;血常规、肝肾功能正常,心电图基本正常;依从性良好并签署知情同意书。
1.3 治疗方法注射用nab-P(阿博利斯生物科技:ABEAXANE)100 mg/m2,第1、8天用药,卡铂药时曲线下面积(AUC)为5,第1天静滴,21 d为1个周期;所有患者均接受至少2个周期的治疗;上述化疗方案均在治疗中给予常规预防性止吐及必要预处理,对症支持,必要时给予重组人粒细胞集落刺激因子(rhGCSF)等治疗。
1.4 疗效及不良反应评定标准参照实体瘤疗效评定标准RECIST标准评价疗效,2个周期化疗结束后进行疗效评价,并于4周期后进行疗效确认。判断完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),有效率(RR)为(CR+PR)/可评价病例数,疾病控制率(DCR)为(CR+PR+SD)/可评价病例数。按照NCICTC3.0常见毒性分级标准评价不良反应(0~Ⅳ级)。无进展生存时间(PFS)为化疗开始至疾病进展或死亡的时间,总生存时间(OS)为化疗开始至死亡或末次随访时间。
2 结果
2.1 治疗情况39例患者中,男36例(92.3%),女3例(7.7%),吸烟28例(71.8%),不吸烟11例(28.2%),ⅢB期18例(46.2%),Ⅳ期21例(53.8%),ECOG评分1分者23例(59.0%),2分者16例(41.0%);39例患者共化疗164周期,1例仅化疗1个周期后外院就诊,其余38例均完成至少2个周期化疗,平均化疗4.3个周期。全组CR 0例,PR 17例,SD 12例,PD 9例,有效率(RR)为44.7%,疾病控制率(DCR)为76.3%;38例可评价疗效的患者均获随访,截止于2013年3月,中位PFS为5.8月,中位OS为11.4月。
2.2 不良反应39例患者均可评价不良反应,主要非血液毒性为神经不良反应、脱发、乏力;血液不良反应方面中性粒细胞减少及贫血较为常见,大多为Ⅰ~Ⅱ级不良反应,发生Ⅲ/Ⅳ级不良反应的患者比例较低,主要为中性粒细胞减少(28.2%),贫血(18.0%),乏力(15.4%),血小板减少(10.3%)。无因不良反应而停药的患者。其他不良反应均在可控制范围。
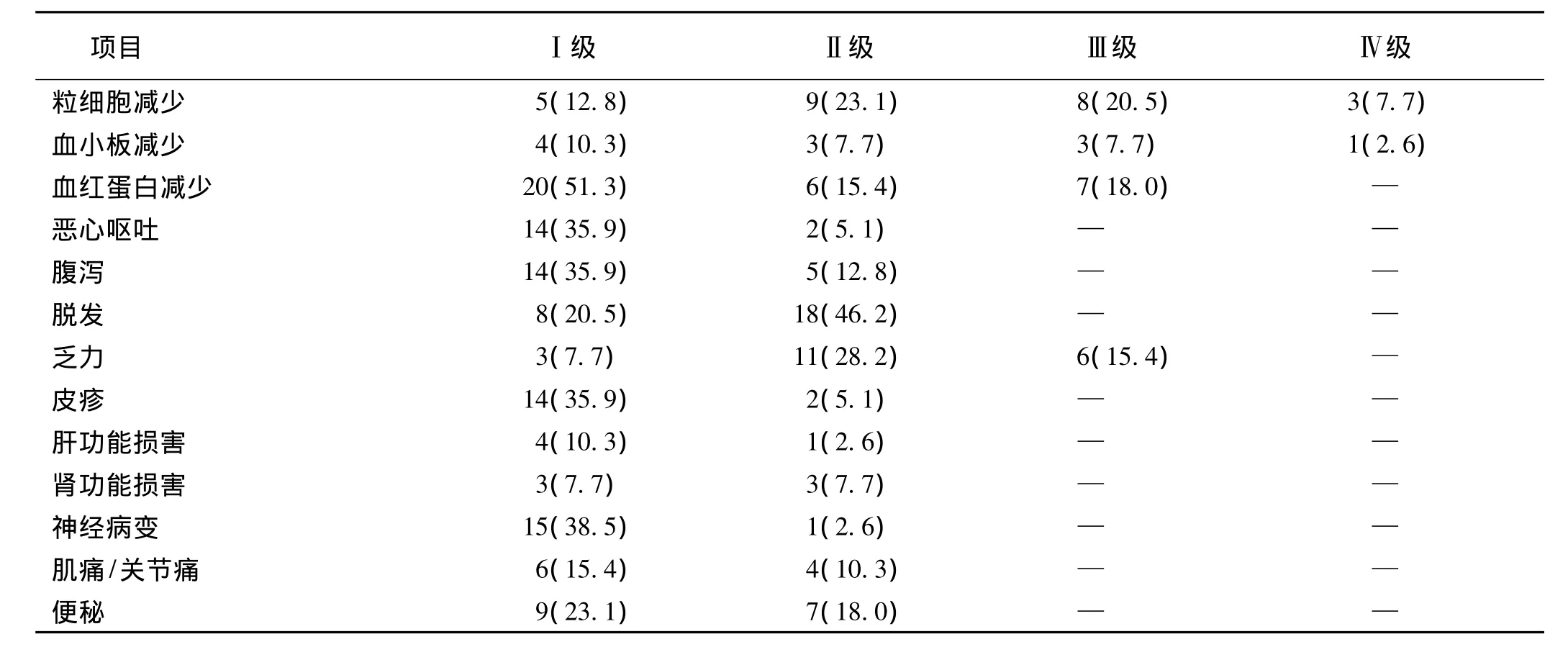
表1 39例肺鳞癌患者的不良反应分级(n,%)
3 讨论
根据2008年全球癌症统计显示,肺癌的发病率及死亡率居世界首位[3]。同样,在中国肺癌也是发病率最高的恶性肿瘤,且随着人口基数的增长及人口老龄化趋势的加快,这一数字也在进一步升高[4]。其中,非小细胞肺癌(NSCLC)占85%以上,腺癌和鳞癌是主要的病理类型[5-6]。吸烟是肺癌最主要的危险因素[4,7]。
我国肺癌患者的中位年龄是63岁(1996年)[7],随着老年人口的增加,老年肺癌的比例逐渐升高,目前超过50%的NSCLC患者诊断时年龄>65岁,约1/3的患者年龄>70岁。
自20世纪90年代以来,第3代化疗药物吉西他滨、紫杉醇、多西紫杉醇、长春瑞滨等联合铂类方案已成为晚期NSCLC的标准一线治疗方案。以上不同含铂两药方案在NSCLC中的总体疗效相似,但亚组分析表明腺癌患者疗效优于鳞癌[8]。肺鳞癌治疗方面一直没有突破性的进展,在治疗选择方面也相对局限,但近年来一些临床试验的结果逐渐引起了人们对于肺鳞癌的重视,其中一项Ⅲ期临床研究显示nab-P在肺鳞癌的治疗中取得了较好的疗效[2]。
nab-P是一种以人血白蛋白作为载体的新型紫杉醇白蛋白冻干剂,它不需要聚氧乙烯蓖麻油和无水乙醇作为助溶剂。载体白蛋白是人体自然的疏水性分子,这一生物特性,增加了紫杉醇在肿瘤细胞中的分布,从而有助于紫杉醇发挥最大功效的同时降低不良反应[9-10]。
Socinski等[2]报道的Ⅲ期随机临床研究显示,与传统紫杉醇联合卡铂(PC)一线治疗晚期NSCLC相比,nab-PC治疗的客观缓解率(ORR)更高,亚组分析显示,肺鳞癌患者,nab-PC方案的ORR较PC方案提高了67%(41%比24%,P<0.001),而对非鳞癌患者,nab-PC方案与PC方案疗效相似(ORR:26%比25%);同时研究发现年龄≥70岁的NSCLC患者中nab-PC组的OS明显高于PC组(19.9月比10.4月,P=0.009),年龄亚组OS延长的原因尚不清楚,可能与溶剂型紫杉醇每3周方案相比,老年人能更好地耐受nab-P每周方案。本研究中nab-PC方案的RR和DCR分别为44.7%和76.3%,与文献报道一致。
研究认为,nab-P在肺鳞癌患者中疗效更好,可能与其微囊蛋白-1(caveolin-1,CAV-1)异常过度表达从而导致nab-P通过gp60-CAV1通路高浓度聚集于肿瘤细胞内有关。已有数据表明肺鳞癌中CAV-1阳性率高达67.1%,而肺腺癌仅为16.7%[6,11-12]。也有研究认为肿瘤组织间隙对nab-P的摄取和蓄积通过白蛋白与富含半胱氨酸的酸性分泌蛋白(SPARC)之间的相互作用得到加强[10]。SPARC为肿瘤生长过程中分泌,其功能类似白蛋白受体,因此肿瘤组织SPARC阳性的患者nab-P疗效更好,这一结果在头颈部肿瘤、乳腺癌的临床研究中得到证实[13-14]。其在肺癌中疗效尚需进一步临床研究证实。
卡铂为第2代铂类抗癌药,其作用与顺铂相似,主要能引起靶细胞DNA的交叉联结,阻碍DNA复制及合成,从而抑制肿瘤细胞生长。在治疗NSCLC的化疗药物中,铂类占有重要地位,与顺铂相比,除血液学毒性外,卡铂的不良反应低,尤其是肾毒性及胃肠道反应小[15];老年肺癌患者多伴有慢性心肺疾病及重要脏器功能减退,存在免疫功能减低,药物代谢能力下降等特点,故应用卡铂方案更具有优势,大多数患者耐受良好。
不良反应方面,本研究方案中主要的不良反应为中性粒细胞减少和神经毒性,大多为Ⅰ~Ⅱ级不良反应,Ⅲ/Ⅳ级中性粒细胞减少占28.2%,其中1例患者出现粒细胞缺乏性发热,经经验性抗感染、rhG-CSF等对症治疗后,症状能改善,不影响下一周期治疗;神经毒性主要表现为外周肢体的感觉麻木或异常,未有严重的神经毒性发生。其他不良反应中贫血较为常见,占84.6%,可能与老年患者通常伴随多种基础疾病及重要器官功能减退有关,但没有因不良反应停药的患者。目前已有研究表明,nab-P每周方案的疗效和安全性较3周方案更好,125 mg/m2被认为是nab-P每周方案的最大耐受剂量[1];本研究以老年患者为研究人群,nab-P采用的剂量为100 mg/m2,使得总体的不良反应发生率降低,患者耐受良好,但疗效并未受到影响。
综上,nab-PC一线治疗老年晚期肺鳞癌安全有效。本项回顾性分析研究存在样本量少,未设置对照组等不足。尚未能有力证明nab-PC能够明显改善晚期肺鳞癌的生存预后。因此,还需大规模、大样本多中心前瞻性随机对照试验证实。
[1]Rizvi NA,Riely GJ,Azzoli CG,et al.Phase I/II trial of weekly intravenous 130-nm albumin-bound paclitaxel as initial chemotherapy in patients with stage IV non-small-cell lung cancer[J].J Clin Oncol,2008,26(4):639-643.
[2]Socinski MA,Bondarenko I,Karaseva NA,et al.Weekly nab-paclitaxel in combination with carboplatin versus solvent-based paclitaxel plus carboplatin as first-line therapy in patients with advanced non-small-cell lung cancer:final results of a phaseⅢtrial[J].J Clin Oncol,2012,30(17):2055-2062.
[3]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].Int J Cancer,2010,127(12):2893-2917.
[4]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[5]杨俊,黄茂.老年原发性肺癌144例临床特点分析[J].实用老年医学,2000,14(1):54.
[6]Chen HL,Fan LF,Gao J,et al.Differential expression and function of the caveolin-1 gene in non-small cell lung carci-noma[J].Oncol Rep,2011,25(2):359-366.
[7]LamWK,White NW,Chan-Yeung MM.Lung cancer epidemiology and risk factors in Asia and Afric[J].Int J Tuberc Lung Dis,2004,8(9):1045-1057.
[8]Scagliotti GV,Parikh P,von Pawel J,et al.Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advancedstage non-small-cell lung cancer[J].J Clin Oncol,2008,26(21):3543-3451.
[9]Green MR,Manikhas GM,Orlov S,et al.Abraxane,a novel Cremophor-free,albumin-bound particle form of paclitaxel for the treatment of advanced non-small-cell lung cancer[J].Ann Oncol,2006,17(8):1263-1268.
[10]Xing PY,Li JL,Wang Y,et al.Efficacy and safety of albumin-bound paclitaxel in treating recurrent advanced nonsmall-cell lung cancer[J].Chin J Cancer Res,2013,25(2):200-205.
[11]Desai N,Trieu V,Yao Z,et al.Increased antitumor activity,intratumor paclitaxel concentrations,and endothelial cell transport of cremophor-free,albumin-bound paclitaxel,ABI-007,compared with cremophor-based paclitaxel[J].Clin Cancer Res,2006,12(4):1317-1324.
[12]Pelkmans L,Burli T,Zerial M,et al.Caveolin-stabilized membrane domains as multifunctional transport and sorting devices in endocytic membrane traffic[J].Cell,2004,118(4):767-780.
[13]Desai NP,Trieu V,Hwang LY,et al.Improved effectiveness of nanoparticle albumin-bound(nab)paclitaxel versus polysorbate-based docetaxel in multiple xenografts as a function of HER2 and SPARC status[J].Anticancer Drugs,2008,19(9):899-909.
[14]Desai N,Trieu V,Damascelli B,et al.SPARC expression correlates with tumor response to albumin-bound paclitaxel in head and neck cancer patients[J].Transl Oncol,2009,2(2):59-64.
[15]de Castria TB,da Silva EM,Gois AF,et al.Cisplatin versus carboplatin in combination with third-generation drugs for advanced non-small cell lung cancer[J].Cochrane Database Syst Rev,2013,8:CD009256.
[16]韩利勋,高敬华.多西紫杉醇联合卡铂治疗晚期非小细胞肺癌56例分析[J].中国医药导报,2009,6(11):157-158.

