首次肿瘤细胞减灭术与新辅助化疗后间隔性肿瘤细胞减灭术治疗Ⅲ和Ⅳ期卵巢癌患者后其对铂类药物耐药性及生存期的影响
成 莉,李 琳,邢 辉
据世界卫生组织(WHO)估计,每年卵巢癌的发病人数约为20万,死亡人数高达12.5万[1]。卵巢癌的病死率在所有妇科肿瘤中居首位,这也表明其潜在的早期播散性,诊断时大多已为晚期[2]。首次肿瘤细胞减灭术(PDS)仍然是治疗进展期卵巢癌的标准方法。新辅助化疗后间隔性肿瘤细胞减灭术(NACT-IDS)可以作为一种辅助治疗手段,尤其对于治疗国际妇产科联盟(FIGO)分期的Ⅳ期卵巢癌[3]。近年来研究显示,Ⅲ期和Ⅳ期卵巢癌患者随机采用NACT-IDS或者化疗后行PDS治疗,其生存率相当[4]。肿瘤细胞减灭术涉及肿瘤血供及预防化疗耐药等方面,不良血供的肿瘤被切除后剩余瘤体会对化疗药物更加敏感。化疗药物能够在增殖活性强、体积小的肿瘤上发挥最大的作用[5-6]。因此在肿瘤细胞减灭术之后再进行系统化疗能够更进一步地提高化疗药物的作用。然而,采用NACT-IDS治疗方案则会增加肿瘤细胞耐药性的风险。本研究旨在回顾性比较晚期卵巢癌患者经PDS与NACT-IDS治疗后其对铂类药物耐药性及生存期的影响。
1 资料与方法
1.1 纳入和排除标准 纳入标准:(1)经过临床及术后病理检查诊断为卵巢癌的患者。(2)FIGO分期为Ⅲ期和Ⅳ期患者。(3)患者均知情并同意参与本研究。排除标准:(1)FIGO分期为Ⅰ期及Ⅱ期患者。(2)伴有严重的心肝肾等器官功能障碍者。
1.2 一般资料 选择2006年1月—2008年2月襄阳市中心医院收治的晚期卵巢癌患者116例为研究对象,年龄46~72岁,平均(57.1±7.5)岁。均已婚已育。78例患者有腹胀、腹痛症状,59例患者存在贫血、消瘦等营养不良表现,31例患者有食欲不振、恶心呕吐症状,11例患者有不规则阴道出血。术后肿瘤标本均经过病理证实。病理类型:浆液癌72例,癌肉瘤10例,子宫内膜样癌7例,黏液癌6例,透明细胞癌6例,混合癌15例。FIGO分期:Ⅲ期86例,Ⅳ期30例。按照治疗方法的不同,将两组患者分为PDS组及NACT-IDS组,每组58例,两组患者的年龄、病理类型、FIGO分期比较,差异均无统计学意义(P>0.05,见表1)。

表1 两组一般资料比较
注:FIGO=国际妇产科联盟;*为t值,余检验统计量值为χ2值
1.3 治疗方法
1.3.1 PDS 手术范围为全子宫、大网膜、双附件、盆腔淋巴结清扫、阑尾切除。再行腹主动脉旁淋巴结清扫术。经过PDS后患者腹腔内单个残留灶最大直径>1 cm的有22例,≤1 cm的有36例。3例行外阴转移灶切除术,1例行腹壁转移灶切除术。PDS组患者术后行PMF化疗方案:顺铂80 mg/m2,丝裂霉素6 mg/m2,氟尿嘧啶1 200 mg/m2。化疗时间为最少3个疗程。
1.3.2 NACT-IDS 首先进行新辅助化疗,化疗方案为TP方案:紫杉醇135 mg/m2,顺铂80 mg/m2。化疗持续96 h,化疗10 d后评估化疗效果,最少治疗3个疗程。3个疗程后进行PDS,方法同上,手术距离化疗时间间隔为1~2个月。
1.4 疗效评价 根据WHO推荐的化疗效果评价标准,完全缓解(CR):靶病灶全部消失,无新病灶出现,并且血清糖类抗原125(CA125)≤35 U/ml;部分缓解(PR):靶病灶最大直径之和减少≥30%,维持4周,血清CA125>35 U/ml或低于最初的50%以上;疾病稳定(SD):靶病灶最大直径之和缩小未达PR,或增大未达疾病进展(PD),血清CA125未见明显升高;PD:靶病灶最大直径之和至少增加20%,或出现新的病灶,血清CA125显著增加。化疗敏感性是指:首次接受以铂类药物为基础的常规化疗有效,停药半年内无复发;化疗耐药性是指:首次接受以铂类药物为基础的常规化疗有效,停药半年内出现复发。
1.5 生存分析 生存分析开始时间为开始治疗时,结束时间为患者死亡或随访结束时,随访结束时间为2013-02-20。随访方式采用电话及来院复查的形式,116例患者中,仅有1例患者因无法联系而失访。

2 结果
2.1 两组患者CA125水平及治疗情况比较 PDS组与NACT-IDS组患者CA125水平、完全切除无残留率及肠道手术率比较,差异均无统计学意义(P>0.05);PDS组患者化疗周期>6的患者较NACT-IDS组减少,腹腔化疗的患者较NACT-IDS组增多,差异均有统计学意义(P<0.05,见表2)。
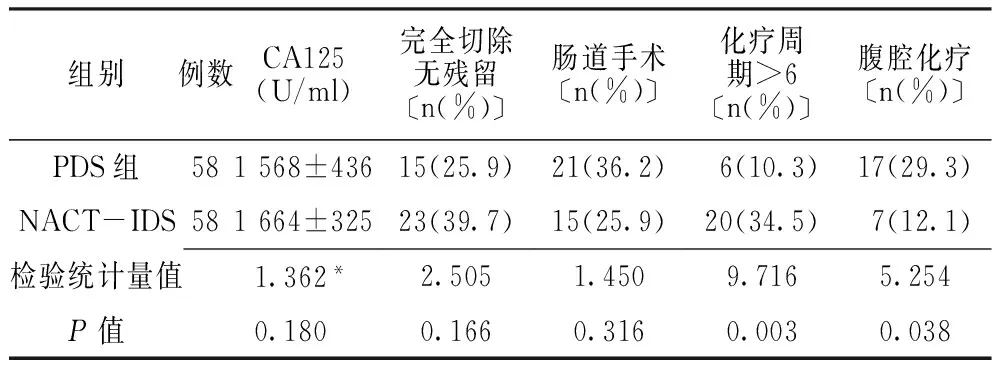
表2 两组患者CA125水平及治疗情况比较
注:CA125=糖类抗原125;*为t值,余检验统计量值为χ2值
2.2 两组患者治疗效果 3个周期化疗结束后,PDS组49例(84.5%)患者为CR,7例(12.1%)患者为PR,PDS组患者对铂类为基础的化疗反应率为96.6%;NACT-IDS组47例(81.0%)患者为CR,11例(19.0%)患者为PR,NACT-IDS组患者对铂类为基础的化疗反应率为100.0%。两组患者对铂类为基础的化疗反应率比较,差异无统计学意义(P=0.496)。
2.3 两组患者铂类耐药率比较 停止化疗6个月后,PDS组17例出现复发,对铂类的耐药率为29.3%;NACT-IDS组26例出现复发,对铂类的耐药率为44.8%。两组化疗耐药率比较,差异有统计学意义(χ2=6.421,P<0.05)。
经χ2检验,两组患者各病理特征的分布符合Hardy-Weinberg遗传平衡定律,提示研究对象具有代表性。单因素非条件Logistic回归分析结果显示,两组FIGOⅢ期、完全切除无残留、肠道手术、化疗周期>6的患者铂类耐药率比较,差异均有统计学意义(P<0.05,见表3)。
2.4 患者铂类药物耐药影响因素的多因素Logistic回归分析 以耐药性为因变量,以治疗方法、FIGO分期、年龄、化疗周期、腹腔化疗、铂类联合紫杉醇为自变量(见表4),行多因素非条件Logistic回归分析,结果显示,治疗方法、年龄、化疗周期、腹腔化疗、铂类联合紫杉醇与第一个周期对化疗有反应的患者铂类药物耐药有回归关系(P<0.05);治疗方法、FIGO分期、年龄、铂类联合紫杉醇与经过≥4周期化疗的患者铂类药物耐药有回归关系(P<0.05,见表5)。
2.5 生存分析 NACT-IDS组和PDS组中位无病生存期均为16个月,差异无统计学意义(χ2=1.243,P=0.541,见图1),而中位总生存期则NACT-IDS组显著低于PDS组,差异有统计学意义(33个月与45个月,χ2=6.153,P=0.013,见图2)。多因素Cox回归分析结果显示,治疗方法、FIGO分期、年龄、化疗周期、腹腔化疗、铂类联合紫杉醇与患者生存期有回归关系(P<0.05,见表6)。
表3 不同情况两组患者铂类耐药率比较〔n(%)〕
Table3 Comparison of platinum resistance between two groups of different stuations
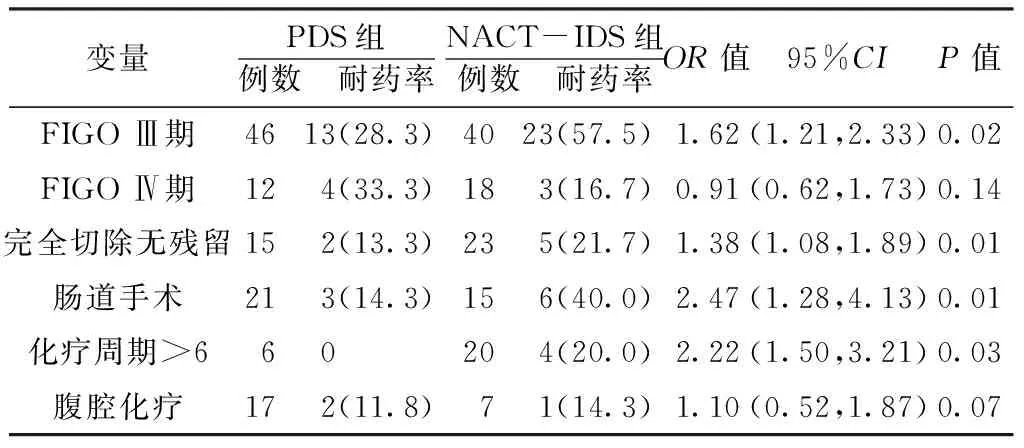
变量PDS组例数 耐药率NACT-IDS组例数 耐药率OR值95%CIP值FIGOⅢ期4613(28.3)4023(57.5)1.62(1.21,2.33)0.02FIGOⅣ期12 4(33.3) 18 3(16.7) 0.91(0.62,1.73)0.14完全切除无残留15 2(13.3) 23 5(21.7) 1.38(1.08,1.89)0.01肠道手术21 3(14.3) 15 6(40.0) 2.47(1.28,4.13)0.01化疗周期>6 6 0 20 4(20.0) 2.22(1.50,3.21)0.03腹腔化疗17 2(11.8) 7 1(14.3) 1.10(0.52,1.87)0.07

表4 患者铂类药物耐药影响因素赋值
表5 患者铂类药物耐药影响因素的多因素Logistic回归分析
Table5 Multivariate Logistic regression analysis on influencing factors for platinum drug resistance

变量第一个周期对化疗有反应的患者(n=114)OR值 95%CI P值经过≥4周期化疗的患者(n=52)OR值 95%CI P值治疗方法1.72(1.21,2.34)0.011.42(1.12,2.13)0.04FIGO分期1.28(0.72,1.77)0.221.58(1.11,2.30)0.01年龄3.22(2.43,4.47)0.002.49(1.78,3.52)0.03化疗周期2.59(1.54,4.21)0.001.81(0.87,3.62)0.32腹腔化疗0.42(0.13,0.87)0.010.52(0.32,1.20)0.11铂类联合紫杉醇0.61(0.22,0.84)0.030.50(0.11,0.74)0.01
表6 患者生存期影响因素的多因素Cox回归分析
Table6 Multivariate Cox regression analysis on influencing factors for disease-free survival

变量回归系数P值相对危险度治疗方法1.650.0044.31FIGO分期1.130.0152.41年龄0.970.0341.15化疗周期1.460.0132.64腹腔化疗0.870.0080.78铂类联合紫杉醇2.110.0220.65
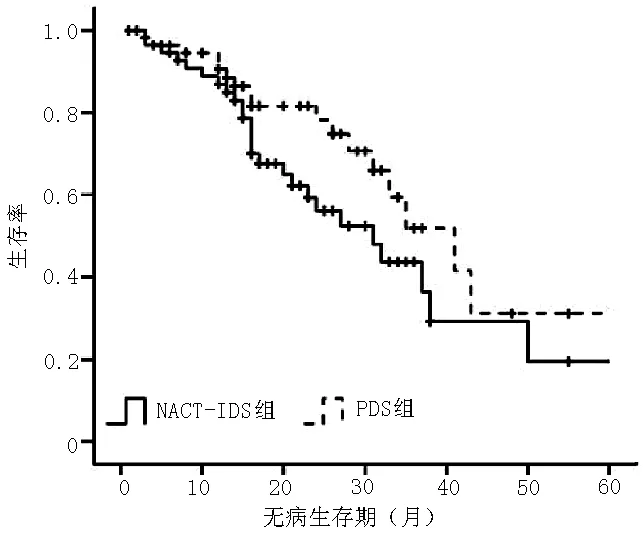
图1 两组患者无病生存期Kaplan-Meier生存曲线
3 讨论
肿瘤细胞减灭术后联合铂类药物为基础的化疗是治疗卵巢癌的标准方案并且能延长患者的生存期。NACT-IDS可在不同疾病背景下作为一种治疗策略。NACT-IDS经过研究证实可以减少二次手术相关的病死率及在进展期卵巢癌患者中获得最优化最彻底的肿瘤细胞减灭效果。Vergote等[7]的随机对照研究证实NACT-IDS和PDS方案的患者生存率相当,而其他研究中的研究结果则显示NACT-IDS的生存率则低于PDS。虽然很难对两者生存率进行严格的比较,但本研究结果证实NACT-IDS和PDS的中位无病生存期无差异,而中位总生存期存在差异,PDS优于NACT-IDS。NACT-IDS是否引发铂类药物耐药性相关报道较少。
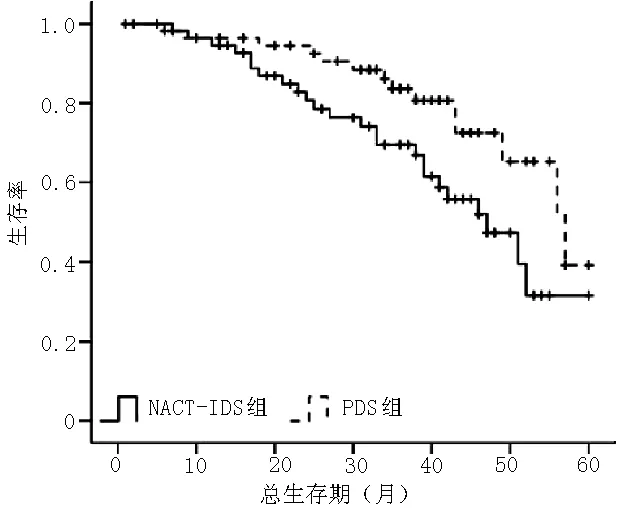
图2 两组患者总生存期Kaplan-Meier生存曲线
卵巢癌被认为是实体瘤中对细胞毒性化疗药物最为敏感的肿瘤之一,并且据估计超过80%的女性患者接受了标准的铂类联合紫杉醇的化疗方案[8-9]。然而有超过75%对铂类化疗药物敏感的患者发生复发[10]。铂类耐药性定义为首次接受以铂类药物为基础的常规化疗有效,停药半年内出现复发。患者化疗后12个月复发定义为对铂类敏感。患者复发时间介于化疗后6~12个月,被定义为铂类部分敏感,大约30%的患者对铂类药物敏感。铂类药物耐药是一种多因素的结果[11]。这些因素包括肿瘤本身性质及治疗过程中获得性因素。目前的研究表明,许多分子通路与肿瘤耐药相关,例如DNA修复增强,药物外排增加或者对关键分子失活,这些均可以作为临床上预测患者预后的相关因素。更好地了解耐药机制及铂类耐药相关风险因素则是开发药物和制定规避耐药机制的途径之一[12]。有学者证实肿瘤耐药性与其大小相关[13]。根据其假设,体积较大的肿瘤存在更多的耐药细胞。根据这一理论,采用NACT-IDS方案可以增加肿瘤获得性耐药的风险,当化疗时患者体内肿瘤体积仍较大。本研究采用通用的标准来评价化疗反应性及铂类耐药性,多因素非条件Logistic回归分析结果显示,对铂类为基础的化疗第一个周期有反应的患者中,NACT-IDS组患者更容易发生铂类耐药,风险较PDS组上升1.72倍,<57岁、化疗周期≤6分别较≥57岁、化疗周期>6耐药风险上升3.22倍、2.59倍。经过≥4周期化疗的患者多因素非条件Logistic回归分析结果显示,治疗方法、FIGO分期、年龄与铂类药物耐药有回归关系。这也提示产生铂类耐药性的风险和药物使用时间有关,药物使用时间也会根据患者的化疗效果而进行调整。化疗周期长的患者其产生耐药性的风险大,这可能由于患者本身经历的临床干预措施以及自身的客观条件决定了其对化疗药物反应性差、起效较慢,因而使用时间过长。这也指导临床上应该更多地关注患者的临床干预方案及自身客观因素,才能达到最佳的化疗效果,如果产生耐药风险较高,可以尽早地更换其他化疗药物。有研究者对卵巢癌、输卵管癌和腹膜癌体外耐药性进行了评估,结果发现NACT-IDS较PDS能够更明显地增加肿瘤对铂类耐药性,而PDS与NACT-IDS两组对紫杉醇的耐药性无差异[14]。Bristow等[15]研究发现,每一个术前化疗周期都会相应地降低4.1个月的中位生存时间。本研究中PDS组与NACT-IDS组中位无病生存期无差异,而中位总生存期则NACT-IDS组低于PDS组。与之前有一定差异,这可能由于本研究样本较小,存在一定的偏倚所致。
本研究回顾性分析晚期卵巢癌患者对铂类药物耐药性的风险,比较了PDS与NACT-IDS两种方案治疗后患者对铂类药物敏感性的差异。由于本研究为回顾性研究,选择偏倚不可避免,对于患者的后续护理也知之甚少,而且患者一些二线治疗方案会对其生存期产生影响。在今后的研究中,将对不同病理类型患者铂类耐药性的分子机制进行更加深入的研究和探索,以便为临床化疗提供更有利的理论依据。
1 Chang SJ,Bristow RE,Ryu HS.Impact of complete cytoreduction leaving no gross residual disease associated with radical cytoreductive surgical procedures on survival in advanced ovarian cancer[J]. Ann Surg Oncol,2012,19(13):4059-4067.
2 Chereau E,Lavoue V,Ballester M,et al.External validation of a laparoscopic-based score to evaluate respectability for patients with advanced ovarian cancer undergoing interval debulking surgery[J]. Anticancer Res,2011,31(12):4469-4474.
3 Chi DS,Musa F,Dao F,et al.An analysis of patients with bulky advanced stage ovarian,tubal,and peritoneal carcinoma treated with primary debulking surgery(PDS) during an identical time period as the randomized EORTC-NCIC trial of PDS vs neoadjuvant chemotherapy(NACT) [J]. Gynecol Oncol,2012,124(1):10-14.
4 Dewdney SB,Rimel BJ,Reinhart AJ,et al.The role of neoadjuvant chemotherapy in the management of patients with advanced stage ovarian cancer:survey results from members of the society of gynecologic oncologists[J]. Gynecol Oncol,2010,119(1):18-21.
5 Fagö-Olsen CL,Håkansson F,Antonsen SL,et al.Diagnostic accuracy of risk of malignancy index in predicting complete tumor removal at primary debulking surgery for ovarian cancer patients[J]. Acta Obstet Gynecol Scand,2013,92(6):721-726.
6 Freedman OC,Dodge J,Shaw P,et al.Diagnosis of epithelial ovarian carcinoma prior to neoadjuvant chemotherapy[J]. Gynecol Oncol,2010,119(1):22-25.
7 Vergote I,Tropé CG,Amant F,et al.Neoadjuvant chemotherapy or primary surgery in stage ⅢC or Ⅳ ovarian cancer[J]. N Engl J Med,2010,363(10):943-953.
8 Furukawa N,Sasaki Y,Shigemitsu A,et al.CA-125 cut-off value as a predictor for complete interval debulking surgery after neoadjuvant chemotherapy in patients with advanced ovarian cancer[J]. J Gynecol Oncol,2013,24(2):141-145.
9 Keyver-Paik MD,Zivanovic O,Rudlowski C,et al.Interval debulking surgery in patients with Federation of Gynecology and Obstetrics(FIGO) stage ⅢC and Ⅳ ovarian cancer[J]. Onkologie,2013,36(6):324-332.
10 Luyckx M,Leblanc E,Filleron T,et al.Maximal cytoreduction in patients with FIGO stage ⅢC to stage Ⅳ ovarian,fallopian,and peritoneal cancer in day-to-day practice:a Retrospective French Multicentric Study[J]. Int J Gynecol Cancer,2012,22(8):1337-1343.
11 Milam MR,Tao X,Coleman RL,et al.Neoadjuvant chemotherapy is associated with prolonged primary treatment intervals in patients with advanced epithelial ovarian cancer[J]. Int J Gynecol Cancer,2011,21(1):66-71.
12 唐兆前,李力,张玮,等.卵巢癌卡铂耐药相关肿瘤抑制基因差异表达的研究[J].中国全科医学,2010,13(7):2338-2341.
13 Pölcher M,Mahner S,Ortmann O,et al.Neoadjuvant chemotherapy with carboplatin and docetaxel in advanced ovarian cancer--a prospective multicenter phase Ⅱ trial(PRIMOVAR) [J]. Oncol Rep,2009,22(3):605-613.
14 Le T,Faught W,Hopkins L,et al.Can surgical debulking reverse platinum resistance in patients with metastatic epithelial ovarian cancer? [J].J Obstet Gynaecol Can,2009,31(1):42-47.
15 Bristow RE,Eisenhauer EL,Santillan A,et al.Delaying the primary surgical effort for advanced ovarian cancer:a systematic review of neoadjuvant chemotherapy and interval cytoreduction[J]. Gynecol Oncol,2007,104(2):480-490.

