急性髓系白血病患者骨髓细胞中上皮钙黏着蛋白和β-连环蛋白的基因表达水平及其临床意义
许 娜,周 旋,肖小珍,卢绮思,肖雅娟,高冠伦,周红升,徐 丹,刘晓力
骨髓微环境不仅支持正常或恶性造血细胞的生长、增殖,还能保护肿瘤细胞逃避化疗药物引起的凋亡,其中骨髓基质细胞可分泌多种细胞黏附因子介导耐药[1],是近几年国内外学者研究的热点。上皮钙黏着蛋白(E-cadherin,E-cad)是钙黏蛋白家族成员之一,表达于骨髓基质细胞和CD34+造血干细胞,介导造血细胞与骨髓基质细胞的相互作用,E-cad可直结合β-连环蛋白(β-catenin)形成复合物抑制Wnt/β-catenin通路激活[2]。本研究应用实时定量PCR方法检测急性髓系白血病(AML)患者骨髓细胞中E-cad和β-catenin基因表达水平,为深入研究骨髓微环境介导的耐药提供实验室基础。
1 资料与方法
1.1 一般资料 选取2010年9月—2012年7月南方医科大学南方医院血液科诊治的初发AML患者75例(AML组),均符合原发性AML诊断标准[2],均知情同意。其中男41例,女34例;年龄为13~67岁,中位年龄35岁。按照FAB分型:M1 3例、M2 27例、M3 7例、M4 16例、M5 22例。其中55例完成染色体核型分析,包括正常核型31例,染色体异常24例。另选取同期我院诊治的非恶性血液病患者20例为对照组,其中缺铁性贫血13例,特发性血小板减少性紫癜7例;男12例,女8例;年龄为15~60岁,中位年龄34岁。两组患者性别构成及年龄间有均衡性。
AML组患者诱导缓解方案:非M3患者采用DA(柔红霉素、阿糖胞苷)、IA(去甲氧柔红霉素、阿糖胞苷)、TA(吡喃阿霉素、阿糖胞苷)、HA(高三尖杉酯碱、阿糖胞苷)方案;M3患者采用全反式维甲酸诱导分化治疗。共有7例进行自体干细胞移植,3例进行异基因干细胞移植,随访370 d。
1.2 方法
1.2.1 RNA提取及反转录为cDNA 取肝素抗凝骨髓液3~5 ml,常规Ficoll淋巴细胞分离液分离单个核细胞,TRIzol提取细胞总RNA,经紫外分光光度计和10%琼脂糖凝胶电泳检测RNA质量和浓度。按照反转录酶试剂盒(TAKARA公司)说明书中的步骤反转录cDNA。
1.2.2 实时定量PCR检测E-cad和β-catenin基因表达 引物由上海英骏生物技术有限公司合成,E-cad上游引物:5′-GGCTCAAGCTATCCTTCAC-3′,下游引物:5′-CTTGAGCCCAGGAGTTTGAG-3′;β-catenin上游引物:5′-ACCTTTCCCATCATCGTGAG-3′,下游引物:5′-AATCCACTGGTGAACCAAGC-3′;GAPDH上游引物:5′-CAGTTGCCATGTACCCCT-3′,下游引物:5′-GCTGCCCACAGAATAGCTTC-3′。按SYBR Premix Ex Taq试剂盒(TAKARA公司)说明书进行。总体系20 μl,SYBR Premix 1 μl,上下游引物(10 μmol/L)各0.4 μl,cDNA 2 μl,灭菌三蒸水7.2 μl。循环条件:95 ℃ 15 s;95 ℃ 5 s;72 ℃ 30 s;40个循环。每个标本均做2个平行管,取2管平均Ct值计算2-ΔCt值作为各标本mRNA的相对表达量,-ΔCt=(目的基因Ct值-内参基因Ct值)。
比较AML组与对照组、AML组不同FAB分型间、AML合并髓外浸润组与无髓外浸润组、难治性AML组与非难治性AML组E-cad、β-catenin mRNA的表达水平,探讨E-cad、β-catenin mRNA的表达水平与临床特征的关系。患者出现下列情况之一即为髓外浸润:(1)病理学证实为髓外浸润;(2)临床上有肝、脾、淋巴结肿大、牙龈增生肿胀、胸腔积液、脑脊液,或胸片、B超等客观检查发现病变,排除其他病因且化疗有效。难治性AML的标准:将2个疗程未达完全缓解(CR)、首次CR后6个月内复发、首次CR后6个月后复发但经正规诱导化疗失败、多次复发定义为难治性AML。上述标准均参照张之南等主编的《血液病诊断及疗效标准》[3]。
1.3 统计学方法 采用SPSS 15.0软件进行统计检验。由于E-cad、β-catenin mRNA的表达水平不符合正态分布,故以中位数(M)、四分位间距(QR)描述,组间比较采用独立样本非参数检验(Mann-Whitney U test);相关分析采用Spearman相关分析。检验水准α=0.05。
2 结果
2.1 熔解曲线及扩增效率一致性分析 所提取的RNA经分光光度计检测吸光度(A),A260 nm/A280 nm值均在1.8~2.0,纯度较高,可用于实时定量PCR检测。实时定量PCR在反应结束后,仪器自动进行了熔解曲线分析,可见到一个锐利峰形,特异性扩增产物熔解温度均一(见图1),说明特异性扩增产物较为单一。应用2%琼脂糖凝胶电泳鉴定PCR扩增产物,可见β-catenin、GAPDH基因PCR产物位于200~400 bp之间靠近200 bp处,E-cad PCR产物位于600~800 bp之间靠近600 bp处,与预期位置226、225、630 bp相符(见图2),且条带致密、明亮,无引物二聚体和非特异性扩增,说明扩增产物正确,引物特异性好。
注:A为E-cad,B为β-catenin,C为GAPDH
图1 实时定量PCR扩增曲线和溶解曲线
Figure1 Amplification curve and melting curve of real-time PCR
图2 实时定量PCR扩增产物2%琼脂糖凝胶电泳
Figure2 2% agarose gel electrophoresis of the real-time PCR amplification product
2.2 E-cad和β-catenin mRNA表达水平比较 AML组E-cad mRNA、β-catenin mRNA表达水平分别为0.003(0.007)和0.026(0.311),与对照组的0.091(0.109)和0.004(0.011)比较,差异均有统计学意义(z=-5.425,P=0.000;z=-6.016,P=0.000)。AML组不同FAB分型间E-cad、β-catenin mRNA表达水平比较,差异均无统计学意义(P>0.05,见表1)。
表1 AML组不同FAB分型间E-cad、β-catenin mRNA表达水平比较〔M(QR)〕
Table1 Comparison of expression of E-cad and β-catenin mRNA in AML patients with different FAB type
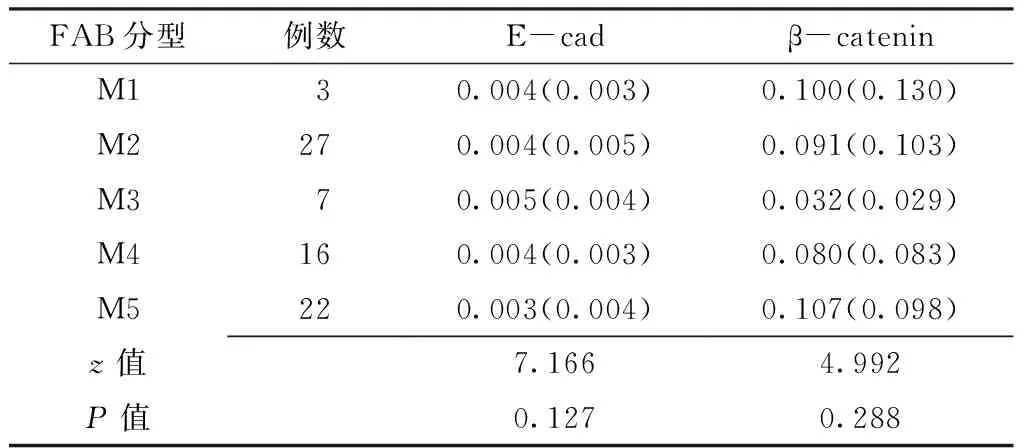
FAB分型例数E-cadβ-cateninM1 3 0.004(0.003)0.100(0.130)M2270.004(0.005)0.091(0.103)M3 7 0.005(0.004)0.032(0.029)M4160.004(0.003)0.080(0.083)M5220.003(0.004)0.107(0.098)z值7.1664.992P值0.1270.288
注:E-cad=钙黏着蛋白,β-catenin=β-连环蛋白
2.3 E-cad和β-catenin mRNA表达水平与临床特征的关系 Spearman相关分析显示,E-cad mRNA表达水平与乳酸脱氢酶水平呈负相关(P<0.05),而与年龄、初发时白细胞计数、外周血及骨髓原幼稚细胞比例均无线性相关(P>0.05)。β-catenin mRNA表达水平与患者年龄、初发时白细胞计数、外周血原幼稚细胞比例均无线性相关(P>0.05),而与患者乳酸脱氢酶水平、骨髓原幼稚细胞比例呈正相关(P<0.05,见表2)。
表2 AML患者E-cad和β-catenin mRNA表达水平与临床特征的相关性
Table2 Correlation analysis between E-cad and β-catenin mRNA expression with AML clinical characteristics
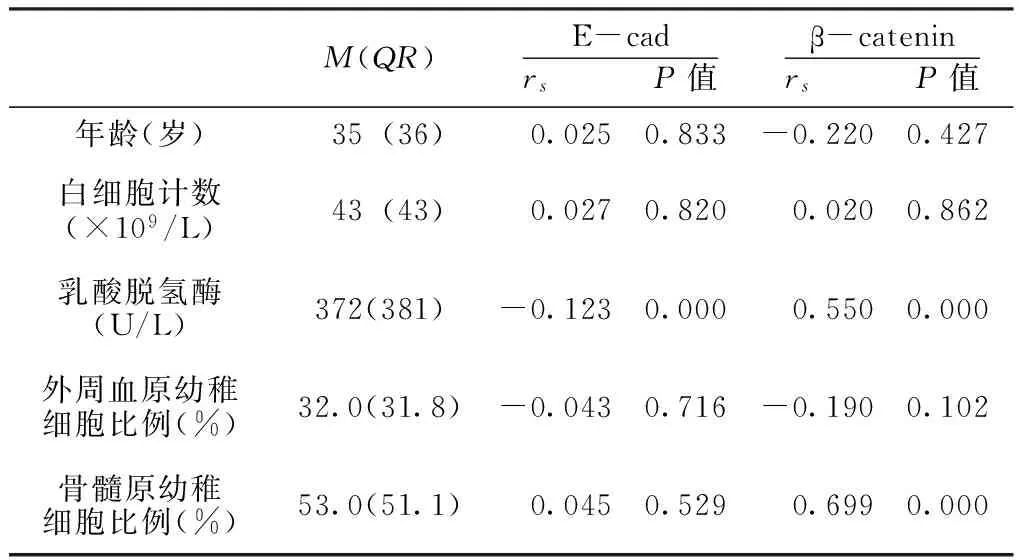
M(QR)E-cadrs P值β-cateninrs P值年龄(岁) 35(36) 0.0250.833-0.2200.427白细胞计数(×109/L) 43(43) 0.0270.820 0.0200.862乳酸脱氢酶(U/L)372(381)-0.1230.000 0.5500.000外周血原幼稚细胞比例(%)32.0(31.8)-0.0430.716-0.1900.102骨髓原幼稚细胞比例(%)53.0(51.1) 0.0450.529 0.6990.000
2.4 E-cad和β-catenin mRNA表达水平与髓外浸润及疗效的关系 75例AML患者中,17例患者合并髓外浸润(髓外浸润组),58例患者无髓外浸润(无髓外浸润组)。两组患者E-cad、β-catenin mRNA表达水平间差异均有统计学意义(P<0.05,见表3)。
75例AML患者中,3例患者放弃治疗、4例患者治疗不足1疗程未列入统计,其余68例患者均列入治疗反应分析,其中难治性AML组14例,非难治性AML组54例。两组患者E-cad、β-catenin mRNA表达水平间差异均有统计学意义(P<0.05,见表4)。
表3 髓外浸润组和无髓外浸润组AML患者E-cad、β-catenin mRNA表达水平比较〔M(QR)〕
Table3 Comparison of E-cad and β-catenin mRNA with and without extramedullary leukemia in AML
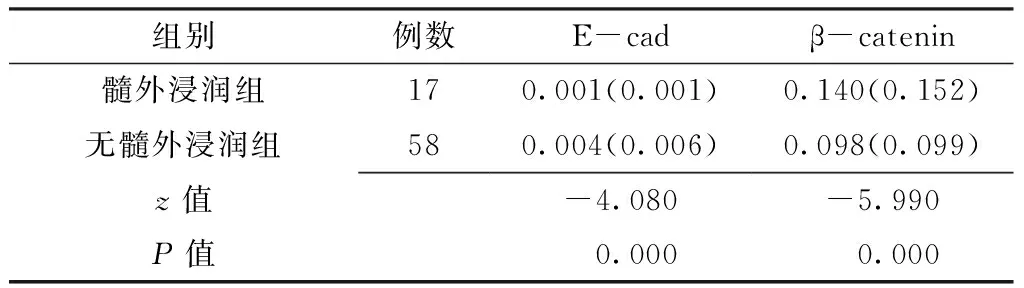
组别例数E-cadβ-catenin髓外浸润组170.001(0.001)0.140(0.152)无髓外浸润组580.004(0.006)0.098(0.099)z值-4.080-5.990P值 0.000 0.000
表4 难治性AML组和非难治性AML组患者E-cad、β-catenin mRNA表达水平比较〔M(QR)〕
Table4 Comparison of E-cad,β-catenin mRNA expression with and without refractory leukemia in AML
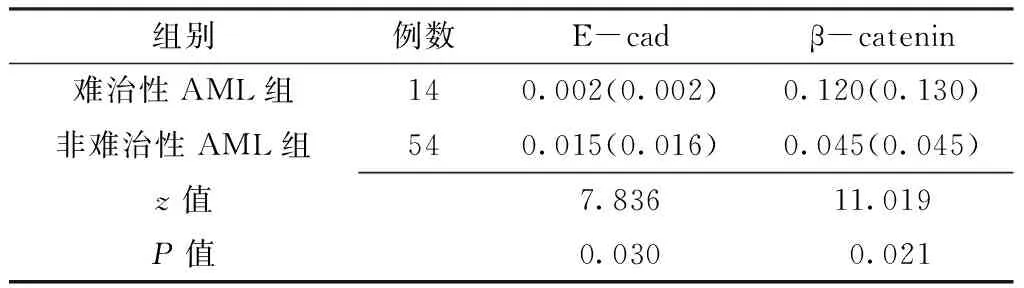
组别例数E-cadβ-catenin难治性AML组140.002(0.002)0.120(0.130)非难治性AML组540.015(0.016)0.045(0.045)z值7.83611.019P值0.030 0.021
3 讨论
近年来研究发现E-cad介导的细胞黏附除了与肿瘤侵袭、转移有关外,还可能参与细胞存活[4]。有研究表明,E-cad功能失活可能破坏造血干细胞和骨髓基质间的细胞黏附和信号传导,进而促进造血细胞恶性增殖并向外周血逃逸[5]。E-cad部分功能需依赖β-catenin来完成,细胞膜上的β-catenin可与E-cad内肽段结合形成复合体进而介导细胞组织结构的形成及黏附。生理情况下β-catenin主要在细胞膜上表达,其转录活性是低的,主要以介导黏附作用为主;如果在细胞质或细胞核中出现β-catenin的聚集,将激活Wnt/β-catenin通路,促进细胞恶性增殖。
E-cad表达缺失时,一方面β-catenin在细胞质内聚集到一定量后转位到细胞核中,与转录因子TCF/LEF结合形成TCF/LEF/β-catenin复合体,TCF/LEF抑制作用被解除,由转录抑制剂转变为转录激活剂,特异地启动下游靶基因如c-myc、CyclinD1等癌基因的转录和表达,引起细胞增殖加快,从而抵抗凋亡;另一方面,可使白血病细胞从彼此的连接中解离、迁移出来,并破坏造血微环境的稳态,获得侵袭性表型,使白血病细胞脱离其他细胞的黏附并进一步分散和转移。最近亦有报道E-cad在维持胚胎干细胞归巢及抑制肿瘤干细胞转移过程中起了重要作用[6]。
E-cad、β-catenin在上皮起源肿瘤中的作用已基本明确,而对其在血液系统恶性疾病中的作用研究相对较少。唐克晶等[7]应用反转录PCR检测出急性白血病患者E-cad低表达或缺失可能与E-cad基因CDH1启动子甲基化有关。Xu等[8]采用免疫组化的方法研究发现β-catenin在AML中表达增高,且与预后密切相关,其中β-catenin在细胞质中的异常积累是关键环节,而蛋白水平的增高涉及其合成的增多及降解的减少,Wnt通路主要在蛋白降解水平上对β-catenin进行调节,而对于β-catenin转录水平的研究国内外报道较少。饶青等[9]研究发现,E-cad细胞膜表达缺失与其甲基化有关,而β-catenin在AML中存在定位异常,进而推测β-catenin的异常定位可能参与白血病的发生,但该异常定位是否发生在转录水平上尚不明确。目前关于白血病细胞中是否存在β-catenin转录水平异常仍存在争议。
本研究采用实时定量PCR方法检测了75例AML患者E-cad和β-catenin的基因表达水平,发现与非恶性血液病患者比较,AML患者E-cad基因失表达或低表达,β-catenin基因表达水平则较高;同时,AML合并髓外浸润者β-catenin mRNA表达水平明显升高,而E-cad mRNA几乎不表达。E-cad介导的细胞黏附使上皮细胞保持正常极性及同型细胞紧密连接的分子基础,在正常上皮细胞生长的“接触抑制”中起着重要作用[10-11]。因此,推测在AML中低表达或失表达的E-cad使cadherin-catenin复合体难以形成,而黏附复合体结构的破坏,使细胞之间的黏附能力降低,从而促进急性白血病细胞髓外浸润的形成。进一步分析E-cad、β-catenin基因表达与临床特征的关系,发现β-catenin mRNA表达水平与患者乳酸脱氢酶水平、骨髓原幼稚细胞比例呈正相关;且在难治性AML中,β-catenin表达水平明显增高,可能因为细胞膜E-cad表达的缺失,破坏了E-cad维持细胞间黏附的平衡,并促进了β-catenin在细胞内的聚集,从而激活Wnt/β-catenin通路,导致白血病细胞恶性增殖、凋亡受抑。
本研究初步证实了E-cad缺失可引起β-catenin被释放转入细胞核引起一系列癌基因的转录,为阐明E-cad介导的造血细胞与骨髓基质细胞间相互作用的丧失在白血病发生中的作用及机制提供了实验依据。
1 Meads MB,Hazlehurst LA,Dalton WS.The bone marrow microenvironment as a tumor sanctuary and contributor to drug resistance[J].Clin Cancer Res,2008,14(9):2519-2526.
2 Zhang B,Li M,McDonald T,et al.Microenvironmental protection of CML stem and progenitor cells from tyrosine kinase inhibitors through N-cadherin and Wnt-β-catenin signaling[J].Blood,2013,121(10):1824-1838.
3 张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:45-47.
4 Inge LJ,Barwe SP,D′Ambrosio J,et al.Soluble E-cadherin promotes cell survival by activating epidermal growth factor receptor[J].Exp Cell Res,2011,317(6):838-848.
5 Klopp AH,Lacerda L,Gupta A,et al.Mesenchymal stem cells promote mammosphere formation and decrease E-cadherin in normal and malignant breast cells[J].PLoS One,2010,5(8):e12180.
6 Redmer T,Diecke S,Grigoryan T,et al.E-cadherin is crucial for embryonic stem cell pluripotency and can replace OCT4 during somatic cell reprogramming[J].EMBO Rep,2011,12(7):720-726.
7 唐克晶,饶青,孟继虹,等.E-cadherin表达缺失在白血病细胞行为中的作用[J].中国病理生理杂志,2009,25(3):489-492.
8 Xu J,Suzuki M,Niwa Y,et al.Clinical significance of nuclear non-phosphorylated beta-catenin in acute myeloid leukaemia and myelodysplastic syndrome[J].Br J Haematol,2008,140(4):394-401.
9 饶青,徐智芳,王继英,等.E-cadherin在白血病细胞膜表面的表达及与β-catenin细胞膜定位的关系[J].中华血液学杂志,2008,29(9):592-594.
10 Kim NG,Koh E,Chen X,et al.E-cadherin mediates contact inhibition of proliferation through Hippo signaling-pathway components[J].Proc Natl Acad Sci U S A,2011,108(29):11930-11935.
11 安继荣,张亚珍,刘小峰,等.上皮钙黏蛋白和黏附分子CD44V6及基质金属蛋白酶2在贲门癌中的表达及意义[J].中国全科医学,2011,14(10):3364.

