乳酸菌微生物燃料电池产电性能及产电机理研究
杨静娜,孙玉娣,关 毅
(天津大学化工学院,天津300072)
微生物燃料电池(M icrobial Fuel Cell,简称MFC)是指在微生物的催化作用下将有机物的化学能转变成电能的装置[1]。由于 MFC可以将各种有机质直接转化成电能,不仅能量转化率高、无污染,而且在获得电能的同时可以净化废水、废物,消减或消除污染,MFC日益受到学术界的关注[2-4]。1910年英国植物学家Potter以葡萄糖为底物,酵母和大肠杆菌为产电微生物,在MFC中获得了电压[4],此后,MFC在空间科学研究领域取得了较大进展。MFC具有能源转化效率高、燃料来源广泛、反应条件温和、环保无污染等特点,成为极具希望缓解能源短缺问题的新技术。
日益增长的能源需求与环境危机促使人们关注可再生能源的发展[5-6]。微生物燃料电池在能量转化过程中减少了燃烧步骤,使其转化效率大大提高,具有很广阔的应用前景,研究者们已经在其结构设计和提高输出功率方面取得了很大进展[7-12]。但是目前微生物燃料电池的电子回收率和电流密度都不高,因此选取高活性的微生物尤其重要[13]。乳酸菌作为产电微生物具备如下优势:来源广泛,生长迅速;作为耐氧厌氧型,用其制成的MFC适用性广泛;对人体与环境安全无害;遗传背景较为清楚,便于机理研究。张鑫[14]等以乳酸菌为产电微生物,MFC的最大输出电压为637.2 mV,说明以乳酸菌为产电菌是可行的,具有良好效果。
MFC系统底物直接影响着产电能力[15],葡萄糖是微生物新陈代谢不可缺少的碳源,其氧化反应释放的能量是微生物生命活动所需能量的重要来源[16],因此选择葡萄糖作为 MFC的底物。本研究采用1.5 g/L葡萄糖溶液作为阳极液,0.1 mol/L的铁氰化钾溶液作为阴极液,环境温度为30℃。通过考察乳酸菌产电过程中pH值、阳极液中乳酸菌菌数、葡萄糖浓度、化学耗氧量(COD)、代谢产物(主要是醛、醇和酸类)的变化,并且设置空白对照实验即乳酸菌生物膜电极在非产电的情况(生物膜电极在单个瓶中进行厌氧发酵),以此来分析乳酸菌产电的主要代谢过程。
微生物燃料电池的研究逐渐增多,在生物部分的研究包括产电微生物的选择、产电微生物细胞内的电子传递以及微生物与电极之间的电子传递机理等,其中产电微生物的生理学特性以及具体的产电机制的检测存在一定困难。本实验选取高活性的乳酸菌作为产电微生物,首次以气相色谱手段分析乳酸菌代谢产物的含量来判断产电过程中乳酸菌的产电机理。
1 实验装置和方法
1.1 实验装置
本实验采用自制的双室微生物燃料电池系统,它主要是由2个等容积的圆形玻璃反应器(高10 cm,底面直径6 cm)组成,有效体积为250 mL。反应器间有管路连接,管路中间用4×4 cm2的N117质子交换膜(上海河森电气有限公司)将两反应器隔开,在使用之前要经过消毒处理。电池系统的电极均采用经处理后的碳纸电极(HCP030,上海河森电气有限公司),电极尺寸为4×2.5 cm2。
1.2 菌种与运行条件
微生物菌种取自某乳业污水,经分离纯化培养驯化后备用。菌种培养采用MRS培养基。MFC的阳极液由1.5 g/L的葡萄糖和磷酸盐缓冲液组成,阴极液采用铁氰化钾溶液。阳极阴极pH值均调节到7.0。
1.3 分析与测试
1.3.1 M FC产电性能测试
在双室微生物燃料电池系统中进行乳酸菌MFC的启动,首先将电极置于MRS培养液中放于4℃冰箱1周或以上使细菌形成的生物膜牢固附着于碳纸上,然后将乳酸菌的生物膜阳极放入微生物燃料电池反应器中,阳极室加入COD为1.5 g/L的阳极液,进行产电性能的实验。
MFC的产电性能通常以最大输出功率密度来表示,待MFC系统稳定后,将外阻在50~10000Ω区间内逐渐增大,记录在不同外阻条件下电池的输出电压,计算输出功率。根据P=U2/R,当R=r时,功率达到最大Pmax=U2/4r。由于微生物生长的电极面积会对产能产生影响,因此单位面积或体积产生的功率更能说明微生物产电的情况,本实验采用阳极面积功率密度,阳极面积为 A,计算公式如式(1)。

1.3.2 葡萄糖浓度和COD去除率的测定
葡萄糖浓度的测定:在氢氧化钠和苯酚存在下,3,5-二硝基水杨酸(DNS)与还原糖在沸水浴中反应生成3-氨基-5硝基水杨酸。在过量的氢氧化钠碱性溶液中此化合物呈橘红色,在540nm处有最大吸收峰,在一定的浓度范围内,还原糖的量与光吸收值呈线性关系。本实验采用北京瑞利分析仪器公司的UV-9200紫外可见分光光度计在540nm波长下测定反应生成物的吸光度,以此来确定底物葡萄糖的浓度。
COD去除率的测定:采用重铬酸钾法测定。
1.3.3 乳酸菌M FC代谢产物成分及含量的检测
采用北京瑞利分析仪器公司生产的SP-2100气相色谱仪,色谱柱为石英毛细管柱,分别用顶空气相色谱法和甲酯化法测定代谢产物的含量。
1.3.3.1 顶空气相色谱法测定乙醇及乙醛含量
色谱操作条件:柱温40℃(0.21min)→90℃(3.00min)10℃/min,进样器 110℃,FID检测器:130℃。氮气 10 mL/min,氢气 10 mL/min,氧气20 mL/min。
1.3.3.2 甲酯化法测定乙酸及乳酸含量
色谱操作条件:柱温80℃(0.21min)→110℃(0.51min)10℃/min,110℃(0.21min)→210℃(0.51min)20℃/min进样器220℃,FID检测器:230℃。氮气 10 mL/min,氢气 10 mL/min,氧气20 mL/min。
2 结果与分析
2.1 电压和功率密度曲线
在室温条件下,乳酸菌MFC以1.5 g/L葡萄糖为底物,图1给出了电池的开路电压随时间的变化关系和乳酸菌MFC的功率密度曲线。
由图1a)可以看出,乳酸菌在经过1.8 d的适应期开路电压由820 mV降至500 mV,然后电压虽然有一定程度的下降,但是仍处于相对稳定的水平。在运行7 d后由于底物葡萄糖的大量消耗,电压明显下降。待乳酸菌MFC系统运行稳定后,将外阻在50~10000Ω区间内逐渐增大,记录不同电阻下电池的电压值,从而计算出不同外阻时电池的电流和功率密度。图1b)是乳酸菌MFC的功率密度曲线。由图1可知,功率密度随电流的增大而增大,增至最大值后,电流进一步增大,功率密度却迅速降低。这是由于电流随外部电阻的减小而增加,当外部电阻减小到较小值,电流增加至较大值时,发生了近似短路的情况,导致输出功率密度迅速降低。在该实验条件下,乳酸菌MFC在500Ω外阻条件下获得393.23 mW/m2的最大输出功率密度,即其内阻约为500Ω。
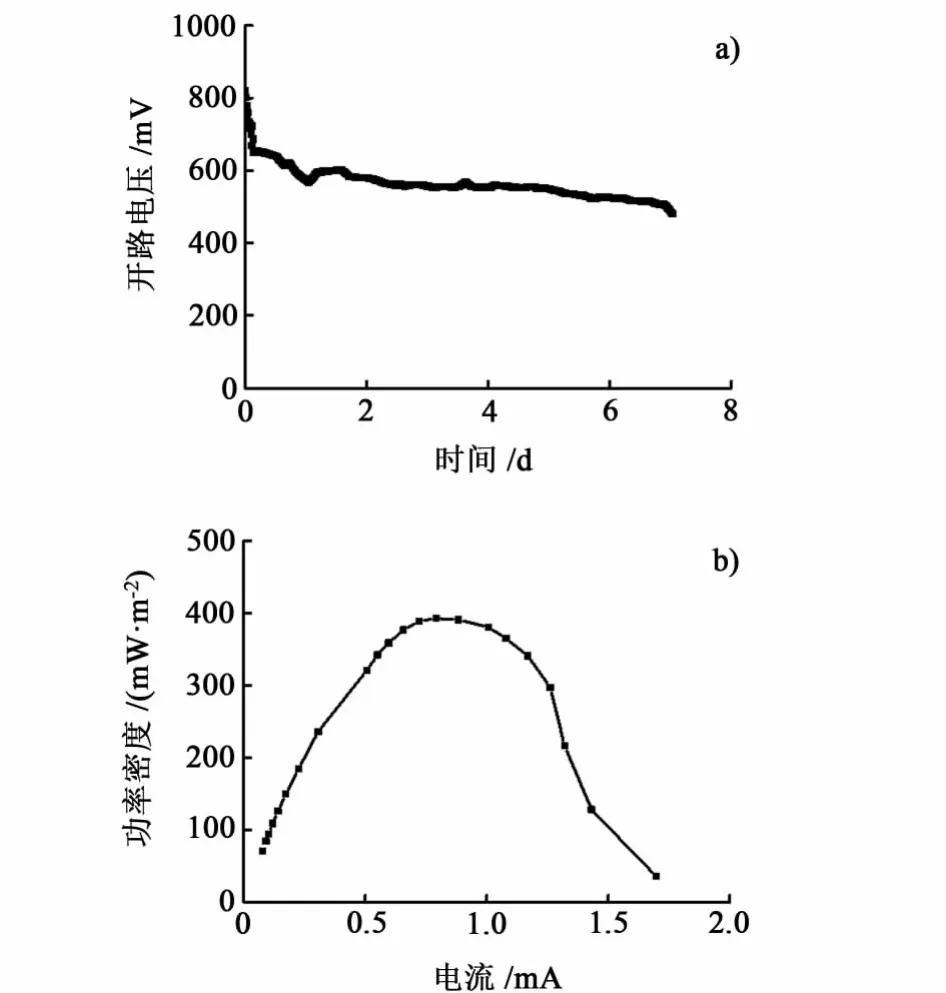
图1 乳酸菌MFC开路电压a)和功率密度b)Fig.1 Open-Circuit voltage a)and power density b)of the lactic acid bacteria MFC
2.2 产电过程中各参数的情况对比
图2是乳酸菌MFC产电过程及空白对照的pH值,乳酸菌菌数,葡萄糖浓度和COD去除率的变化。
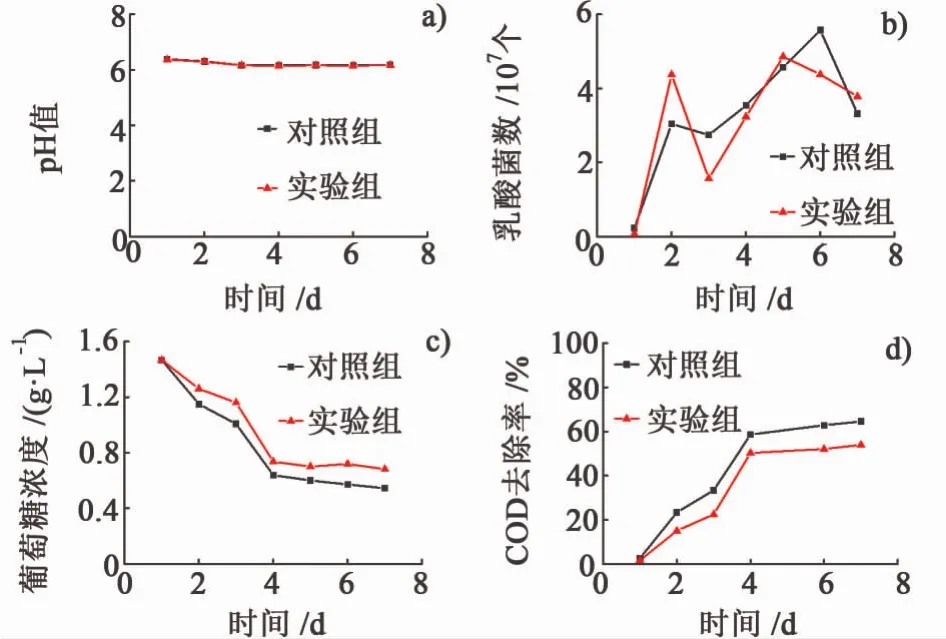
图2 产电过程中各参数的变化:a)pH值;b)乳酸菌菌数;c)葡萄糖浓度;d)COD去除率Fig.2 Each parameter changers in the process of producing electricity:a)pH value; b)the number of lactic acid bacteria; c)glucose concentration;d)removal rate of COD
张培远等[17]发现,随着 MFC的运行,阳极液的pH值会呈现下降的趋势,然而由图2a)可知产电过程和空白对照的pH值变化均不明显,出现这样的结果是由于溶液中均存在着磷酸盐缓冲液。由图2b)可知,产电和非产电实验的乳酸菌数总体均为增长,但产电比非产电实验乳酸菌菌数波动要大些,到第6 d随着葡萄糖的消耗乳酸菌菌数均开始减少。从图2c)中可以看出两者葡萄糖浓度的下降趋势相同,而产电过程中消耗的葡萄糖量低于空白对照。从图2d)中可以看出,随着时间的延长,COD的去除率均在增加,并且产电过程的COD去除率要低于空白对照实验。图2c)和图2d)说明产电过程提高了乳酸菌对能量的利用率,减少了葡萄糖的消耗。
产电过程中乳酸菌菌数有变化,但是由图1a)可知,MFC的开路电压没有受菌数波动的影响而发生明显变化,这说明溶液中的细菌对产电的贡献微乎其微,对产电起主要作用的是阳极生物膜的细菌。根据连静等[18-19]的发现,电流达到稳定平台的时间就是微生物吸附在电极上并形成成熟生物膜所需的时间,电流的大小受生物膜的影响。生物膜形成初期,微生物与接触面之间以及微生物之间相互作用,一旦足够多的细胞聚集起来,细胞通过分泌的胞外物质将彼此连接而形成生物膜。MFC产生电压主要是由于细菌吸附在电极表面而致,并不是由于悬浮在溶液中的细菌所致,所以菌数的变化对开路电压影响不大。但是溶液中的细菌数与COD去除率有着一定的关系,当电池运行初期或细菌呈对数生长期间,COD的去除率也迅猛升高。细菌生长的初期及对数期均需要大量的营养物质来进行合成代谢,以提供自身生长必须得核糖体、酶类和ATP等,因此最初和对数生长期COD大量消耗,之后细菌进入生长稳定期,COD下降缓慢。在MFC产电过程中,随着葡萄糖浓度的降低,开路电压并未随之明显下降,分析其原因:一部分是因为葡萄糖已经转化为代谢中间产物,这些中间产物进一步代谢产生电能;另一部分是由于葡萄糖消耗完后,有机底物不足,细胞内源呼吸的作用。
2.3 乳酸菌产电过程中代谢产物含量变化
图 3a),图 3b),图 3c)和图 3d)分别是酵母菌MFC产电过程及空白对照溶液中的乙醛、乙醇、乙酸和乳酸含量的变化。
对于乙醛的含量变化,在空白对照中,乙醛的产量在1周内相对较稳定,在0.1 g/L左右,而在参与产电的样品中,乙醛的产量在第2 d达到最高值,第4 d再次达到一次高值。对于乙醇的含量变化,在空白对照中乙醇的产量在1周的时间内较稳定,在0.02 g/L左右,而在参与产电的样品中,乙醇的含量明显高于空白对照中乙醇含量。在空白对照中,乙醛和乙醇的含量均相对较稳定,说明乳酸菌在以葡萄糖为底物而非产电的情况下,各反应达到相对平衡,整个体系处于稳定状态。而乳酸菌在产电过程中,乙醇含量明显较高,说明产电环境可能会促进乳酸菌的异型乳酸发酵的经典途径。在空白对照中,乙酸的含量先由低到高,经再次升高后下降,最后又升高,总体上不稳定。在产电样品中,乙酸含量也是先升高再降低。乳酸的产量无论是在非产电的正常代谢途径,还是参与产电的代谢途径,均比较低,均低于0.1 g/L,但是变化趋势均为先升高,再降低,再缓慢升高。但是在空白对照中,高峰的出现要迟于产电的分析样品,这说明产电环境促进乳酸的生成。
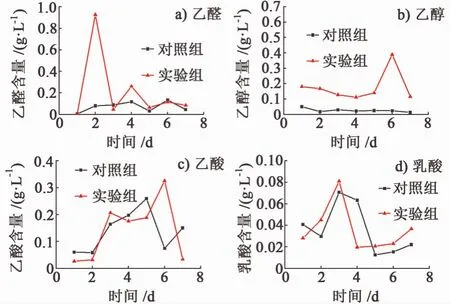
图3 乳酸菌M FC产电过程各代谢产物含量变化Fig.3 The content changes of acetaldehyde in the lactic acid bacteria MFC power production process
2.4 结果与分析
在产电和非产电过程中,均检测到乙醛、乙醇、乙酸和乳酸的存在,因此代谢中均可能涉及到乳酸菌的同型乳酸发酵途径、异型乳酸发酵的经典途径和双歧杆菌途径,见图4。假设乳酸菌产电过程中只涉及这几种途径中的一种,根据各种代谢产物的量来计算参与各反应的葡萄糖量,这却是没有解的一组方程组。从而推断,乳酸菌在MFC中的代谢可能是多种途径的共同结果。
为了判断可能的主要产电途径,设计试验在产电过程中人为添加乙醇。乳酸菌MFC开路电压稳定在480 mV,在第2 d添加乙醇浓度为2 g/L。图5是MFC添加乙醇前后各项数据的变化情况。
由图5可知添加乙醇后电压在0.2 d之内急剧下降,降至320 mV之后仍继续缓慢下降,在添加2 d之后电压降至154 mV。添加乙醇之后,溶液的pH值略有升高,乳酸菌正常生长。产电样品中,加入乙醇之后乙醇、乙醛、乙酸和乳酸的变化均较明显。加入乙醇之前,乙醛含量较低,加入乙醇之后产电样品中乙醛量增至0.68 g/L,第4 d稍下降,乙醇量变化与之相反。乙酸和乳酸均是在加入乙醇后的1 d内变化不大,2 d后急剧升高。
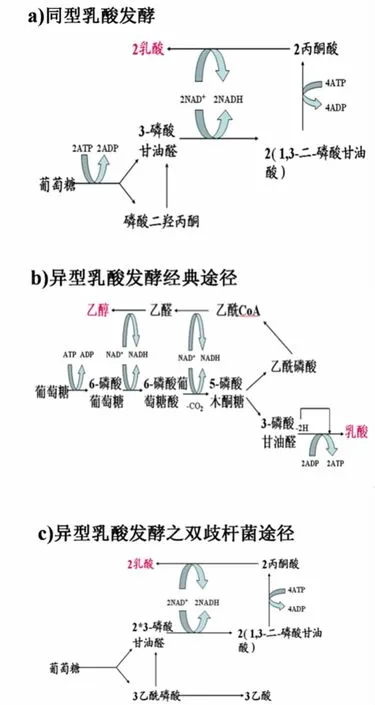
图4 乳酸菌发酵途径Fig.4 Fermentation pathway of lactic acid bacteria
在3种发酵途径中,生成乙醇的途径是异型乳酸发酵之经典途径。在体系中人为添加乙醇之后,由化学平衡可知,生成乙醇的正反应受到了一定程度的阻碍,而其逆反应则在一定程度上进行,因此加入乙醇之后导致了乙醛和乳酸的大量积累。乳酸的增多导致溶液的pH值下降,进而影响乙酸的形成。乳酸菌MFC加入乙醇之后电压先急剧下降之后又缓慢下降,这说明乙醇的添加不利于产电,乙醇的加入抑制了异型乳酸发酵经典途径,阻断了电子的传递,从而导致了电压的降低。因此可以推断,该途径(异型乳酸发酵之经典途径)是乳酸菌进行产电的主要代谢途径。
微生物与电极之间的直接接触是MFC电子转移的主要途径之一,生物膜上的微生物自身可以产生可溶性氧化还原电子中介体,可溶性中介体分散在阳极表面生物膜中参与底物的转化和电子的传递[20],细菌均是利用细胞分泌的多糖等物质将其与碳纤维连接起来的。为了看清乳酸菌的形貌,对乳酸菌的生物膜电极做环境扫描电镜分析。图6是乳酸菌的SEM照片,可以看出,乳酸菌黏附在碳纤维表面,实验过程中并没有外加中介体,得到了较高的开路电压,说明乳酸菌可以通过自身将电子转移到电极表面。
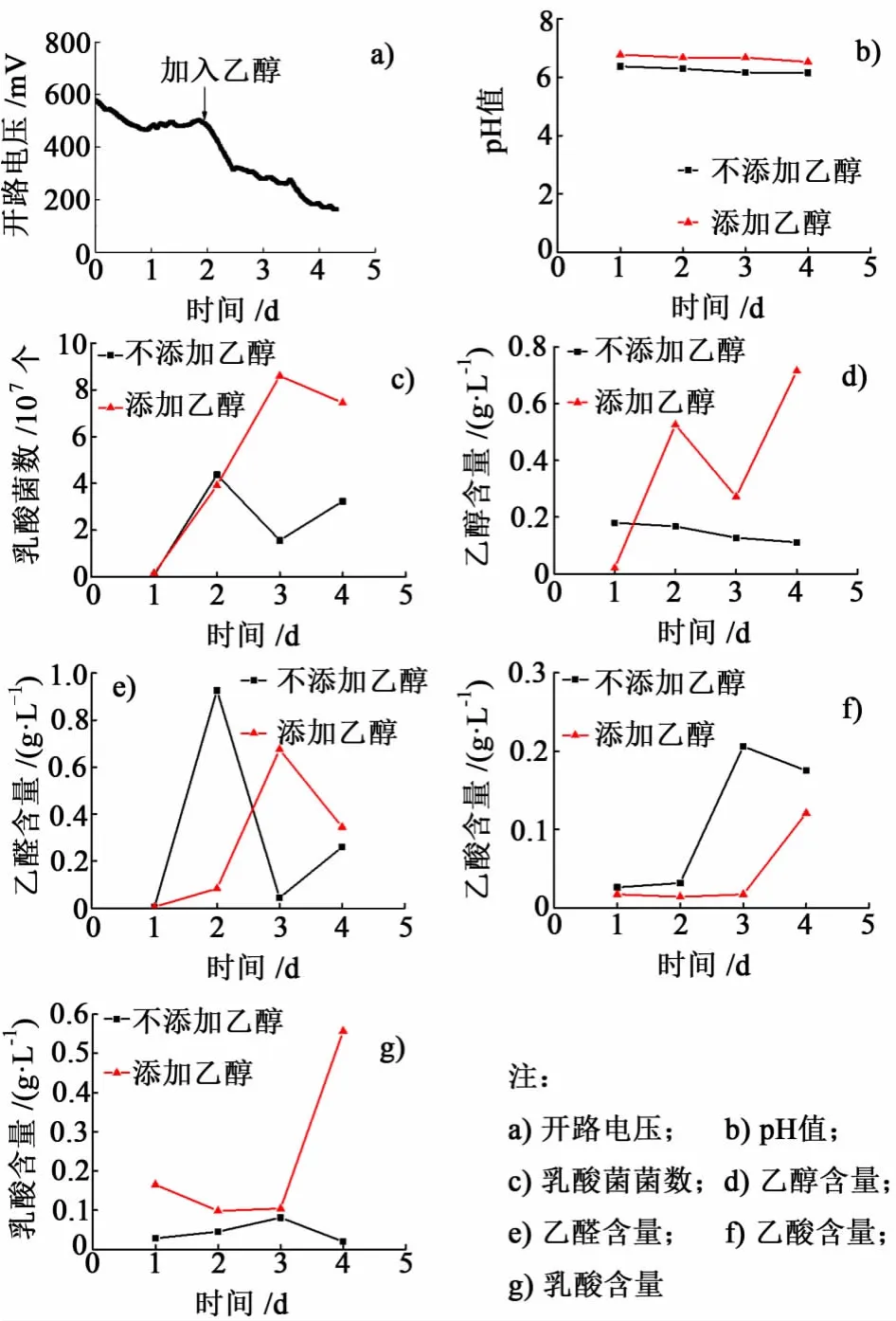
图5 M FC添加乙醇后各项数据Fig.5 Open-Circuit voltage in MFC
3 结论
1)30℃条件下,以葡萄糖为唯一的电子供体,初始浓度为1.5 g/L,双室微生物燃料电池可以连续产电,开路电压为500 mV,最大输出功率密度为393.23 mW/m2,内阻约为500Ω。
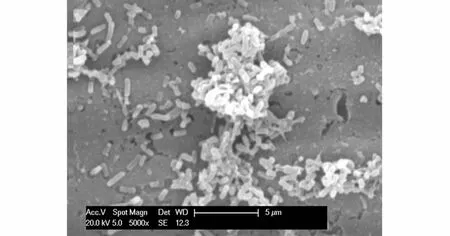
图6 乳酸菌生物膜电极的环境扫描电镜Fig.6 SEM of the lactic acid bacteria biofilm electrode
2)乳酸菌MFC的数据表明,在产电和非产电过程中都有可能涉及到乳酸菌的同型乳酸发酵途径、异型乳酸发酵的经典途径和双歧杆菌途径。乙醇的添加实验表明异型乳酸菌发酵的经典途径是乳酸菌进行产电的主要途径。
[1]Du Z,Li H,Gu T.A state of the art review on microbial fuel cells:A promising technology for wastewater treatment and bioenergy[J].Biotechnol Adv,2007,25:464-482
[2]Logan B E,Hamelers B,Rozendal R,et al.Microbial fuel cells:Methodology and technology[J].Environ Sci Technol,2006,40(17):5181-5192
[3]Bullen R A,Arnot T C,Lakemanc J B,et al.Biofuel cells and their development[J].Biosens Bioelectron,2006,21(11):2015-2045
[4]Rabaey K,Verstraete W.Microbial fuel cells:Novel biotechnology for energy generation[J].Trends Biotechnol,2005,23(6):291-298
[5]Tartakovsky B,Manuel M F,Neburchilov V,et al.Biocatalyzed hydrogen production in a continuous flow microbial fuel cell with a gas phase cathode[J].JPower Sourc,2008,182:291-297
[6]Lovley D R.Microbial fuel cells:Novelmicrobial physiologies and engineering approaches[J].Curr Opin Biotechnol,2006,17:327-332
[7]Logan B E,Murano C,Scott K,et al.Electricity generation from cysteine in a microbial fuel cell[J].Water Res,2005,39:942-952
[8]Kim JR,Jung SH,Regan JM,et al.Electricity generation and microbial community analysis of alcohol powered microbial fuel cells[J].Biores Technol,2007,98:2568-2577
[9]Chaudhuri S K,Lovley D R.Electricity generation by direct oxidation of glucose in mediatorless microbial fuel cells[J].Nat Biotechnol,2003,21:1229-1232
[10]Mohan Y,Kumar SM,Das D.Electricity generation using microbial fuel cells[J].Int J Hydr Eng,2008,33:423-426
[11]Manohar A K,Bretschger O,Nealson K H,et al.The polarization behavior of the anode in amicrobial fuel cell[J].Electr Acta,2008,53:3508-3513
[12]Bond D R,Holmes D E,Tender LM,et al.Electrode-Reducing microorganisms that harvest energy from marine sediments[J].Science,2002,295:483-485
[13]Rabaey K,Boon N,Siciliano SD,et al.Bio-Fuel cells select for microbial consortia that self-madiate electron transfer[J].Appl Environ Microbiol,2004,70(9):5373-5382
[14]张鑫.复合微生物燃料电池的研究 [D].天津:天津大学,2007 Zhang Xin.Study of microbial fuel cells using comp lex microorganisms[D].Tianjin:Tianjin University,2007(in Chinese)
[15]Liu Z,Liu J,Zhang S,et al.Study of operational performance and electrical response on mediator-lessmicrobial fuel cells fed with carbon and protein-rich substrates[J].Biochem Eng,2009,25:185-191
[16]徐金球,梁波,王利军,等.葡萄糖在微生物燃料电池中的应用研究进展 [J].上海第二工业大学学报,2012,29(4):257-265 Xu Jinqiu,Liang Bo,Wang Lijun,et al.Progress of application research for glucose in microbial fuel cells[J].Journal of Shanghai Second Polytechnic University,2012,29(4):257-265(in Chinese)
[17]张培远,刘中良.矩形微生物燃料电池性能的分析[J].微生物学通报,2011,38(6):832-838 Zhang Peiyuan,Liu Zhongliang.Analysis on a rectangular microbial fuel cell performance[J].Microbiology China,2011,38(6):832-838(in Chinese)
[18]连静,冯雅丽,李浩然,等.直接微生物燃料电池的构建与初步研究[J].过程工程学报,2006,6(3):408-412 Lian Jing,Feng Yali,Li Haoran,et al.Construction and preliminary studies on the directmicrobial fuel cell[J].The Chinese Journal of Process Engineering,2006,6(3):408-412(in Chinese)
[19]梁鹏,范明志,曹效鑫,等.填料型微生物燃料电池产电特性的研究[J].环境科学,2008,29(2):512-517 Liang Peng,Fan Mingzhi,Cao Xiaoxin,et al.Electricity generation using the packing-type microbial fuel cells[J].Environmental Science,2008,29(2):512-517(in Chinese)
[20]Rabaey K,Boon N,Höfte M,et al.Microbial phenazine production enhances electron transfer in biofuel cells[J].Environmental Science and Technology,2005,39(9):3401-3408

