尼古丁及氯化琥珀胆碱对皮肤细胞增殖的影响
杨希苧, 陈汉春
(中南大学 生命科学学院, 湖南 长沙 410013)
0 引 言
吸烟与很多疾病的发生密切相关,烟草中的尼古丁类有害成分可致皮肤松弛[1]。吸烟引起的皮肤松弛表现为毛孔突显、面部轮廓变模糊、皮肤松弛下垂等[2]。尼古丁是烟草植物合成的杂环类水溶性生物碱,俗称烟碱,易透过生物膜和血脑屏障而使人成瘾。人体通过口鼻和支气管黏膜吸收尼古丁后,会出现如心跳加速、呼吸变快、血压升高、精神状况改变等症状。尼古丁的半衰期约为2 h[1]。
尼古丁是乙酰胆碱受体激动剂,经尼古丁型乙酰胆碱受体(nAChR)介导而发挥作用[2-3]。nAChR是一种相对分子质量为290 kDa的蛋白质,最初发现表达于神经肌肉间突触;深入研究表明,整个外周和中枢神经系统以及非神经细胞均表达nAChR。nAChR具有一个特征性的同五聚体环结构跨膜区,环结构的中心为离子通道。已发现αl~αl0、βl~β4、γ、δ和ε等17种nAChR亚单位,它们的组成差异决定离子通道的功能[4]。其中,αl0亚单位不能单独形成功能受体,当其与α9组成型受体共同作用时,可产生强大的乙酰胆碱激发电流,表明αl0亚基可调节α9亚基型受体的生理学特性,两种亚单位共同组成一个功能型受体[4]。电生理学与免疫组化研究表明,人类神经纤维表达的nAChR主要由α3、α5或β4亚基的同五聚体组成。据报道,尼古丁可能通过激活α7胆碱受体而发挥保护神经的作用[5-6]。此外,nAChR的表达并不局限于神经末梢,研究发现皮肤组织也表达nAChR和毒覃碱型乙酰胆碱受体(mAChR);人胚皮肤成纤维细胞(Human Embryonic Fibroblast, hEF)表达特异性nAChR[7]。
皮肤松弛是常见的皮肤衰老现象,可由自然因素和/或非自然因素引起[8]。大量研究证实,皮肤松弛始于皮肤真皮的成纤维细胞特有的生物学特性改变;皮肤皱褶、皮肤变薄与真皮成纤维细胞生长异常密切相关。皮肤老化程度与吸烟量及吸烟持续时间正相关[9]。尼古丁能改变成纤维细胞的组织重塑功能及nAChRs的结构和功能,从而引起皮肤细胞外基质中特定成分减少[10]。香烟烟雾提取物和尼古丁对hEF的损伤效应的研究[11]结果表明,香烟烟雾提取物可致hEF呈典型的损伤细胞形态,并抑制细胞生长和诱导细胞G1、G2期停滞[12];但是,微量尼古丁(低于1 mmol/L)则可促进培养的hEF增殖。所以,目前尼古丁对hEF增殖的作用尚未明确。
琥珀胆碱是尼古丁受体阻断剂,它能与尼古丁受体结合而使尼古丁丧失对nAChR的刺激效应,是一种除极性肌松药[13],琥珀胆碱可阻断神经细胞中nAChR表达而用作止痛药和麻醉辅助剂。由琥珀酰氯和氯化胆碱在一定条件下反应制取的氯化琥珀胆碱(Succinylcholine Chloride, SC)注射液是医学上常用的一种骨骼肌松弛剂[14]。然而,尚未证明SC能阻断皮肤中nAChR的表达而缓解尼古丁的皮肤损伤作用。
本研究经分别分析尼古丁及其受体阻断剂——氯化琥珀胆碱对人胚皮肤成纤维细胞增殖的影响,旨在发现吸烟对皮肤成纤维细胞的损伤效应及氯化琥珀胆碱的潜在效能,为深入研究氯化琥珀胆碱的皮肤保护效应及其美容功效提供实验依据。
1 材料与方法
1.1 细胞培养
采用补充10%新生牛血清的DMEM培养基培养hEF(细胞株取自医学遗传学国家重点实验室),胰蛋白酶消化传代,取对数生长期细胞、以10 000个/100 μL接种96孔板,分别加入不同浓度的尼古丁和氯化琥珀胆碱培养。
1.2 细胞增殖分析
本研究采用的噻唑蓝 (3-(4,5-dimethylthiazol-2-yl)2,5-diphenyl tetrazolium bromide,MTT)比色法是常用的检测细胞存活的方法[15]。其检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为非水溶性的蓝紫色结晶甲臜(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(Dimethyl Sulfoxide,DMSO)能溶解细胞中的甲瓒,用酶联免疫检测仪在490 nm波长处测定其吸光度,可间接反映活细胞数量[16]。在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。该方法已被广泛用于一些生物活性因子的活性检测、大规模的抗肿瘤药物筛选、细胞毒性试验以及肿瘤放射敏感性测定等,具有灵敏度高、经济适用等特点。
细胞种板后,设置正常生长的细胞为对照组,其余组按浓度添加:① 尼古丁(昆明伊普瑞斯科技有限公司)(共8个浓度):10-8、10-7、10-6、10-5、10-4、10-3、10-2和10-1mol/L;② SC(上海旭东海普药业有限公司)(共8个浓度):10-8、10-7、10-6、10-5、10-4、10-3、10-2和10-1mol/L;③ 10-3mol/L尼古丁和SC(共5个浓度):10-6、10-5、10-4、10-3和10-2mol/L;④ 10-7mol/L尼古丁和SC(共5个浓度):10-6、10-5、10-4、10-3和10-2mol/L;继续培养24 h。吸除每孔液体并用磷酸盐缓冲液(Phosphate Buffered Solution,PBS)洗细胞一遍,再加入100 μL PBS和20 μL 0.5%MTT溶液,作用4 h。吸除每孔液体,各加入150 μL DMSO,震荡混匀10 min。以对照组调零测A490;计算细胞存活率(实验组A值 / 对照组A值)。
1.3 数据分析
2 结 果
2.1 尼古丁对皮肤成纤维细胞增殖的影响
与对照组比较,hEF在10-8~10-6mol/L尼古丁作用下,存活率升高,说明该浓度尼古丁对hEF增殖具有促进作用;10-5~10-1mol/L尼古丁作用下,存活率明显降低,说明该浓度尼古丁对hEF增殖具有抑制作用(见图1)。
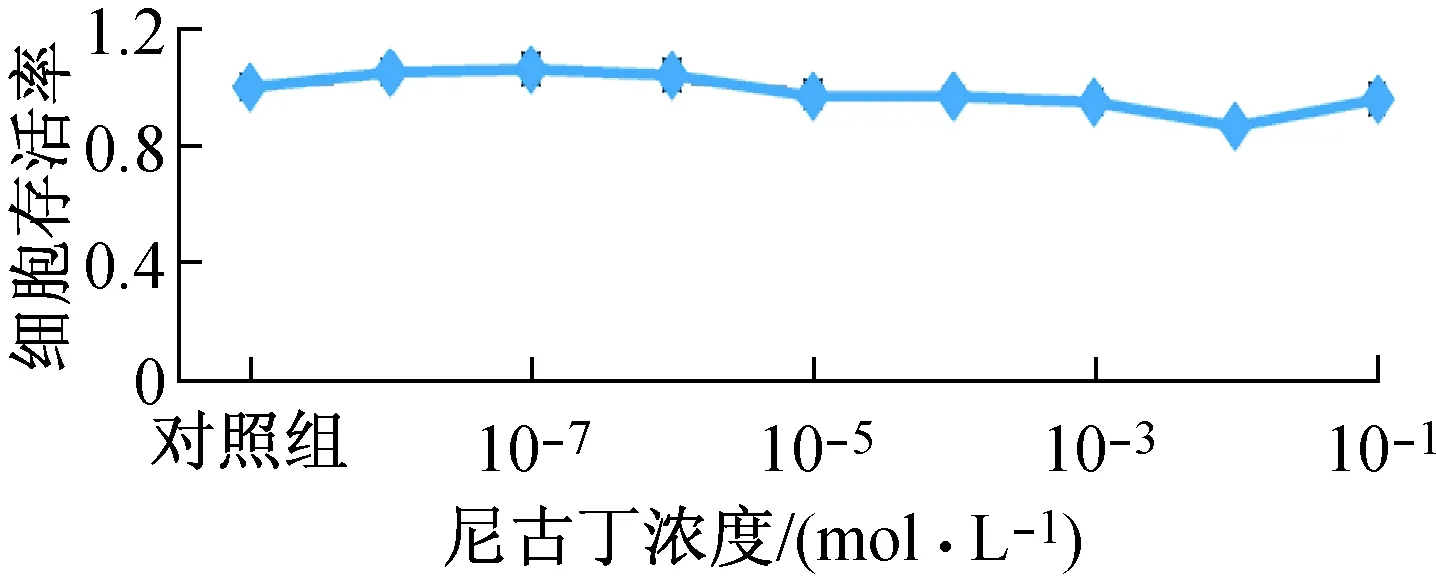
图1 尼古丁浓度作用24 h的hEF存活率
2.2 氯化琥珀胆碱对皮肤成纤维细胞增殖的影响
仅10-8mol/L SC作用后hEF存活率远低于对照组存活率,其余浓度SC作用后细胞存活率均与对照组无显著差异。说明10-8mol/L SC对hEF增殖具有抑制作用;10-7~10-1mol/L SC对hEF增殖的影响不明显,仅呈现随着浓度增高其细胞增殖的促进作用增强的趋势(见图2)。
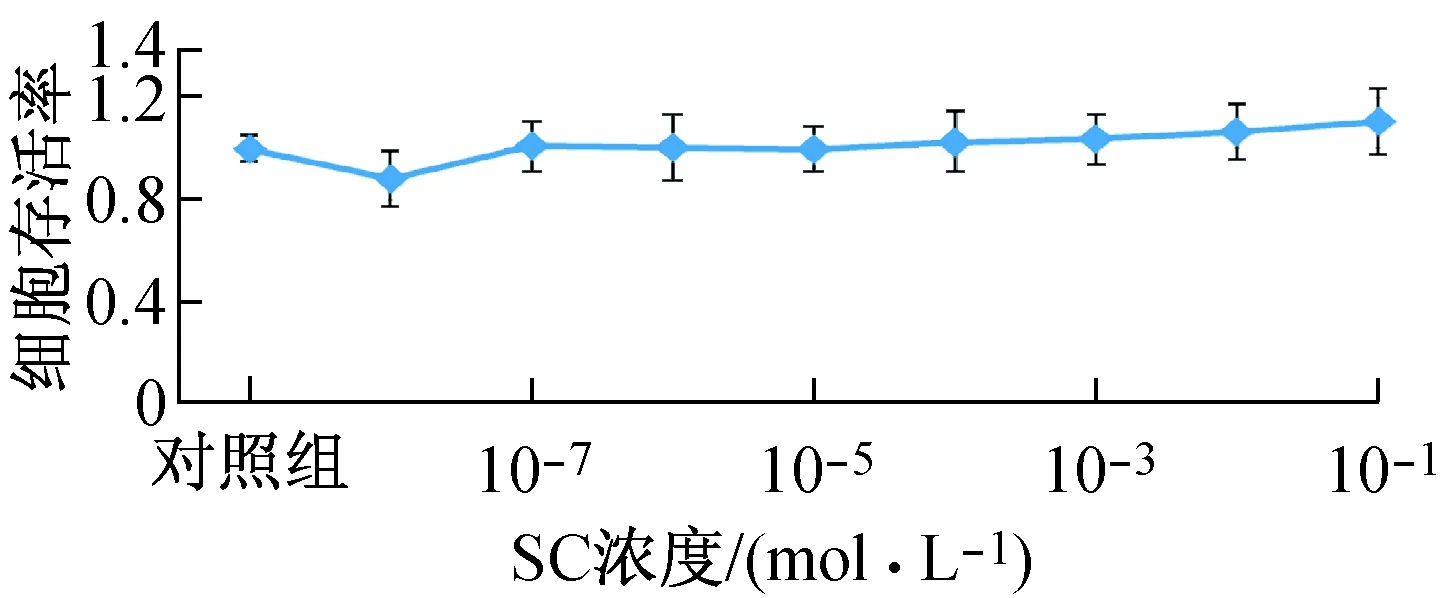
图2 SC浓度作用24 h的hEF存活率
2.3 氯化琥珀胆碱对尼古丁作用的影响
10-6~10-2mol/L SC与10-3mol/L尼古丁共同作用于hEF,仅10-4mol/L SC共同作用时细胞存活率大于10-3mol/L尼古丁单独作用时的存活率。说明10-4mol/L SC能降低尼古丁对hEF增殖的抑制作用,而其余浓度SC却与尼古丁协同抑制hEF增殖(见图3)。10-6~10-2mol/L SC与10-7mol/L尼古丁共同作用于hEF,细胞存活率均小于10-7mol/L尼古丁单独作用时的存活率,说明SC能减弱尼古丁对hEF增殖的促进作用(见图4)。
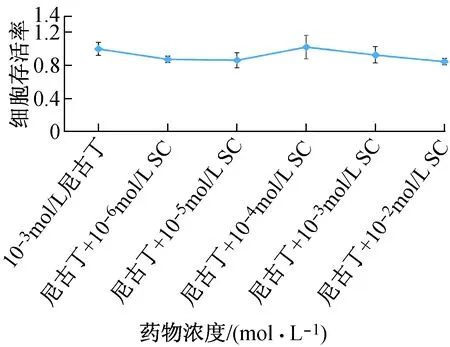
图3 不同浓度SC及10-3mol/L尼古丁作用24 h的hEF存活率
3 讨 论
本研究采用MTT法依次检测了尼古丁和SC对hEF增殖的影响,以及SC对尼古丁作用的影响。结果表明,高浓度尼古丁抑制hEF增殖;而低浓度尼古丁则促进细胞增殖,这种趋势与钱革等[11]采用尼古丁原代培养hEF以观察其损伤效应的结果相符。临床上用于维持肌松的SC浓度为(7.55~1.51) mmol/L,本实验证明该浓度SC对hEF增殖无不良影响,因此可以作为尼古丁受体阻断剂进行其对尼古丁作用的检测。10-6~10-2mol/L SC能减弱尼古丁对hEF增殖的作用(抑制或促进)。其中,10-4mol/L SC能明显缓解尼古丁对hEF增殖的抑制作用,且该浓度处于临床上使用SC的浓度范围内,提示了10-4mol/L SC可以用于缓解皮肤松弛。
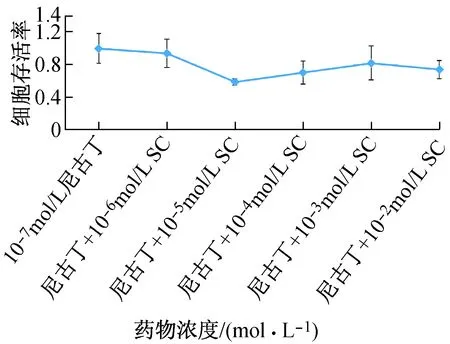
图4 不同浓度SC及10-7mol/L尼古丁作用24 h的hEF存活率
在进一步分析SC对尼古丁作用的影响的实验中,可加入正常培养的细胞作为对照组,以估测SC对尼古丁作用的强度。检测SC是否能逆转尼古丁的抑制作用而使hEF增殖由受损变为受益,或SC仅缓解尼古丁的抑制作用但仍使hEF增殖受损;检测SC是否虽削弱尼古丁的促进作用但仍使hEF增殖受益,或SC能逆转尼古丁的促进作用而导致hEF增殖受损。基于已有及后期成果,SC有望成为具有抗皮肤松弛的香烟添加剂成分,在特定浓度下发挥缓解尼古丁损伤皮肤作用的功效,为减少吸烟对人体皮肤的损伤提供新思路。
[1] Ortiz A, Grando S A. Smoking and the skin [J]. International Journal of Dermatology, 2012, 51(3): 250-262.
[2] Baker L K, Mao D, Chi H,etal. Intermittent nicotine exposure upregulates nAChRs in VTA dopamine neurons and sensitises locomotor responding to the drug [J]. European Journal of Neuroscience, 2013, 37(6): 1004-1011.
[3] Hammer T R, Fischer K, Mueller M,etal. Effects of cigarette smoke residues from textiles on fibroblasts, neurocytes and zebrafish embryos and nicotine permeation through human skin [J]. International Journal of Hygiene and Environmental Health, 2011, 214: 384-391.
[4] Holtman J R, Dwoskin L P, Dowell C,etal. The novel small molecule α9 α10 nicotinic acetylcholine receptor antagonist ZZ-204G is analgesic [J]. European Journal of Pharmacology, 2011, 670: 500-508.
[5] Costa R, Motta E M, Manjavachi M N,etal. Activation of the alpha-7 nicotinic acetylcholine receptor (α7 nAchR) reverses referred mechanical hyperalgesia induced by colonic inflammation in mice [J]. Neuropharmacology, 2012, 63(5): 798-805.
[6] Akinori A, Yuki T, Toshiaki K,etal. Mechanisms of Neuroprotective Effects of Nicotine and Acetylcholinesterase Inhibitors: Role of α4 and α7 Receptors in Neuroprotection [J]. Journal of Molecular Neuroscience, 2010, 40(1-2): 211-216.
[7] Grando S A, Horton R M, Pereira E F,etal. A nicotinic acetylcholine receptor regulating cell adhesion and motility is expressed in human keratinocytes [J]. Journal of Investigative Dermatology, 1995, 105(6): 774-781.
[8] Gill J F, Yu S S, Neuhaus I M. Tobacco smoking and dermatologic surgery [J]. Journal of the American Academy of Dermatology, 2013(68): 167-172.
[9] Ishiwata T, Seyama K, Hirao T,etal. Improvement in skin color achieved by smoking cessation [J]. International Journal of Cosmetic Science, 2013, 35(2): 191-195.
[10] Choi J E, Kim J N, Jeong S H,etal. Nicotine induces the expression of early growth response-1 in human skin dermal fibroblasts [J]. International Journal of Dermatology, 2010, 49(2): 158-161.
[11] 钱 革, 蒋法兴, 陶小华, 等. 尼古丁与皮肤健康 [J]. 国际皮肤性病学杂志, 2007, 33(6): 366-368.
QIAN Ge, JIANG Fa-xing, TAO Xiao-hua,etal. Nicotine and skin health [J]. International Journal of Dermatology and Venereology, 2007, 33(6): 366-368.
[12] 钱 革, 蒋法兴, 周武庆, 等. 香烟烟雾提取物致体外皮肤成纤维细胞损伤和对胶原合成的影响 [J]. 中国康复理论与实践, 2007, 13(5):440-443.
QIAN Ge, JIANG Fa-xing, ZHOU Wu-qing,etal. Effect of cigaratte smoke on cell biological activities and collagen synthesis of primary culture of skin fibroblast [J]. Chinese Journal of Rehabilitation Theory and Practice, 2007, 13(5):440-443.
[13] Kawabata H, Kanekura T, Gushi A,etal. Successful treatment of digital ulceration in Buerger’s disease with nicotine chewing gum [J]. British Journal of Dermatology, 1999, 140(1):187-188.
[14] 郑洪国, 宁张磊, 梁立娜, 等. 离子色谱法检测氯化琥珀胆碱注射液中的氯化胆碱的含量 [J]. 药物分析杂志, 2009, 29(12): 2147-2149.
ZHENG Hong-guo, NING Zhang-lei, LIANG Li-na,etal. Determination of choline chloride in succinylcholine chloride injection by iron chromatography [J]. Chinese Journal of Pharmaceutical Analysis, 2009, 29(12): 2147-2149.
[15] Ferrari M, Fornasiero M C, Isetta A M. MTT colorimetric assay for testing macrophage cytotoxic activity in vitro [J]. Journal of Immunological Methods, 1990, 131(2): 165-172.
[16] Gerlier D, Thomasset N. Use of MTT assay to measure cell activation [J]. Journal of Immunological Methods, 1986, 94(1-2): 57-63.

