缺血后处理抑制TLR2信号通路对大鼠缺血再灌注脑损伤的保护作用
王伯玉 陆 斌 罗毅男 葛鹏飞 周 畅
(吉林大学第一医院神经外科,吉林 长春 130021)
缺血后再灌注造成的脑损伤已经成为影响闭塞血管-血管再生预后的重要因素〔1〕。动物实验发现,局灶性缺血和再灌注造成脑损伤的病理因素很多,如氧化应激、内质网应激和蛋白质聚集〔2,3〕。然而,越来越多的证据表明,炎症反应是决定脑缺血后果的关键因素,抑制神经炎症因子已经成为保护脑损伤的治疗靶点。
1 材料与方法
1.1动物 成年雄性大鼠(n=45; 体重280~300 g; 7~8周龄,由吉林大学实验动物中心提供,饲养温度控制在22℃~25℃,12 h的光/暗周期处理,自由进食进水。所有动物操作获得吉林大学动物实验伦理委员会的批准。根据实验室动物护理和使用指导原则,尽可能减少在本研究中动物所遭受的痛苦和用于实验的动物数量〔4〕。
1.2缺血后处理方案 将大鼠随机分成假手术组、局灶性缺血组和缺血后处理组(每组15只)。局灶性缺血组和缺血后处理组的大鼠按照描述进行2 h的局灶性脑缺血处理,局灶性缺血组大鼠不进行进一步的再灌注中断处理。缺血后处理组大鼠接受2 h的局灶性缺血处理后,进行3次30 s/30 s的再灌注/再阻塞处理。假手术组大鼠接受除大脑中动脉闭塞外的其他相同操作。
1.3梗死体积测量 再灌注24 h后,由操作人员(研究外人员)在每组中随机选出5只大鼠,用过量的戊巴比妥注射处死大鼠,快速剥离大脑。梗死体积的测量需借助TTC染色 (TTC; Sigma-Aldrich, St. Louis, MO, USA)。将大脑切成2 mm厚的冠状切片,4%多聚甲醛过夜浸泡,用1%TTC溶液37℃染色30 min。用动物全脑组织测量大脑梗死的比例〔5〕。
1.4神经系统评估 大脑中动脉闭塞24 h后,按照下列评分系统对所有小组进行神经系统评估,分为0 分(没有明显病态)、1分(尾巴止停时侧前肢弯曲)、2分(牵拉尾巴时侧前肢抓地力降低)、3分(多方向自发活动;只有在牵拉尾巴时发生侧向盘旋)、4分(自发侧向盘旋)、5分(麻醉复苏后死亡) 。每组5只大鼠。
1.5检测指标 局灶性缺血处理24 h后,剥离大脑,RT-PCR 测定TNF-α和IL-1β mRNA 表达量。用特异性酶联免疫吸附试验(ELISA)试剂盒(Thermo Scientific Company, Rockford, IL, USA)测量IL-1β和TNF-α蛋白浓度。所有标准品和样本均重复4次,每次3个重复。
1.6蛋白质免疫印迹 将缺血半影区皮质组织均匀分布到冰冷的缓冲液中,匀浆离心(10 000r/min,20 min,4℃),并测量上清液中的蛋白质浓度。
用12% SDS-PAGE 进行蛋白质免疫印迹分析。每个实验组有四个样本(来自不同大鼠)用于统计学分析。电泳后,将蛋白质转移到PVDF膜上。膜上有抗-TLR2 (1∶1 000,Abcam, Cambridge, MA, USA)的探针。室温下,将膜用抗兔二抗(1∶50 000)孵育1 h。ECL检测显影,用Kodak 1D凝胶分析软件对蛋白质条带的光密度进行定量。假手术组的光密度值作为基线参考值,每个实验组与假手术组的比值作为变化值。
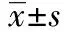
2 结 果
大脑中动脉闭塞所造成的脑缺血成功诱导局灶性缺血组和缺血后处理组中所有大鼠的梗死。与局灶性缺血组相比,缺血后处理组的梗死体积和神经系统评分均显著降低(P<0.01)。RT-PCR结果显示:与假手术组相比,局灶性缺血组神经炎症因子TNF-α和IL-1β的转录水平均显著升高(P<0.01)。然而,缺血后处理可以显著消除这种效应(P<0.01)。ELISA结果显示:与假手术组相比,局灶性缺血组神经炎症因子TNF-α和IL-1β的表达水平也均显著升高(P<0.01)。缺血后处理会抑制由缺血/再灌注造成的TNF-α和IL-1β表达增加(P< 0.01)。 蛋白质免疫印迹结果显示:缺血后处理会显著限制TLR2(促神经炎症细胞因子TNF-α和IL-1β的上游调控因子)的表达。
3 讨 论
目前的研究表明,3次30 s的再灌注/再阻塞是一种有效的缺血后处理方法,它会降低脑梗死体积并改善神经系统功能。此外,缺血后处理会抑制由局灶性缺血/再灌注造成促炎症细胞因子TNF-α和IL-1β转录和表达水平提高。同时,缺血后处理也会降低TLR2的表达水平。
脑损伤是造成缺血/再灌注后神经系统障碍的主要因素之一〔6〕。另一方面,减少脑梗死对局灶性缺血/再灌注处理大鼠的神经系统功能有益。这些报道表明,对受伤脑组织的保护有助于改善神经系统功能。尽管已经提出了氧化应激和钙离子超载这些理论来解释缺血/再灌注后的脑损伤,但是目前认为炎症反应是造成脑损伤的关键因素之一〔7〕。在这项研究中发现,缺血后处理可以改善经局灶性缺血/再灌注处理过大鼠的神经机能障碍,并会降低脑梗死的体积。这表明缺血后处理所造成神经系统功能的改善与损伤脑组织的减少有关。
尽管没有直接的研究表明细胞因子 IL-1β和TNF-α是TLR2的调控靶点,但是先前研究表明TLR2也参与由大脑缺血/再灌注所造成的炎症反应。在本研究中,缺血后处理会降低损伤脑组织中的TLR2水平,这可能有助于缺血后处理对脑损伤的保护作用。
总之,缺血后处理会显著降低由局灶性缺血/再灌注造成的脑梗死体积并改善其神经机能障碍。缺血后处理的保护作用与TLR2, TNF-α和IL-1β的抑制显著相关。同时,抗炎症作用可以作为预防由缺血/再灌注所造成脑损伤的新研究靶点。
4 参考文献
1Tjoumakaris SI, Jabbour PM, Rosenwasser RH.Neuroendovascular management of acute ischaemic stroke〔J〕. Neurosurg Clin N Am, 2009; 20:419- 29.
2Buch P, Patel V, Ranpariya V,etal. Neuroprotective activity of Cymbopogon martinii against cerebral ischemia/reperfusion-induced oxidative stress in rats〔J〕. J Ethnopharmacol, 2012;142:35-40.
3Osada N, Kosuge Y, Ishige K,etal. Characterization of neuronal and astroglial responses to ER stress in the hippocampal CA1 area in mice following transient forebrain ischemia〔J〕.Neurochem Int, 2010;57:1-7.
4National research council(US) committee for the update of the guide for care and use of laboratory animals.Guide for the care and use of laboratory animals〔M〕. 8th edn. Washington (DC): National Academies Press (USA), 2011:32-5.
5Li ZY, Liu B, Yu J,etal. Ischaemic postconditioning rescues brain injury caused by focal ischaemia/reperfusion via attenuation of protein oxidization〔J〕. J Int Med Res, 2012;40:954-66.
6Guo RB, Wang GF, Zhao AP,etal. Paeoniflorin protects against ischemia-induced brain damages in rats via inhibiting MAPKs/NF-κB-mediated inflammatory responses〔J〕. PLoS One, 2012;7:e49701.
7Wang Y, Ge P, Zhu Y. TLR2 and TLR4 in the brain injury caused by cerebral ischemia and reperfusion〔J〕. Mediators Inflamm 2013;2013:124614. doi: 10.1155/2013/124614.

