烟草青枯病生防菌YH-22抗病机制的初步研究
杨 欢,余 君,王昌军,李进平,施河丽,谭 军,李锡宏,王 瑞,徐迪红,陈守文*
(1.华中农业大学农业微生物国家重点实验室,武汉 430070;2.湖北省烟草科研所,武汉 430030;3.湖北省烟草公司恩施州公司科技中心,湖北 恩施 445000)
烟草是一种重要的农业经济作物,在我国多个地方都有种植区域,然而一些细菌性、真菌性与病毒病害等给烟叶生产带来了巨大的损失,严重制约了高效农业的发展。据不完全统计,烟草花叶病、赤星病、黑胫病、青枯病和根结线虫病5种烟草主要病害造成的产量损失为4.8亿多公斤,产值损失高达 15亿多元[1]。烟草青枯病是由茄科雷尔氏菌(Ralstonia solanacearum)引起的一种土传细菌性病害,可浸染烟草、马铃薯、番茄、茄子、辣椒等54个科的450多种植物[2],以危害根、茎为主[3],是典型的维管束病害。目前,青枯病防治措施主要有农业防治和化学防治等。其中,抗病品种连作会引起作物抗性衰退[4],防治效果差,而化学农药残留带来了严重的环境污染。相对于传统防治方法而言,生物防治因其环境友好型、防治效果显著等特点,近年来成为植物病害防治的研究热点。生物防治是利用对土传病害有拮抗效果的微生物或其代谢物,抑制病原微生物的生长,达到防治土传病害发生的目的[5],是一种环保无公害的方法。
微生物生防机制主要包括竞争生态位点和营养、产生抗菌物质、诱导抗性和促进植物生长等。对于一个理想的生防菌而言,既要具有产生有效拮抗病原菌因子的能力,又要很好的定殖于植株体内或根部以占据有利的生态位[6]。因此想要获得较好的病害防效,必须考虑生防菌株在植物体内的定殖能力。王静等[7]、张秀玉等[8]从烟草根际土壤分离到一株枯草芽胞杆菌SH7,分泌的抗菌蛋白对青枯病菌具有良好的抑制作用。
本研究供试生防菌解淀粉芽胞杆菌(Bacillus amyloliquefaciens)YH-22分离筛选自恩施州烤烟种植区域的健康烟叶,对烟草青枯病有一定防效。以利福平抗性诱导,获得利福平抗性株,研究了该菌株在烟草根际土壤和组织体内的定殖情况。为了进一步探讨该菌株的抗病机制,对其抗菌物质的理化性质进行了初步研究。
1 材料与方法
1.1 菌种及烟草
生防菌株解淀粉芽胞杆菌YH-22(筛选自健康烟草叶片);烟草青枯病病原菌茄科雷尔氏菌9-2、烟草K326均由湖北省烟草科学研究院提供。
1.2 培养基
NA液体培养基:葡萄糖20 g,蛋白胨5 g,牛肉膏3 g,1000 mL水,pH 7.2~7.4;TTC固体培养基:葡萄糖20 g,蛋白胨5 g,牛肉膏3 g,红四氮唑0.10 g,1000 mL水,琼脂粉18.0,pH 7.2~7.4;红四氮唑溶液(TTC):0.10 g红四氮唑溶于10 mL蒸馏水配成母液,使用前用灭菌的0.22 μm无机滤膜过滤,100倍稀释用;LB液体培养基:蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,1000 mL水,pH 7.0~7.5,固体培养基加入1.8%琼脂;发酵培养基:玉米淀粉 15 g,豆粕 50 g,K2HPO4·3H2O 1.0 g,MgSO4·7H2O 0.75 g,MnSO4·H2O 0.01 g,1000 mL水,pH 7.5。
1.3 利福平抗性诱导
先将筛选的拮抗菌株YH-22按2%的接种量接入含有5 μg/mL利福平的LB中,37 ℃、180 r/min振荡培养24 h,然后接入含10 μg/mL利福平的LB中,以此逐级转接于含 20、50、100、150、200、300、400 μg/mL利福平的LB中进行抗性诱导。同时验证抗400 μg/mL利福平菌株抗利福平能力和抗青枯病菌活性的稳定性。
1.4 盆栽定殖试验
2012年10月烟草育苗,12月份将2个月苗龄的烟草移入盆钵中,盆栽土壤使用前每隔12 h间歇灭菌1次,每次121 ℃、30 min,然后80 ℃烘干,共灭菌、烘干3次。盆钵置于温室中,温室培养温度为28~30 ℃,相对湿度为65%,16 h光照(白天)、8 h黑暗(晚上)。12月中旬,将菌株YH-22对烟苗进行灌根100 mL(接菌浓度为107CFU/mL),分别于灌根后第4、16、23、30、60天分别取样(根际土壤、根围土壤、根、茎)检测拮抗菌的定殖情况:采用LB抗性平板,利福平浓度为100 μg/mL。每个处理做3盆,3次重复。取10 g土样于90 mL无菌生理盐水,做系列稀释10-3、10-4、10-5,同时分别称取20 g根围土壤,风干后测量其pH;根(茎)冲洗干净后风干,进行表面消毒(75%无水乙醇浸泡10 s,10% NaClO浸泡5 min,无菌生理盐水洗涤 3次),于灭菌研钵中加适量水研磨成组织液后稀释涂布于 LB抗性平板,37 ℃培养箱倒置培养12~24 h,记录菌落数。
1.5 平板对峙实验
烟草青枯病病原菌茄科雷尔氏菌接入NA液体培养基中,30 ℃、180 r/min振荡培养12~16 h,以5%体积比加入冷却至60 ℃左右的TTC固体培养基得到含菌培养基;拮抗菌YH-22接入LB液体培养基,37 ℃、180 r/min振荡培养10~12 h后转接于发酵培养基,发酵48 h,8000 r/min离心15 min收集上清。在含菌培养基中打孔,每孔加入50 μL检测液,检测其抗烟草青枯病原菌活性。
1.6 抗菌物质理化性质初步研究
有机溶剂溶解性[9]:将发酵液离心上清分别与氯仿、乙酸乙酯等量混合后震荡 1 h,静置萃取30 min后,分别取50 μL萃取相和萃余相加入含菌TTC平板的孔中,检测抗菌活性。
热稳定性[10]:YH-22的36 h的发酵液离心上清除菌后,分别在80 ℃、110 ℃、115 ℃、121 ℃处理30 min,放置至室温,0.22 μm滤膜过滤除菌,测定对烟草青枯病原菌的拮抗活性。
酸碱稳定性[11]:用 3 mol/L盐酸或 NaOH将YH-22发酵液离心上清pH分别调至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,置于4 ℃冰箱24 h,然后回调pH至7.0左右,0.22 μm滤膜过滤除菌,分别测定滤液对烟草青枯病原菌的拮抗活性。
酶的耐受性[12-13]:将YH-22发酵液离心上清分别加入1 mg/L的中性蛋白酶、胰蛋白酶和胃蛋白酶,置于37 ℃水浴保温1 h后,80 ℃水浴3 min终止反应,0.22 μm滤膜过滤除菌,分别测定滤液对烟草青枯病原菌的拮抗活性。
紫外线稳定性[14]:将YH-22发酵液离心上清置于紫外灯(8 w)下照射30 min,0.22 μm滤膜过滤除菌,后测定滤液对烟草青枯病原菌的拮抗活性。酸沉淀、排油特性、液滴坍塌性具体方法均见参考文献[15]。
1.7 统计分析方法
抗菌物质理化性质的实验数据结果采用SPSS18.0软件的 Duncan检验进行显著差异性(p<0.05)分析。
2 结 果
2.1 利福平抗性诱导
将菌株YH-22逐级接入含有5、10、25、50、100、200、300、400 μg/mL的LB液体培养基中,37 ℃、180 r/min振荡培养12~24 h,最终获得了抗400 μg/mL利福平的菌株,传代10代后,其抗菌作用与原始菌株接近,利福平抗性能力和第一代抗性诱导菌株保持一样。
2.2 盆栽定殖能力检测
将抗400 μg/mL利福平的抗性菌株YH-22接入LB液体培养基中,37 ℃、180 r/min振荡培养12~16 h得种子液,以2%接种量接入发酵培养基,相同培养条件下培养24 h,得菌悬液,用灌根法接种于团棵期的烟草K326植株根部,分别在灌根接种后的第 0、4、16、23、30、60天取样检测 YH-22的存活量,其生长动态结果见表1。
接种后第4天,根和茎均未检测到菌株。第16天,根里开始检测到菌株,后期菌数基本保持稳定,维持在103CFU/g鲜质量。在第23天,茎里开始检测到菌株。第 30天,根和茎中拮抗菌大增,分别增加了4.0倍和6.8倍,说明烟草正处于旺长期,合成了大量营养物质,为定殖的拮抗菌提供了生长繁殖所需的营养来源。第 60天,根和茎的菌株数量锐减,分别降低了70.0%和98.4%,说明烟草趋于成熟,合成的营养物质较少,使得拮抗菌株因缺少营养来源而繁殖力降低。而土壤中拮抗菌的菌量保持在105CFU/g土壤,从第4~30天,拮抗菌株数量呈现增长的趋势,第60天,根际土壤和根围土壤的菌数分别降低到第30天的58.5%和82.2%,这和植株中定殖的拮抗菌数量的变化相似。植株中菌量为102~103CFU/g组织,菌数并不高,可能原因是拮抗菌灌根接种浓度(107CFU/mL,100 mL)较低,这与易有金[16]研究中菌株在107CFU/mL接种时在烟草体内未被检测到的结果相类似。

表1 YH-22菌株在烟草K326上的定殖能力检测Table 1 The detection of the colonization ability of strain YH-22 in tobacco K326
2.3 抗菌物部分理化性质
2.3.1 有机溶剂溶解性 用氯仿、乙酸乙酯与发酵液离心上清振荡混合1 h后静置萃取30 min后,分别检测萃取相和萃余相的抗菌活性。萃取液均无抗菌活性,萃余相均有抗菌活性,且萃取相的抑菌活性和未经有机溶剂处理的上清液相差不大,说明该抗菌物质为水溶性物质而不溶于有机溶剂氯仿和乙酸乙酯[13],结果如图1所示。

图1 抗菌物质的有机溶剂溶解性Fig.1 The antibactiral substances solubility in organic solvent
2.3.2 稳定性 将发酵离心上清过滤除菌后,分别经不同温度、pH、酶和紫外线处理,放置至室温,测定青枯病菌拮抗活性,结果如图2所示。图 2A中,在80 ℃、110 ℃、115 ℃、121 ℃处理30 min后,活性分别保留为71.0%、33.8%、9.7%、2.7%,说明该拮抗活性组分具有一定的耐热性;图2B中,抗菌物质在pH 4~10下稳定,pH 8时活性最高,抑菌圈为6.50 mm;图2C中,抗菌物质经中性蛋白酶、胰蛋白酶和胃蛋白酶处理后,活性分别保留有60.3%、65.7%和95.6%,前二者酶处理活性有所降低,说明该抗菌物质中含有蛋白成分,这和齐爱勇等[9]的研究结果类似,他们从枯草芽胞杆菌B21的发酵离心上清中分离纯化到43.0 KD的抗菌蛋白,对胰蛋白酶和蛋白酶K部分敏感;图2D中,上清经紫外线照射后,活性保留93.0%。

图2 抗菌物质的稳定性Fig.2 Stability of antibactiral substances by different treatments
2.3.3 酸沉淀 将发酵液离心上清在 pH 2.0的条件下进行沉淀,离心收集沉淀,用甲醇溶解,检测甲醇萃取液的拮抗活性,发现酸沉淀后的上清和甲醇本身没有拮抗活性,而甲醇溶解的沉淀拮抗活性较强,结果如图3所示,该抗菌物质大部分能在pH 2.0沉淀下来,这是因为抗菌蛋白或脂肽类物质在强酸条件下会变性而形成絮状物沉积下来,说明该抗菌物质为蛋白类或脂肽类物质,而甲醇溶解后仍有很强的抑菌活性,而脂肽可以溶解于甲醇,从而进一步说明抗菌物质中含有脂肽类物质。
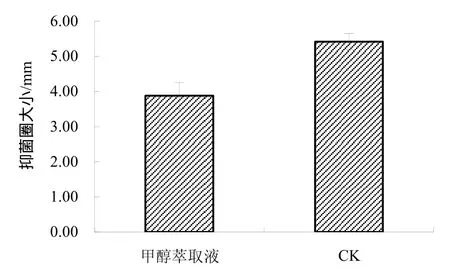
图3 酸沉淀抑菌活性Fig.3 Bacteriostatic activity of acid precipitation
2.3.4 表面活性剂特性 枯草芽胞杆菌分泌的抗菌脂肽surfactin是高活性的生物表面活性剂[17],具有溶血、排油、液滴坍塌、凝聚特性[15],实验中将发酵液滴加到油膜中心,发现油膜迅速被打散成一个个圆圈,说明该活性物质具有排油的特性;另外,将发酵液滴在parafilm膜上,液滴慢慢坍塌,而不是保持球形结构,说明该抗菌物质具有使液滴坍塌的特性,这进一步表明该抗菌活性物质含有脂肽类物质。
3 讨 论
生防菌只有在植物体内占据很好的生态位,才有可能发挥更好的防效。而生防菌侵入植物体内的方式和其定殖部位是决定生防菌施用方式和施用时间的关键因素。可通过构建工程菌株,如荧光蛋白基因标记,对生防菌株在植株上的定殖进行实时跟踪,研究抗病菌株发挥生防作用的部位以及菌株在植株中的消长动态,以确定生防机制属于拮抗、竞争、寄生还是诱导植株系统抗性中的哪一种[18],为生防菌剂的施用提供理论指导。
芽胞杆菌抗菌物质主要有蛋白质和脂肽两大类,通过对抗菌物质理化性质的研究,可以初步确定抗菌物质的种类,进而采取相应的分离纯化的方法,对抗菌物质的结构进行进一步分析。可采用硫酸铵沉淀和酸沉淀进行纯化,将纯化的样品做质谱分析,以确定该拮抗物质的种类。如果是脂肽类,可采用酸沉淀,用甲醇抽提,将抽提液进行HPLC,通过标准样品(如iturin、surfactin、fengycin)进行含量测定;如果是蛋白类,可用硫酸铵逐级沉淀,磷酸缓冲液溶解,将溶解液透析除盐后进行SDS-PAGE,确定蛋白种类和大小,并测定所分离蛋白粗提物的抗菌能力,选择较强抗菌能力的蛋白拮抗物进行氨基酸序列分析、基因克隆或基因导入表达以确定蛋白质的结构。
4 结 论
在根际土壤、根、茎先后检测到了菌株YH-22,说明菌株 YH-22在烟草组织内具有一定的定殖能力。后期可以考虑构建工程菌株,如荧光蛋白基因标记,研究抗病菌株在植株具体部位中的消长动态,为生防菌剂的施用提供理论指导。
解淀粉芽孢杆菌 YH-22对青枯病菌具有抗性的物质,对胰蛋白酶和中性蛋白酶具有一定的耐受性,能耐受紫外线和胃蛋白酶,不溶于氯仿和乙酸乙酯,具有排油和使液滴坍塌的表面活性剂特性,具有一定的耐热性,可初步确定该抗菌活性物质是蛋白和脂肽的混合物。至于其结构的鉴定,要进一步对其进行分离纯化,如硫铵沉淀、酸沉淀、HPLC、SDS-PAG等;通过氨基酸序列分析、基因克隆或基因导入表达等方法确定其结构。
[1]陈瑞泰,朱贤朝,王智发,等.全国16个主产烟省(区)烟草侵染性病害调研报告[J].中国烟草科学,1997,18(4):1-7.
[2]Wicker E, Grassart L, Coranson-Beaudu R, et al.Ralstonia solanacearumStrains from Martinique (French West Indies) exhibiting a new pathogenic potential[J].Applied and Environmental Microbiology, 2007, 73(21):6790-6801.
[3]周训军,王静,杨玉文,等.烟草青枯病研究进展[J].微生物学通报,2012,39(10):1479-1486.
[4]方树民,顾钢,纪成灿,等.烟草青枯菌致病型及分布的研究[J].中国烟草学报,2002,8(3):40-43.
[5]钱风光.高效生防菌枯草芽胞杆菌的筛选及其发酵工艺优化[D].武汉:华中农业大学,2008.
[6]Verma S C, Ladha J K, Tripathi A K.Evaluation of plant growth promoting and colonization ability of endophyticdiazotrophs from deep water rice[J].Journal of Biotechnology, 2001, 91(2): 127-141.
[7]王静,赵廷昌,孔凡玉,等.SH7对烟草青枯病的抑菌、防病作用及其抑菌物质的初步研究[J].中国烟草科学,2007,28(2):41-44.
[8]张秀玉,孔凡玉,王静,等.枯草芽孢杆菌SH7抑菌蛋白的分离纯化及对烟草青枯病菌的抑制作用[J].中国烟草科学,2010,31(1):13-15.
[9]齐爱勇,魏东盛,刘大群.枯草芽孢杆菌B21抗菌蛋白的分离纯化及特性研究[J].河北农业大学学报,2011,34(3):56-59.
[10]郭金鹏,刘晓昌,仝赞华,等.芽孢杆菌HSY-8-1对植物病原真菌的抑制及其抑菌产物特性[J].吉林农业大学学报,2010,32(1):29-33.
[11]安文静.侧孢芽孢杆菌BL-1产抗菌物质发酵条件的研究以及抗菌物质的分离纯化[D].哈尔滨:黑龙江大学,2008.
[12]黄曦,张荣灿,王何健,等.枯草芽孢杆菌ON-6菌株抑制荔枝炭疽菌活性物质的初步研究[J].中国农学通报,2011,27(13):188-193.
[13]任召珍,孙谧,郑媛,等.海洋侧孢短芽孢杆菌 Lh-1株所产多肽R-1性质分析及作用原理探讨[J].海洋科学,2010,34(11):41-45.
[14]Yan X, He L, Song G, et al.Antagonistic bioactivity of endophytic strains isolated from Salvia miltiorrhiza[J].African Journal of Biotechnology, 2011, 10(67):15117-15122.
[15]王启军.枯草芽胞杆菌B6-1产脂肽和聚-γ-谷氨酸及抗几种植物病原菌的研究[D].武汉:华中农业大学,2008.
[16]易有金.烟草内生细菌及其对烟草青枯病的防治作用研究[D].长沙:湖南农业大学,2007.
[17]林文凭.Bacillus subtilisZJU15产生的抗菌肽研究[D].杭州:浙江大学,2010.
[18]程亮,游春平,肖爱萍.拮抗细菌的研究进展[J].江西农业大学学报,2003,25(5):732-737.
