利用猪流行性腹泻病毒S基因真核表达质粒制备多克隆抗体
任晓峰,王雪,高睿泽,董博,李广兴
(东北农业大学动物医学学院,哈尔滨 150030)
REN Xiaofeng,WANG Xue,GAO Ruize,DONG Bo,LI Guangxing(School of Veterinary Medicine,Northeast Agricultural University, Harbin 150030,China)
利用猪流行性腹泻病毒S基因真核表达质粒制备多克隆抗体
任晓峰,王雪,高睿泽,董博,李广兴
(东北农业大学动物医学学院,哈尔滨 150030)
将流行性腹泻病毒(PEDV)S基因的真核表达质粒pVAX1-S作为抗原,免疫BALB/c小鼠制备多克隆抗体。抗体经纯化后,利用间接ELISA、间接免疫荧光、Western Blot方法检测制备多克隆抗体的生物学活性。结果表明,用PEDV S基因真核表达质粒免疫制备的多抗血清抗体效价可达1∶214,该多克隆抗体不仅可以很好地识别PEDV S蛋白,还可以特异性检测到PEDV抗原。研究为PEDV的诊断和S蛋白免疫学特性研究提供试验依据。
猪流行性腹泻病毒;S蛋白;真核表达质粒;多克隆抗体
猪流行性腹泻(Porcine epidemic diarrhea PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的病毒性高度传染性肠道类疾病[1]。PEDV在组成结构、临床症状及对动物体产生损害等方面与TGEV情况相似[1-2]。该病于1971年被英国首次报道并随后蔓延欧洲、亚洲国家[3-7]。比利时Pensaert 1977年分离鉴定毒株(CVL)CV777株[8],我国1980年初次分离PEDV。此病对生长育肥猪感染率为20%~80%,死亡率低,但新生仔猪病死率,高达34%[9]。临床症状表现为脱水、腹泻和严重呕吐,并伴有精神萎靡、食欲不振、体重减轻等,症状轻重与年龄大小呈反比[10]。按照多种冠状病毒S蛋白相似性,S蛋白全长分为(1~735 aa)的S1区和(736~1 383 aa)的S2区[11]。Sun等利用截短后的S基因SID区(696~789 aa)连接原核载体后表达蛋白免疫动物后获得多抗血清,显示此血清可以中和PEDV[12]。本研究利用PEDV的pVAX1-S全长质粒经大提质粒并纯化后,免疫BALB/c小鼠,制备抗S的多抗高效血清,不仅可以应用于PEDV的免疫学特性研究,而且为进一步建立起特异性诊断方法提供参考和依据。
1 材料与方法
1.1 材料
1.1.1 菌株毒株载体及细胞
克隆菌株JM109为本实验室保存;PEDV分离株(CV777),登录号为(AF353511.1)真核表达质粒pVAX1-PEDV S,PEDV S1蛋白为本实验室制备;BHK-21细胞由本实验室保存。
1.1.2 主要试剂
质粒小量提取试剂盒购自索莱宝公司;酶制剂Bam HⅠ和Eco R I、EXT DNA聚合酶购自大连宝生物公司;HRP标记羊抗鼠IgG二抗购自北京中杉公司;DMEM细胞培养液购自GIBCO公司;DNA Maker购自大连宝生物公司;低蛋白质Marker购自大连宝生物公司;兔抗猪PEDV全病毒多克隆抗体本实验室保存。
1.1.3 试验动物
6周龄BALB/c小鼠,购自哈尔滨兽医研究所。
1.2 方法
1.2.1 重组质粒的鉴定
将重组质粒pVAX1-S转化进JM109克隆感受态中。将单菌落接种在添加Amp+的LB液体培养基中,37℃摇床培养,当LB液体培养基变浑浊。将菌液提取质粒作PCR鉴定,双酶切鉴定。引物序列如表1所示。

表1 引物序列Table 1 Sequence of primer
PCR体系为25 μL体系,体系中加入10×PCR Buffer 2.55 μL,引物P1 0.5 μL,引物P2 0.5 μL,模板3.0 μL,Ex Taq 0.3 μL,ddH2O 18.2 μL。
PCR反应条件:95℃预变性10 min;94℃变性1 min,53.5℃退1 min,72℃延伸3 min,本反应共30个循环,72℃终延伸6 min。可于4℃保存备用。1%琼脂糖凝胶电泳观察结果。将pVAX1-S质粒使用Bam H I和EcoR I,两种限制性酶双酶切,酶切体系如下:37℃反应1.5 h。10 μL体系中加入10×K Buffer1.0 μL,pVAX1-S质粒1.0 μL,Eco R I和Bam H I各0.5 μL,ddH2O 7.0 uL。
1.2.2 真核质粒的体外瞬时转染
将BHK-21细胞传于铺好灭菌爬片的24孔细胞板,当细胞生长至细胞面积70%~80%时即可转染。取纯化2 μg pVAX1-S质粒放入到装有50 μL DMEM的EP管中,混匀;2 μg脂质体溶液加入到装有50 μL DMEM的EP管中,混匀,作用5 min;将以上两EP管的溶液混合静止15 min;将混合液加入相应各孔,温箱内培养。设置pVAX1空载体和未经转染的正常细胞对照。
1.2.3 间接免疫荧光方法检测转染重组质粒的表达
细胞固定30 min后;PBS洗细胞3次,每次5 min,加入一抗1∶200的兔抗猪PEDV全病毒多克隆抗体作用60 min;PBS洗细胞3次,每次5 min,二抗为FITC羊抗兔IgG二抗,暗室作用50 min;PBS洗细胞3次,每次5 min,封片剂固定封片后使用荧光显微镜观察荧光结果。
1.2.4 真核表达质粒的大量制备
将重组质粒转化进E.coli JM109中。挑取单个菌落接种于含AMP+的LB培养基中,37℃振荡培养至LB变浑浊;加5 mL经活化后的菌液在500 mL LB培养液中,37℃摇床中震荡培养12 h;6 000 r·min-1,4℃离心20 min;收集菌体沉淀,用200 mL冷STE溶液悬起沉淀,加入SolutionⅠ18 mL和新配置的10 mg·mL-1溶菌酶2 mL,混匀后加入配置的SolutionⅡ40 mL轻轻上下颠倒混匀,静置10min;加冷的SolutionⅢ20 mL,小心来回混匀,冰上冷却10 min;6 000 r·min-1,4℃离心30 min;取上清使其通过4层纱布去除杂质,加入适量异丙醇后摇晃均匀,静置10 min;常温下10 000 r·min-1离心15 min,弃去上层清液,回收沉淀;用含70%的乙醇清洗管底及管壁;沉淀用3 mL TE悬起即为大量制备pVAX1-S的DNA。聚乙二醇沉淀法纯化。
1.2.5 试验动物分组及其免疫
将4只6周龄BALB/c小鼠,随机分成2组(试验组和空白对照),每组2只。小鼠大腿肌肉注射50 μL盐酸利多卡因,5 min后将稀释好的浓度为1 μg-1的pVAX1-S注射试验组小鼠。间隔2周免疫1次,3免1周加强免疫1次,1周后眼球取血处死。
1.2.6 多克隆抗体效价检测
用间接ELISA检测多克隆抗体血清抗体效价,用PEDV病毒包被ELISA板,100 μL·孔-1,4℃包被过夜;PBST洗孔3次,每次5 min,用含5%脱脂乳PBST溶液37℃封闭3 h;一抗为倍比系列稀释的免疫鼠阳性和隐性血清,二抗为1∶5 000稀释HRP标记羊抗鼠IgG,37℃作用1 h;PBST洗孔3次,每次5 min,加入OPD-H2O2底物显色液,OPD避光显色,OD490读数。P/N>2即可判为阳性。
1.2.7 Western Blot检测
将本实验室保存的重组PEDV S1蛋白从SDSPAGE电泳凝胶转移至NC膜,用含5%脱脂乳的PBST,4℃封闭过夜,2道用制备的阳性血清为一抗1∶200稀释37℃作用1 h,1道为阴性血清对照;PBST洗膜3次,每次10 min,以HRP标记羊抗鼠IgG为二抗1∶3 000稀释,37℃作用1 h;PBST洗膜3次,每次10 min,显色液显色,并拍照。
1.2.8 间接免疫荧光试验
将PEDV病毒感染BHK-21细胞,感染后24 h,进行间接免疫荧光。将细胞固定30 min,PBS洗细胞3次,每次5 min,一抗为1∶200的兔抗PEDV全病毒多抗,作用60 min;PBS洗细胞3次,每次5 min,分别加入FITC羊抗兔IgG二抗,暗室作用50 min;PBS洗细胞3次,每次5 min,封片剂固定封片,使用荧光显微镜观察荧光结果。
1.2.9 病毒交叉反应
将PrV,PRV,PRRSV,PPV,PCV2,TGEV, PEDV的病毒液进行浓度测定。病毒和病毒裂解液按4∶1的比例加入裂解病毒30 min。每孔包被病毒量为10 μg,同时设置包被DMEM,PBST,病毒裂解液的阴性对照孔。4℃包被过夜,5%脱脂乳37℃封闭3 h,PBST洗孔3次,每次5 min;一抗用制备的免疫鼠多抗血清1∶500稀释,37℃作用1 h,PBST洗孔3次,每次5 min;二抗用山羊抗鼠IgG 1∶5 000稀释,37℃作用50 min,PBST洗孔3次,每次5 min;加入OPD-H2O2底物显色液,OPD避光显色,OD490读数。P/N>2即可判为阳性。
2 结果与分析
2.1 真核表达质粒的鉴定
真核质粒pVAX1-S(见图1)。经PCR鉴定为4 152 bp大小正确,经Bam H I和Eco R I双酶鉴定载体带为3 000 bp,目的带为4 152 bp,大小正确(见图2)。结果表明,本试验已成功构建pVAX1-S,可进行后续试验。

图1 PCR鉴定Fig.1 Identification of PCR

图2 双酶切鉴定Fig.2 Identification of double enzyme digestion
2.2 真核表达质粒体外瞬时转染及其表达产物的检测
将真核表重组质粒pVAX1-S瞬时转染BHK-21细胞24 h后通过本实验室自制PEDV全病毒多抗,使用间接免疫荧光法显微镜观察重组质粒pVAX1-S表达效果。
由图3可见,在荧光显微镜下可以看到C中转染pVAX1-S细胞大量表达绿色荧光,而在A中未转染细胞和B中空载体转染对照组都未表达绿色荧光。结果说明真核质粒pVAX1-S可在BHK-21细胞中成功瞬时表达S蛋白,可将此质粒用于真核免疫。
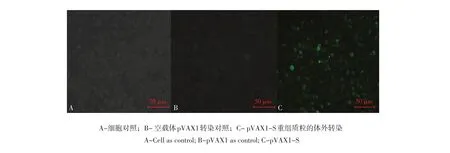
图3 免疫荧光检测重组质粒pVAX1-S在BHK21细胞中瞬时表达Fig.3 Detection of the expression of recombinant eukaryotic plasmid pVAX1-S in BHK-21 cell by IIF
2.3 多克隆抗体效价检测
PEDV病毒包被ELISA板,用间接ELISA方法检测经倍比稀释的多抗血清抗体效价,阴性鼠血清同样经倍比稀释作为隐性对照,酶标仪读取490 nm处每孔吸光光度值,P/N>2可作为判定依据。判定结果显示所制备多克隆抗体血清效价为214。
2.4 间接免疫荧光试验
将病毒感染的细胞经间接免疫荧光法后镜下观察。结果见图3。图3A为细胞对照,没有任何荧光信号出现;图3B为检测血清组,可以发现很多荧光信号出现;图3C为使用阴性血清组,未发现任何荧光信号。表明制备的鼠多抗作为一抗可观察到特异性绿荧光信号,进一步说明本试验制备的鼠多抗可特异性与PEDV结合。
2.5 Western Blot检测
用制备的阳性血清和鼠阴性血清为一抗,检测与实验室已制备的PEDV-S1蛋白(61.0 ku),Western Blot结果如图4,第2道所加一抗为阳性血清,其与S1蛋白能够结合并出现特异性条带;第1道为阴性血清,与S1蛋白未出现特异性结合条带,比较说明制备的S多抗可以特异性地识别截短表达的S蛋白。

图3 免疫荧光检测多克隆抗体特异性Fig.3 Detection of antibody specificity by IF

图5 Western Blot检测抗多克隆抗体特异性Fig.5 Detection of antibody specificity by Western Blot
2.6 病毒交叉反应
通过病毒交叉反应试验对PEDV和实验室常见几种猪病毒PPV、PrV、TGEV、PRRSV、PCV2、PEDV和PRV进行检测,将检测结果进行统计学分析。
检测结果如图6,用制备的多抗血清检测包被PEDV的试验孔和包被其他种病毒的试验孔相比,结果显示,数值差异极显著(P<0.01)。说明用此制备的鼠血清多克隆抗体,比检测物的间接ELISA检测方法有良好特异性,与其他常见猪病毒之间不存在交叉反应,可作为检测试剂。

3 讨论与结论
一般用原核表达系统表达目的蛋白进行多抗制备,但由于原核表达系统自身问题,表达的目的蛋白与天然蛋白之间在空间构象及蛋白糖基化方面存在问题。PEDV表面纤突糖蛋白(S蛋白)有较大分子质量(180~220 ku),原核表达系统无法将其糖基化,也不易表达较大分子质量蛋白。尽管研究指出以SID区(696~789 aa)截短重组S蛋白制备出多抗血清可以中和猪流行性腹泻病毒[13]。但高娃发现S蛋白全长比单独SID区免疫效果更好[14]。
本试验将PEDV的S(4 152 bp)全长基因与真核表达载体pVAX1连接构建pVAX1-S质粒,经纯化后将DNA注射到小鼠体内,在鼠体内表达外源基因,利用鼠体表达蛋白作为机体免疫系统激活抗原,诱发机体产生相关免疫应答,达到产生抗体目的。该方法优点在于利用机体本身表达活性蛋白,产生抗体后效果较好,且抗体可持续较长时间产生。
试验中选用的真核表达载体pVAX1由INVIT⁃ROGEN公司将pcDNA3.l载体演变改造优化,具备核酸疫苗制备中载体条件,pVAX1载体一方面可使多个较大目的基因片段同时克隆,另一方面强启动子pCMV和BGH polyA尾信号也可促进重组蛋白高水表达于免疫动物细胞中。所含CMV启动子还会影响翻译后的修饰从而进一步提高免疫效果。本试验应用pVAX1作为核酸疫苗真核表达载体,构建真核表达质粒pVAX1-S,用于免疫小鼠模型,制备多抗。
本试验以脂质体作为传染剂将真核pVAX1-S质粒转染入BHK-21细胞中,利用间接免疫荧光法显微镜检测是否可以在细胞中瞬时表达,结果显示,只有pVAX1-S转染组多数细胞中有绿色荧光出现,而空载体组和正常细胞组作为对照的组别,无任何荧光信号。综合检测结果说明,本试验构建的pVAX1-S重组质粒能在细胞内表达,且表达出S蛋白具有一定抗原活性,为进一步制备多抗提供理论依据。本试验利用大量提取重组质粒经纯化后免疫小鼠制备多克隆抗体,用间接ELISA测定检测抗体效价。结果表明,产生的抗体水平较高;间接免疫荧光试验结果表明其能够特异性识别PEDV感染BHK-21细胞;Western Blot结果表明,制备多抗可和天然PEDV的S蛋白发生特异性反应,说明制备抗体生物活性较高、特异性好。ELISA结果显示,制备多抗可特异性检测出PEDV抗原,可为PEDV诊断和研究S蛋白的免疫学特性提供试验依据。
[1]Bridgen A,Duarte M,Tobler K,et al.Sequence determination of the nucleocapsid protein gene of the porcine epidemic diarrhoea virus confirms that this virus is a coronavirus related to human coronavirus 229E and porcine transmissible gastroenteritis virus [J].Gen Viro I,1993,174:1795-1804.
[2]Duarte M,Tobler K,Bridgen A,et al.Sequence analysis of the porcine epidemic diarrhea virus genome between the nucleocap⁃sid and spike protein genes reveals a polymorphic ORF[J].Virolo⁃gy,1984,198:466-476.
[3]DeBouck P,Callebaut P,Pensaert M.Prevalence of the porcine epidemic diarrhea(PED)virus in the pig population of different countries[J].Vet Soc,1982(7):53.
[4]Hofmann M,Wyler R.Serologic study of the occurrence of epizoot⁃ic viral diarrhea in swine in Switzerland[J].Schweiz Arch Tierhe⁃ilkd,1987,129:437.
[5]Mostl K,Horvath E,Burki F.Erhebungen uber porcine coronavi⁃ ren in osterreichⅡporcine epidemic diarrhea virus(PEDV)der schweine[J].Wien Tierarztl Monatssch,1990,77:10-18.
[6]Jimene Z G,Castro J M,Pozzo M,et al.Identification of a corona⁃virus inducing porcine gastroenteritis in Spain[J].Pig Vet Soc Congr,1985(9):186.
[7]Kweon C H,Kwon B J,Jung T S,et al.Isolation of porcine epi⁃demic diarrhea virus(PEDV)in Korea[J].Korean Vet Res,1993, 33:249-254.
[8]Pensaert M B,de Bouck P.A new coronavirus-like particle asso⁃ciated with diarrhea in swine[J].Arch Virol,1978,58:243-247. [9]Matthijnssens J,Ciarlet M,Heiman E,et al.Full genome-based classification of rotaviruses reveals a common origin between human Wa-Like and porcine rotavirus strains and human DS-1-like and bovine rotavirus strains[J].J Virol,2008,82:3204-3219.
[10]殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997,
[11]孙东波,冯力,时洪艳.猪流行性腹泻病毒S蛋白中和表位区单克隆抗体的制备与鉴定[J].国预防兽医学报,2007,29(11): 887-890.
[12]Sun D B,Feng L,Shi H Y,et al.Spike protein region of porcine epidemic diarrhea virus is essential for induction of neutralizing antibodies[J].Acta Virol,2007,51(3):149-156.
[13]Park S J,Moon H J,Yang J S,et al.Sequence analysis of the par⁃tial spike glycoprotein gene of porcine epidemic diarrhea viruses isolated in Korea[J].Virus Genes,35(2):321-332.
[14]斯琴高娃.PEDVS与猪IL-18联合DNA疫苗免疫效果研究[D].哈尔滨:东北农业大学,2010.
Preparation of polyclonal antibody withSgene eukaryotic expression plasmid of porcine epidemic diarrhea virus/
This experiment was undertaken to prepare polyclonal antibody by immunization of BALB/c mouse with PEDVSgene eukaryotic expression plasmid(pVAX1-S)as antigen.The biological activity of the polyclonal antibody was assayed by indirect ELISA,indirect immunofluorescence(IF)test and Western Blot. The results showed that the antiserum titer was 1∶214.Not only the recombinant S protein could be identified by the polyclonal antibody,but also the PEDV-derived S protein.This study provided experimental basis of characterization of PEDV immunological properties and disease diagnosis.
porcine epidemic diarrhea virus;Sgene;eukaryotic expression plasmid;polyclonal antibody
S828;S851
A
1005-9369(2014)06-0061-06
时间 2014-6-11 16:13:46 [URL]http://www.cnki.net/kcms/detail/23.1391.S.20140611.1613.012.html
REN Xiaofeng,WANG Xue,GAO Ruize,DONG Bo,LI Guangxing(School of Veterinary Medicine,Northeast Agricultural University, Harbin 150030,China)
任晓峰,王雪,高睿泽,等.利用猪流行性腹泻病毒S基因真核表达载体制备多克隆抗体[J].东北农业大学学报,2014,45(6):61-66.
Ren Xiaofeng,Wang Xue,Gao Ruize,et al.Preparation of polyclonal antibody with S gene eukaryotic expression plasmid of porcine epidemic diarrhea virus[J].Journal of Northeast Agricultural University,2014,45(6):61-66.(in Chinese with English abstract)
2013-03-31
国家自然科学基金面上项目(31372438);教育部博士点基金项目(20122325110019);黑龙江省普通高等学校长江学者后备支持计划项目(2013CJHB002)
任晓峰(1974-),男,博士,教授,博士生导师,黑龙江省“龙江学者”特聘教授。研究方向为预防兽医学与分子病毒学。E-mail:rxfemail@yahoo.com.cn

