不同激素组合对唐古特大黄愈伤组织的影响
哈斯其美格, 曹 忻, 李海玲, 张 洋
(1. 西北民族大学 实验中心,甘肃 兰州730030;2. 双泽管理咨询公司,山东 济南250000)
大黄作为我国特产的传统中药材,始载于《神农本草经》,名为“将军”,《中国药典》收载为蓼科大黄属植物掌叶大黄、唐古特大黄或药用大黄的干燥根及根茎。前两种主产于青海、甘肃,习称北大黄,品种较优,后一种主产于四川,习称南大黄。民间根茎入药,味苦性寒,具有“泻下攻积、清热泻火、止血、解毒、活血化瘀”之功效[1-3]。
唐古特大黄,分布于青藏高原,是一种常用藏药,又称“鸡爪大黄”,是青海省重要的特色药物资源之一,产量大,品质优,在国内外享有盛誉。目前,唐古特大黄资源一直依赖野生植物的采收,由于得不到有效的保护,导致野生大黄资源日益减少、近于枯竭。通过组织培养技术人工繁殖大黄,既可保护野生资源,又可满足日益增长的市场需求[4-6]。本实验选用唐古特大黄种子萌发的无菌苗为材料,对唐古特大黄中蒽醌类次生代谢物质的生物合成途径进行了初步探索,研究了不同激素对唐古特大黄愈伤组织的影响,以便为唐古特大黄中蒽醌物质生物合成途径的深入研究奠定基础。
1 材料与方法
1.1 材料 唐古特大黄(Rheum tanguticum Maxim. ex Regel.),采于青海省黄南藏族自治州泽库县。
1.2 仪器 手提式压力蒸气消毒器YX-280B 型(江阴滨江医疗设备厂);DELTA320pH 计(梅特勒-托利多仪器上海有限公司);WGP-350 隔水式电热恒温培养箱(上海安亭科学仪器厂);S.HS-1300 水平送风净化工作台(上海精密仪器仪表有限公司)。
1.3 实验方法
1.3.1 愈伤组织的诱导 取唐古特大黄饱满粒大的种子,在水中浸泡10 h,将种皮剥去。在超净工作台上,将种子先用75%乙醇溶液浸泡45 s,再用0.1%的HgCl2浸泡15 min,然后用无菌水清洗5 遍。将种子剥开,取出胚,将其接种到MS 固体培养基表面上。在25 ℃左右,于培养箱内恒温培养。培养约3 周后,即可诱导出愈伤组织。
1.3.2 生长培养基的选择 以MS 为基本培养基,向培养基中添加不同组合的激素(见表1)。本研究使用的是常用激素2,4-D、6-BA、NAA。
1.3.3 生产培养基的选择 从不同激素组合的培养基(见表1)中培养出愈伤组织,分别测定它们的蒽醌量[4]。
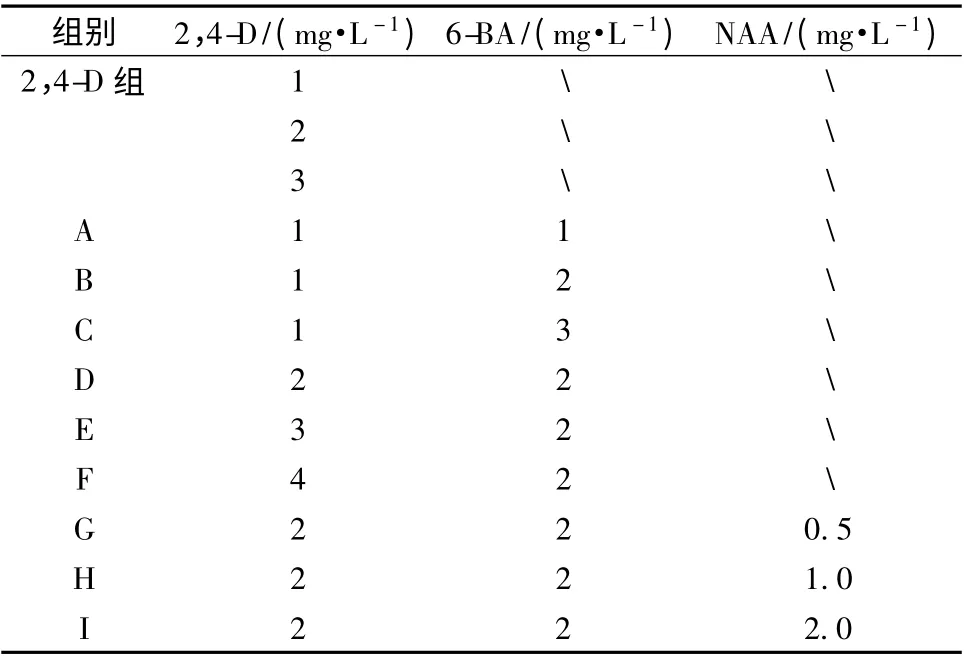
表1 培养基中不同的激素组合
1.3.4 愈伤组织的继代培养 每隔4 周时间,要对愈伤组织进行一次继代培养,将其转入新培养基中,并在转接时用天平称量愈伤组织的质量变化,以对其生长速率做出分析。
2 结果
2.1 对唐古特大黄愈伤组织诱导率的影响 外植体在接种大约一周后开始膨大,约3 周后开始形成愈伤组织。激素2,4-D 单独存在时,2,4-D 组(1、2、3)愈伤组织诱导率分别为65.4%、73.3%和68.5%。在激素2,4-D 质量浓度一定的情况下,添加质量浓度递增的激素6-BA 后,相对于2,4-D 组,A、B、C 组的诱导率明显升高。但激素6-BA 的质量浓度变化对愈伤组织诱导率影响不大。在激素6-BA 质量浓度(2 mg/L)一定的情况下,观察激素2,4-D 质量浓度变化对愈伤组织诱导率的影响,发现随着激素2,4-D 质量浓度的增加,相对于A、B、C 组,D、E、F 组诱导率明显升高。当激素2,4-D 质量浓度为2 mg/L 时,D 组在D、E、F三组中诱导率最高,但激素2,4-D 质量浓度超过2 mg/L后,相对于D 组,E、F 组诱导率又随之降低。在激素2,4-D、6-BA质量浓度一定的情况下,添加另一种激素NAA,相对于D 组G、H、I 组诱导率升高,但无显著的差距,说明生长素NAA 对诱导率的变化无显著的影响。见表2。
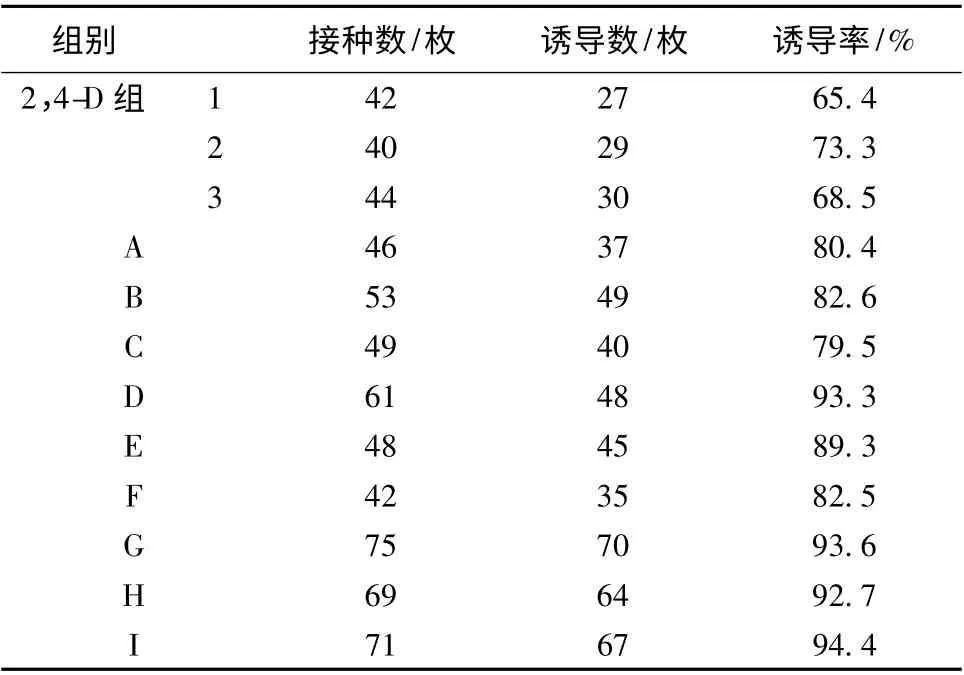
表2 不同激素组合的愈伤诱导情况
2.2 对愈伤组织生长速率的影响 在半年的继代培养时间内,每隔4 周,对愈伤组织进行一次继代培养,将其转入新的培养基中。每次转接时,称量每组愈伤组织的质量变化,用于生长速率分析。所得的数据如表3。
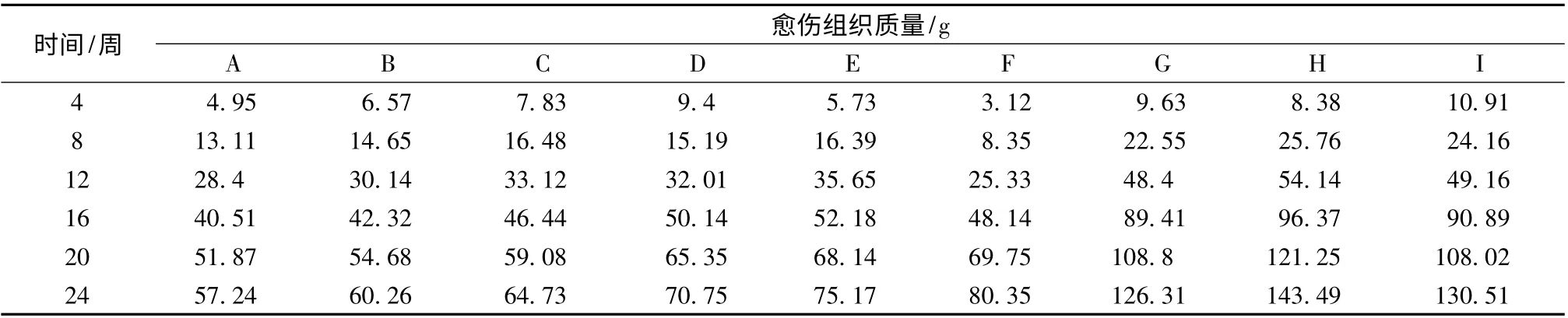
表3 愈伤组织的生长情况
对表3 中数据进行分析,发现G、H、I 3 组培养基的愈伤组织的生长速率是最大的(见图1)。D、E、F 3 组的生长速率比A、B、C 3 组稍大,但无明显差距。内部比较时,A、B、C 3 组之间基本持平,说明激素6-BA 质量浓度的变化对愈伤组织的生长速率亦无明显效应;D、E、F 3 组之间,F 组的生长速率较其他两组要稍大;G、H、I 3 组之间,H 组最大。而且G、H、I 3 组的愈伤诱导率也是最大的,说明H 组是愈伤组织最佳的生长培养基。

图1 愈伤组织的生长速率
2.3 对愈伤组织中蒽醌量的影响 在不同的激素刺激下,愈伤组织显示出不同大小的蒽醌合成能力(见图2)。从图中可以看出,A、B、C 3 组之间无明显规律,相差亦不大;D、E、F 3 组的量是逐渐减少的,说明大剂量的激素2,4-D对蒽醌的合成有一定程度的抑制作用;G、H、I 3 组仍然是最高的,相差亦不大。说明H 组是愈伤组织最佳的生产培养基。
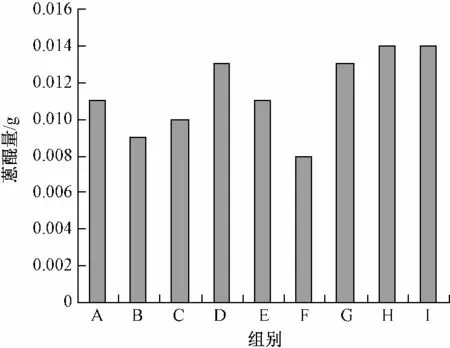
图2 愈伤组织中的蒽醌量比较
3 讨论
3.1 不同激素对愈伤组织诱导和生长的影响 激素作为植物生长调节剂,对愈伤组织的诱导有着各自独特的作用[7-10]。本实验中,激素2,4-D 对愈伤组织诱导起着主导性的作用。单独使用时就有较高的诱导率,加入激素6-BA后,诱导率显著提高。在激素6-BA 质量浓度不变的情况下,诱导率随激素2,4-D 质量浓度变大而提高,2 mg/L 时最大,而后逐渐降低。这说明激素2,4-D 的促进诱导作用有个最适质量浓度,高于这个质量浓度,反而对愈伤诱导有抑制作用。
生长素NAA 对诱导率的影响并不是很大,可能是因为NAA 所需的作用时间太长所致,这也符合张素勤等[11-15]的研究结果。NAA 诱导非洲菊叶片愈伤组织所需时间较长,当NAA 为0.5 mg/L 时,诱导出愈伤组织需26 d。NAA 诱导得愈伤组织量少,而且生长缓慢。但在本实验中,NAA对愈伤组织的生长速率有较大的促进作用。这可能是与加速6-BA 配合的结果。
3.2 不同激素对愈伤组织中蒽醌量的影响 本实验中,对于愈伤组织中的蒽醌产量,激素6-BA 无明显作用;激素2,4-D 在质量浓度为2 mg/L 时效果最好,高质量浓度有较强的抑制作用,且质量浓度越高,抑制越强;1.0 mg/L 以上质量浓度的激素NAA 对2,4-D 有增效作用。
实验结果表明,在A、B、C、D、E、F、G、H、I 组中,H 组是唐古特大黄愈伤组织最佳的生长培养基和生产培养基。2,4-D,6-BA,NAA 3 种不同激素组合的最佳培养基是:MS +2,4-D (2 mg/L) +6-BA (2 mg/L) + NAA(1 mg/L),在此培养基上,愈伤组织的生长速率和蒽醌的产量都有较佳的表现。
[1] 李安仁. 中国植物志:第25 卷[M]. 北京:科学出版社,1998:184-186.
[2] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010:22-23.
[3] Li S J,Dong X H,Wu H X,et al. Review of Rhubarb and pharmaceutical effects of its effective constitutes[J]. Medical Recapitulate,2005,11(1):76-78.
[4] 李玉林,索有瑞,王洪伦,等. 人工栽培唐古特大黄中总蒽醌含量水平的分析[J]. 天然产物研究与开发,2006,18(5):1020 -1022.
[5] 肖春桥,高 洪,池汝安,等. 诱导子促进植物次生代谢产物生产的研究进展[J]. 天然产物研究与开发,2004,16(5):473 -476.
[6] 杜丽娜,张存莉,朱 玮,等. 植物次生代谢合成途径及生物学意义[J]. 西北林学院学报,2005,20 (3):150-155.
[7] 王和勇,罗 恒,孙 敏,等. 诱导子在药用植物细胞培养中的应用[J]. 中草药,2004,8(3):52 -55.
[8] Dong X J,Wang L,Xu W H,et al. Plantlet regeneration from dormancy buds of Rheum tanguticum[J]. Plant Physiol Commun,2004,40(4):45.
[9] 赵 芳,倪 良,耿 征,等. 南方红豆杉组织培养研究[J]. 中草药,1999,30(3):213-215.
[10] 唐建军,项田夫,张禄源,等. 植物次生代谢、离体培养条件下次生代谢物积累及其调控研究进展[J]. 中国野生植物资源,1998,17(4):1-6.
[11] 张素勤,邹志荣,耿广东,等. 培养基和植物激素对非洲菊叶片愈伤诱导的研究[J]. 西北农林科技大学学报,2004,32(10):29-32.
[12] 刘文哲,张爱新. 大黄蒽醌类化合物的组织化学定位研究[J]. 西北植物学报,2000,20(6):1082-1085.
[13] 项雷文,郭丽梅. 前体物对粉葛细胞生长及次生代谢的影响[J]. 福建师范大学福清分校学报,2004,2 (5):50-53.
[14] 徐文华,陈桂琛,李 毅,等. 唐古特大黄组织培养技术的研究[J]. 西北植物学报,2004,24(9):1731-1738.
[15] 于荣敏,马 娜,严春艳,等. 外源激素对何首乌毛状根生长及蒽醌类成分生物合成的影响[J]. 生物工程学报,2006,4(3):58-64.

