磁性高分子载体用于基因释放及MRI监测
朱静芬 刘 光 江 淼 郭 亮 洪若瑜 顾宏伟 李勇刚
肿瘤基因治疗由于受到安全性及转染效率等因素的影响,限制了其在临床上的广泛应用[1-2]。近年来,高分子基因载体由于具有更好的安全性、稳定性、低成本及合成方便等特点而备受关注。迄今已构建了不同的载体形式,其在体内的转染效率也不断提高[3-5]。磁性纳米颗粒具有良好的磁学性能,已广泛应用于体内、外药物释放及MRI监测[6-7]。本研究采用阳离子高分子聚合物聚乙烯亚胺(PEI)修饰超顺磁性氧化铁纳米颗粒,构建磁性高分子基因载体(PEIMNPs),探讨其用于磁性基因转染及在体MRI监测的可行性与效果。
方 法
1. 材料
葡聚糖T20(MW≈20000)购自SCRC公司;聚乙烯亚胺(PEI,支MW≈25 000 g/mol)购自Sigma-Aldrich公司;质粒DNA购自上海生工生物技术有限公司;细胞培养基:营养混合液F-12(DMEM)、胎牛血清、磷酸盐缓冲液(PBS,pH 7.4)、0.05%胰蛋白酶-EDTA均购自上海生工生物技术有限公司。人肝癌Bel7402细胞从中国科学院细胞库(上海,中国)获得。
2. 磁性高分子基因载体 (DNA-MNPs)的合成
2.1 PEI修饰的超顺磁性氧化铁纳米颗粒(PEIMNPs)的合成:根据本课题组前期研究报道,合成葡聚糖-超顺磁性Fe3O4纳米颗粒(SPIO)[2-3]。通过葡聚糖-超顺磁性Fe3O4纳米颗粒表面的葡聚糖与一氯乙酸经过羧甲基化反应生成羧甲基葡聚糖改性的超顺磁性Fe3O4纳米颗粒(CMD-MNPs)。支化聚乙烯亚胺(bPEI)与CMD-MNPs表面的羧基通过DCC/NHS进行化学连接,得到PEI-MNPs。PEI:Fe3O4重量比分别为0.1、0.5、1、2、3。
2.2 氧化铁-质粒DNA磁性纳米颗粒(DNAMNPs)基因载体的合成:DNA-MNPs的合成按照最佳预设比值,将PEI-MNPs (50μg/ml)与溶于PBS中的裸DNA (50μg/ml) 等体积混合并反应30分钟。DNA终浓度100μg/ml。
3. CMD-MNPs 与DNA-MNPs的物理特性检查
采用透射型电子显微镜(HitachiH-600-II) 观察CMD-MNPs 与DNA-MNPs聚合体的形态。PEI-MNPs的平均流体力学直径测量采用Malvern HPPS5001型粒径测试仪通过动态光散射(DLS)原理在25℃时测定,PEI-MNPs悬浮液终浓度为0.1mg/ml。采用振动样品磁强计检测PEI-MNPs的饱和磁化强度。采用纳米激光粒度仪Zetasizer Nano-ZS(马尔文仪器公司),背散射法测量DNA-MNPs粒子的Zeta电位。
4. 体外细胞转染实验
4.1 细胞培养:人肝癌Bel7402细胞采用10%牛血清的DMEM细胞培养基培养,放置在37℃、5%的CO2培养箱中。基因转染前一天,将1ml细胞悬液以5×104个细胞/孔的细胞密度接种到24孔板中。细胞克隆率为60%时,行基因转染实验。
4.2 基因转染:人肝癌Bel7402细胞分为磁性转染组与常规转染组,两组每孔细胞中加入100ml DNAMNPs基因载体溶液(1mg DNA /孔)。磁性转染组在被转染细胞下放置高强度磁铁行24h磁性转染。 常规转染组不放置磁铁,行24h常规转染作为对照。在磁性转染和常规转染后,将细胞洗涤至少三次,以除去悬液中剩余的基因载体,更换细胞培养基后放置在37℃、5%CO2的培养箱中培养48h。然后,去除细胞培养基,将细胞用PBS洗涤一次,采用荧光显微镜观察各组绿色荧光蛋白表达。
5. MRI检查
取两组转染细胞悬液(细胞浓度1×106)1ml置于1.5mlEP管内,分别于转染前、转染后1h及24h行MRI扫描。MRI扫描采用3.0T的全身扫描仪(GE HD MRI)进行扫描,扫描序列及参数如下:①FSET2WI采用序列,TR/ TE:2500/80ms,层厚/间距:2.0/0.5mm,FOV 10 cm×10 cm,矩阵:224×192,激励次数4 NEX。②T2map序列,使用8个回波, 其TE分别为5、10、20、40、60、80、100及120ms,TR为2000ms,其他参数同FSE-T2WI序列。
多回波SE T2map序列扫描完成后,图像传至AW4.0工作站,使用T2map测量软件,测量各组不同时间点T2弛豫时间。T2弛豫时间的拟合公式y=A+C*exp(-t/T2),其中y是时间为t时测量的信号强度,A是背景噪声,C*是质子密度信号强度,t是回波时间。T2弛豫率的计算R2=1/T2( s-1)。
结 果
1. CMD-MNPs 与DNA-MNPs的物理特性
1.1 形态与粒径:PEI-MNPs 与 DNA-MNPs复合物透射电子显微镜观察结果显示,PEI-MNPs 在溶液中为球形结构,平均粒径为15nm,分散均匀,未看到细胞集聚现象(图1A)。DNA-MNPs的形态如(图1B)所示,质粒DNA通过静电相互作用而吸附于PEI-MNPs表面,DNA-MNPs聚合体的平均粒径约850nm。
在2.0∽11.0的pH范围内和0∽0.14mol/L的NaCl浓度范围内PEI-MNPs的平均流体微粒直径在35∽45nm之间(图2、3),在所测试的离子强度变化范围与pH变化范围内没有观察到粒子的聚集。
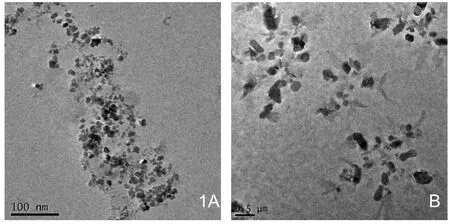
图1 A.PEI-MNPs 聚合物的透射电子显微镜图,PEIMNPs为球形结构,平均粒径为15nm,分散均匀,未看到细胞集聚现象。B. DNA-MNPs 聚合物的透射电子显微镜图。
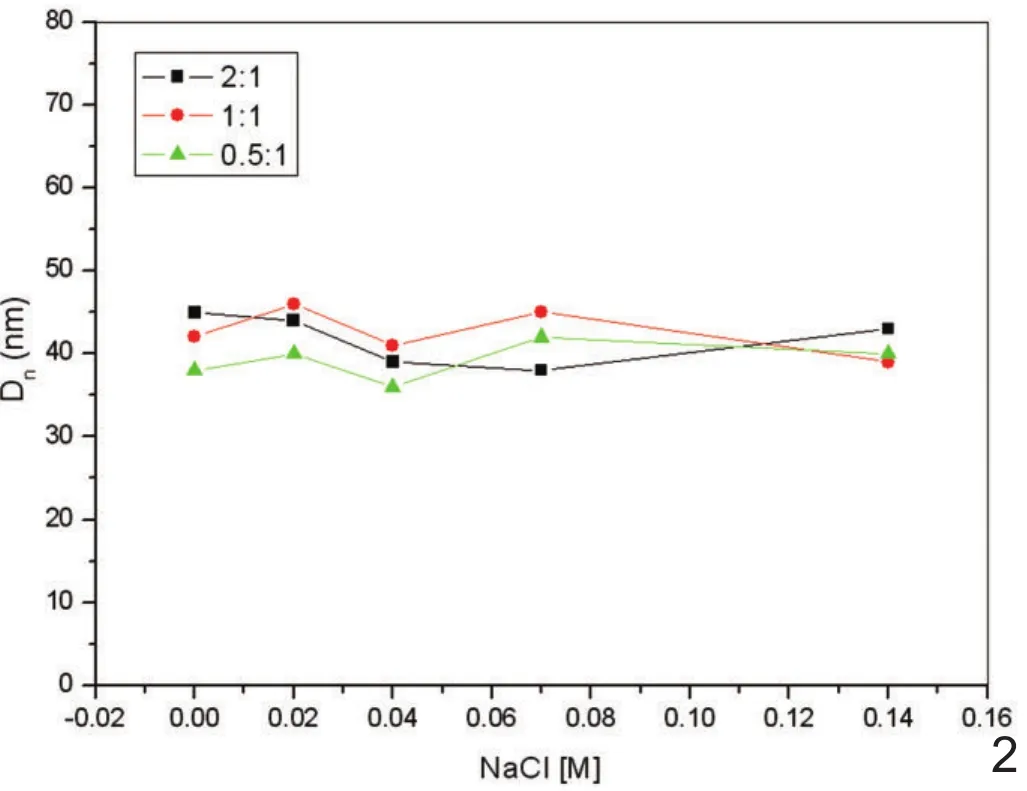
图2 不同PEI/ Fe3O4重量比下的PEI-MNPs在不同NaCl浓度下的流体微粒直径,其中NaCl浓度范围为0∽0.14mol/L,PEI/ Fe3O4比值在2:1,1:1,0.5:1时流体微粒直径均在35∽45nm之间。
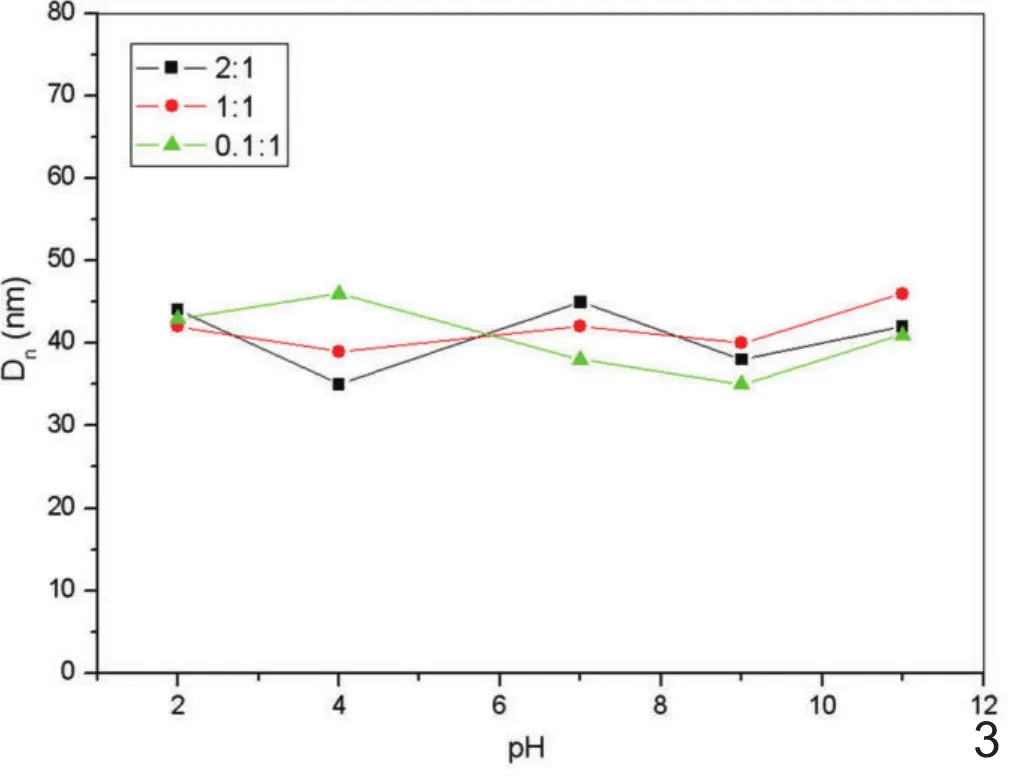
图3 不同PEI/ Fe3O4重量比下的PEI-MNPs在不同pH下的流体微粒直径,其中pH在2.0∽11.0范围内,PEI/ Fe3O4比值在2:1,1:1,0.5:1时流体微粒直径均在35∽45nm之间。
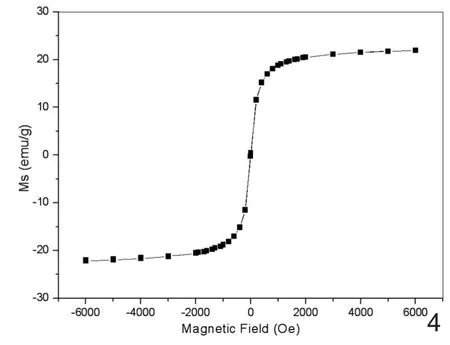
图4 PEI-MNPs的饱和磁化强度曲线。
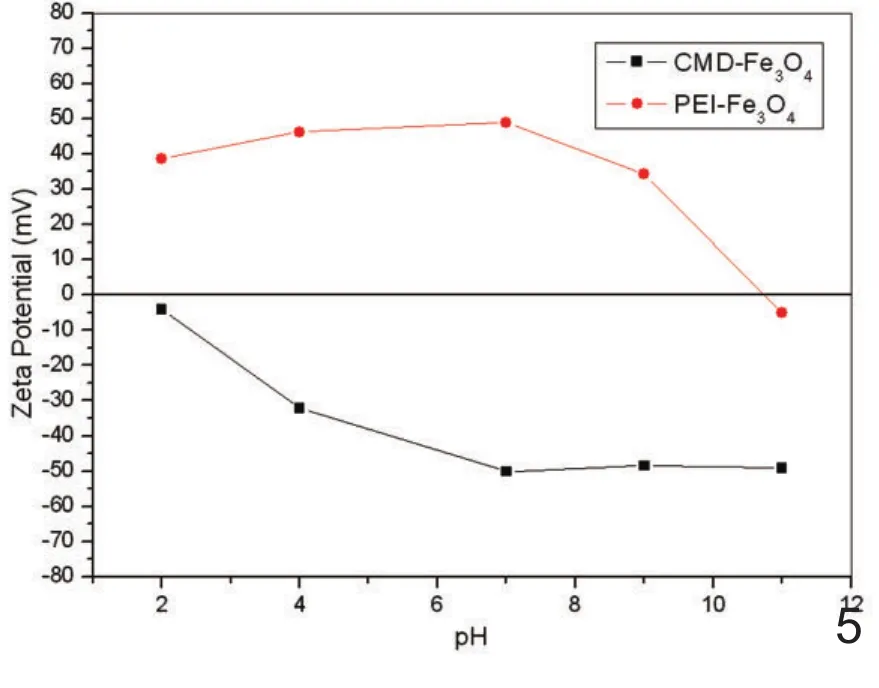
图5 CMD-MNPs 和 PEIMNPs在不同pH的Zeta电位变化曲线。
1.2 磁学特性:PEI-MNPs在室温下典型的样品磁化曲线,表现出典型的超顺磁性行为,样品的饱和磁化强度(Ms)为25.8emu/g(图4)。磁滞曲线表明大部分的纳米颗粒饱和磁化强度约为2000Oe。
1.3 Zeta电位:CMD-MNPs和PEI-MNPs在2.0∽11.0的pH范围内的Zeta电位曲线表明随着溶液碱性逐渐增加,CMD-MNPs的Zeta电位在2.0∽11.0的pH范围内负电位值逐渐增加,而PEI-MNPs的Zeta电位在2.0∽11.0的pH范围内正电位值逐渐减少(图5)。CMD-MNPs的等电点为pH=2.0,PEI-MNPs的等电点为 pH=11.0。DNA-MNPs的Zeta电位与PEIMNPs的Zeta电位相比显著下降(图6)。DNA-MNPs的Zeta电位随着Fe/DNA比值的增高而增高。在Fe/DNA=0.1时Zeta电位为-12mV,Fe/DNA=3时Zeta电位为23mV。
2. 细胞基因转染与MRI成像
磁性转染组与常规转染组随着转染时间的延长T2信号强度减低(图7),不同时间点T2值与R2值测量结果见表 1。

表1 磁性转染组与常规转染组不同时间点T2值与R2值测量结果
常规转染组与磁性转染组转染后72h的Bel7402细胞荧光显微镜图显示,在MNP与DNA比值相同的条件下,磁性转染组的绿色荧光点密度显著高于常规转染组(图8)。
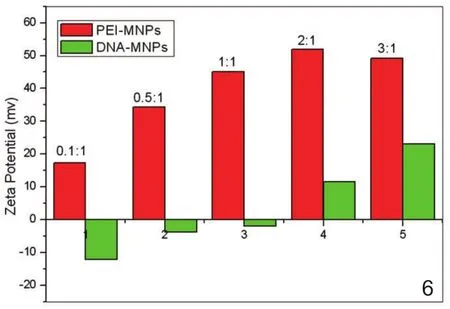
图6 不同PEI 与DNA重量比下PEI-MNPs 和 DNA-MNPs的Zeta电位,PEI-MNPs 和 DNA-MNPs溶解于pH = 7.0的水溶液中。
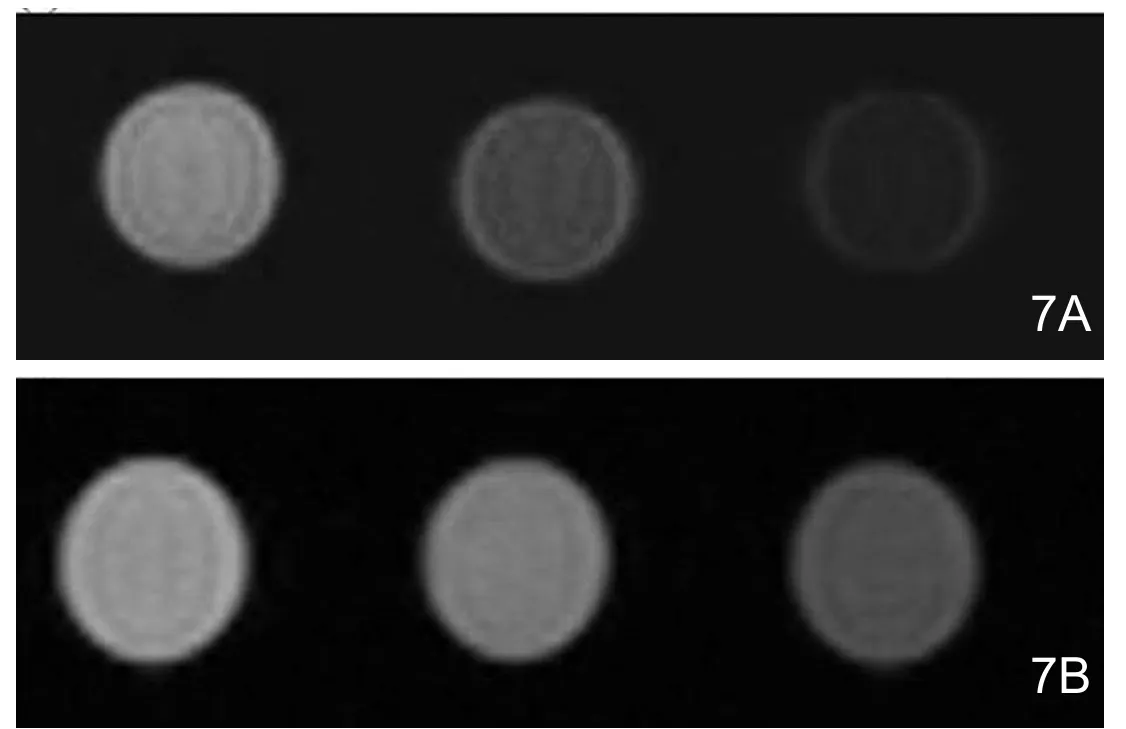
图7磁性转染组(A)与常规转染组(B)转染前、转染后1小时及24小时的Bel7402细胞悬液T2WI图。

图8 A、C.分别为磁性转染组与常规转染组转染后的Bel7402细胞显微镜图。B、D.分别为磁性转染组与常规转染组转染后的Bel7402细胞共聚焦荧光显微镜图,磁性转染组的绿色荧光点密度及强度显著高于常规转染组。
讨 论
基因转染载体大致可分为病毒性基因转染载体与非病毒性基因转染载体。病毒性基因转染载体被认为是最有效的基因转染载体,其转染效率大于90%[8]。但是其安全性成为制约其在临床应用的主要因素[1-2]。非病毒性基因转染载体不但具有更好的安全性[3]、稳定性[4],且其成本低、合成方便,使其在过去几年里备受关注。迄今已构建了不同的载体形式,包括用脂质、高分子聚合物或蛋白质修饰的非病毒性基因转染载体,其在体内的转染效率也不断提高[5,9]。
近年来 ,超顺磁性纳米颗粒作为基因载体用于磁性转染引起了广泛的关注。在磁场中,氧化铁-质粒DNA磁性纳米颗粒能够在细胞内迅速沉降[9-11]。除此之外,磁场还有助于纳米颗粒在体内定位特定靶点并增加其在靶点的停留时间。Plank已经证明了在静态磁场中,利用磁性纳米颗粒进行磁性转染能够提高基因转染的效率[12]。氧化铁纳米颗粒由分散状态转换成聚合状态时其T2弛豫率会发生变化,这种效应被称为“T2弛豫开关效应”。氧化铁纳米颗粒的T2弛豫变化与许多因素密切相关,包括粒径、表面电荷、表面功能基团及表面结合水的含量,氧化铁由分散变成聚合状态既可以导致T2弛豫率的增加,也可使其减小,主要取决于上述这些因素的变化[13]。目前,已有研究者尝试将基于“T2弛豫开关效应”的MR成像用于药物与基因释放的监测,取得初步成功[13-14]。本研究采用超微超顺磁性氧化铁(USPIO)构建磁性纳米基因载体PEI-USPIO,用于磁性基因转染与基因释放的MRI监测。结果表明,在磁性转染组与常规转染组,随着转染时间的延长,其T2弛豫率减小,这表明DNA-MNPs颗粒成功地转入细胞,并随着时间推移逐步释放质粒DNA,基因释放前后USPIO由聚合变成分散状态时T2弛豫发生了显著的变化。与常规转染组相比,磁性转染组的T2弛豫缩短更快更显著,绿色荧光蛋白表达检测也表明磁性转染组绿色荧光蛋白表达显著高于常规转染组,说明磁性基因转染能显著提高基因转染效率。同时,此种MRI监测方法有望用于基因载体体内作用机制、药代动力学以及基因治疗疗效的评估。
聚乙烯亚胺 (PEI) 是基因载体中一种较为理想的阳离子聚合物[8],经PEI修饰的氧化铁-质粒DNA磁性纳米颗粒(PEI-MNPs)能够逃脱内涵体的吞噬清除。PEI的的转染效率及其毒性与它的分子量大小紧密相关[15]。高分子量的PEI有较高的转染效率但急性细胞毒作用较明显,而低分子量的PEI经细胞培养试验被证明是无毒的,但是仅有很低的转染效率。本研究采用分子量为25000的PEI成功合成了磁性纳米载体(PEI-MNPs),并结合质粒DNA,构建氧化铁-质粒DNA磁性纳米颗粒(DNA-MNPs)。PEI-MNPs在生理pH范围内带正电荷并呈现出良好的稳定性。DNAMNPs在磁场内呈现出较高的细胞转染效率与基因表达效能,且转染细胞未出现明显细胞毒性效应。
综上,本研究在超顺磁性氧化铁纳米颗粒表面包被聚乙烯亚胺(PEI-MNPs)并结合质粒DNA,成功构建了氧化铁-质粒DNA磁性纳米颗粒聚合物(DNAMNPs)。PEI-MNPs聚合物表现出了典型的超顺磁性行为,并在较大的pH变化范围内和NaCl浓度变化范围内均表现出良好的稳定性。磁共振成像能监测细胞对DNA-MNPs的摄取以及细胞内基因释放过程。在外磁场导引下行磁性基因转染其转染效率和基因表达效率显著高于常规转染。
[1] Park TG, Jeong JH, Kim SW. Current status of polymeric gene delivery systems. Adv Drug Deliv Rev, 2006, 58: 467-486.
[2] Luo D, Saltzman WM. Synthetic DNA delivery systems. Nat Biotechnol, 2000, 18: 33-37.
[3] Pouton CW, Seymour LW. Key issues in non-viral gene delivery.Adv Drug Deliv Rev, 2001, 46: 187-203.
[4] Kataoka K, Togawa H, Harada A, et al. Spontaneous formation of polyion complex micelles with narrow distribution from antisense oligonucleotide and cationic block copolymer in physiological saline. Macromolecules, 1996, 29: 8556-8557.
[5] Godbey WT, Wu KK, Mikos AG. Poly(ethylenimine) and its role in gene delivery. J Control Release, 1999, 60: 149-160.
[6] Raty JK, Liimatainen T, Wirth T, et al. Magnetic resonance imaging of viral particle biodistribution in vivo. Gene Ther, 2006,13: 1440-1446.
[7] Nasongkla N, Bey E, Ren J, et al. Multifunctional polymeric micelles as cancer-targeted,MRI-ultrasensitive drug delivery systems. Nano Lett, 2006, 6: 2427-2430.
[8] Boussif O, Lezoualc'h F, Zanta MA, et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo:polyethylenimine. Proc Natl Acad Sci U S A, 1995, 92: 7297-7301.
[9] 乔中伟, 缪 飞, 夏春梅, 等. 靶向磁性纳米粒子诊断胰腺癌活体MRI研究. 中国医学计算机成像杂志, 2009, 15: 144-148.
[10] Neuberger T, Schöpf B, Hofmann H, et al. Superparamagnetic nanoparticles for biomedical applications: possibilities and limitations of a new drug delivery system. Journal of Magnetism and Magnetic Materials, 2005, 293: 483-496.
[11] Widder KJ, Senyel AE, Scarpelli GD. Magnetic microspheres: a model system of site specific drug delivery in vivo. Proc Soc Exp Biol Med, 1978, 158: 141-146.
[12] Plank C, Schillinger U, Scherer F, et al. The magnetofection method: using magnetic force to enhance gene delivery. Biol Chem,2003, 384: 737-747.
[13] Park IK, Ng CP, Wang JN, et al. Determination of nanoparticle vehicle unpackaging by MR imaging of a T2 magnetic relaxation switch. Biomaterials, 2008, 29: 724-732.
[14] Chen DY, Li NJ, Gu HW, et al. A novel degradable polymeric carrier for selective release and imaging of magnetic nanoparticles. Chem.Commun., 2010, 46, 6708-6710.
[15] Kunath K, von Harpe A, Fischer D, et al. Low-molecularweight polyethylenimine as a non-viral vector for DNA delivery:comparison of physicochemical properties, transfection efficiency and in vivo distribution with high-molecular-weight polyethylenimine. J Control Release, 2003, 89: 113-125.

