玉郎伞多糖对环磷酰胺所致的免疫抑制小鼠免疫功能的影响
龙 珍,龙腾云,黄仁彬,陈春霞,陈庆全,韦锦斌
广西医科大学药理学教研室,南宁 530021
玉郎伞多糖(Yulangsan Polysaccharide,YLSPS)为豆科植物疏叶崖豆[Millettia Pulchra(Benth.)Kurz var.Laxior (Dunn)Z.Wei]的干燥根中提取的有效成分,由葡萄糖和阿拉伯糖组成,始见于《广西中药志》,为广西壮、瑶医常用药材,具有补血、补气、提高免疫力等功效[1]。YLSPS 多糖含量较多,并且作用广泛,长期以来本课题组对其进行研究,发现YLSPS 具有抗自由基、抗氧化、抗衰老、抗高血压和护肝等作用,并对抗癌和免疫增强有一定药理作用。因此,为进一步研究YLSPS 的功效,本实验通过建立环磷酰胺诱导的免疫抑制模型,拟研究YLSPS 对小鼠免疫器官指数、小鼠脾脏组织内乳酸脱氢酶和酸性磷酸酶活性及肝、脾巨噬细胞廓清指数和吞噬指数、二硝基氟苯诱导的迟发型超敏反应的影响,并对其抗应激能力进行检测,进一步观察YLSPS 对机体免疫功能的双向调节作用,并初步探讨其作用机制,为开发新一类免疫调节剂奠定基础。
1 材料与仪器
1.1 动物
昆明种小鼠,雌雄各半,体质量20 ±2 g,由广西医科大学实验动物中心提供,试验动物质量合格证:SCXK 桂2009-0002。
1.2 药物及试剂
玉郎伞多糖(本实验室自行提取),注射用环磷酰胺(通化茂祥有限公司,批号120802);盐酸左旋咪唑片(广西南国药业有限公司,批号120103);乳酸脱氢酶测定试剂盒(南京建成生物工程研究所,批号20120716);酸性磷酸酶测定试剂盒(南京建成生物工程研究所,批号20120716);无水碳酸钠分析纯AR(衡阳市凯信化工试剂有限公司,批号20090411);印度墨水(solarbio,批号:18060)。
1.3 仪器
722S 型分光光度计(上海精密科学仪器有限公司);台式高速冷冻离心机(德国SIGMA);FT-200高速分散匀质机;BD-326 型海尔卧式冷冻柜。
2 实验方法
2.1 动物分组及给药
SPF 级昆明种小鼠60 只,20 ±2 g,雌雄各半。实验动物随机分为6 组:空白对照组、环磷酰胺(CTX)模型组、阳性药左旋咪唑组(LMS)和YLSPS低、中、高剂量组。除空白对照组外,其它各组小鼠于给药的第1、3、5、7、9 d 皮下注射CTX(30 mg/kg)造模。空白对照组用NS(0.1 mL/10 g)灌胃,LMS组用LMS[50 mg/(kg·d)]灌胃,YLSPS 低、中、高剂量组用YLSPS[150、300、600 mg/(kg·d)]灌胃。
2.2 胸腺、脾脏指数测定
末次给药后小鼠禁食12 h,处死,分别取胸腺、脾脏称湿重,计算胸腺、脾脏指数。胸腺(脾)指数=胸腺(脾)重量(mg)/[小鼠体重(g)×10]。
2.3 乳酸脱氢酶(LDH)及酸性磷酸酶(ACP)活性测定
按试剂说明进行乳酸脱氢酶(LDH)及酸性磷酸酶(ACP)活性测定。
2.4 对免疫抑制小鼠肝、脾巨噬细胞吞噬功能的影响
分组给药、造模同2.1。末次给药后0.5 h,于各鼠尾静脉注射经4 倍稀释的印度墨汁5 μL/g,于1 min(t1)和5 min(t5)后,分别从眼眶静脉取血20 μL,加到1 g/L Na2CO3溶液2 mL 中摇匀,用分光光度计在680 nm 处测定t1和t5的吸光度值(A1,A5),计算廓清指数K。之后,将小鼠处死,取肝脏及脾脏称质量,计算吞噬指数α。廓清指数K=(logA1-logA5)/(t5-t1)=log(A1/A5)/4,吞噬指数α=体质量/(肝重+脾重)×K1/3。
2.5 对环磷酰胺免疫抑制小鼠迟发型过敏反应(DTH)的影响
分组给药、造模同2.1。于第1 d 将每只小鼠腹部去毛3 ×3 cm2,将10 g/L 二硝基氟苯(DNFB)均匀涂抹于其上。末次灌胃后1 h,均在各组小鼠右耳均匀涂10 g/L 二硝基氟苯。攻击24 h 后颈椎脱臼处死小鼠,剪下左右耳廓,用打孔器取下直径8 mm的耳廓,称质量,以左右耳廓重量之差作为肿胀度。
2.6 对小鼠负重游泳时间的影响
分组给药、造模同2.1。末次给药60 min 后,在小鼠尾根部束相当于其体重5%的重物,然后将其放入玻璃水缸(水深35 cm,水温20 ±1 ℃)游泳,记录各组小鼠的游泳时间,以小鼠沉入水中的时间为游泳时间。
2.7 对小鼠常压耐缺氧的影响
分组给药、造模同2.1。末次给药60 min 后,将每只小鼠置于放有15 g 钠石灰的250 mL 的广口瓶中,并以凡士林密封瓶口,记录和观察其生存时间。
2.8 对小鼠耐低温能力的影响
分组给药、造模同2.1。末次给药60 min 后,将小鼠置于-10 ±0.5 ℃的卧式冰柜的隔槽内,透过玻璃门盖观察并记录小鼠在低温条件下的呼吸停止时间。
2.9 对小鼠耐高温能力的影响
分组给药、造模同2.1。末次给药60 min 后,将每只小鼠放入底部置有海绵垫的容积为1000 mL 的烧杯中,然后将烧杯放入恒温水浴箱中(水温为43±1 ℃),观察并记录小鼠在高温条件下的呼吸停止时间。
2.10 对亚硝酸盐中毒性缺氧耐受性的影响
分组给药、造模同2.1。末次给药60 min 后,于各组小鼠腹腔注射5%亚硝酸钠0.1 mL/10 g,观察并记录每只小鼠注射亚硝酸钠后的呼吸停止时间。
2.11 数据分析
采用SPSS13.0 软件进行统计学处理,实验数据的结果以均数±标准差()表示,各组均数之间比较采用One-way ANOVA 和组间多重比较,P <0.05 有统计学意义。
3 实验结果
3.1 对免疫抑制小鼠胸腺指数和脾脏指数的影响
从表1 可以看出与正常对照组比较,CTX 组胸腺指数,脾脏指数显著降低(P <0.01),给药后,玉郎伞多糖中、高剂量组可显著提高免疫抑制小鼠的胸腺指数、脾脏指数(P <0.01)(见表1)。
表1 玉郎伞多糖对免疫抑制小鼠胸腺指数、脾脏指数的影响(n=10,)Table 1 Effects of YLSPS on thymus index and spleen index of immunosuppressive mice (n=10,)
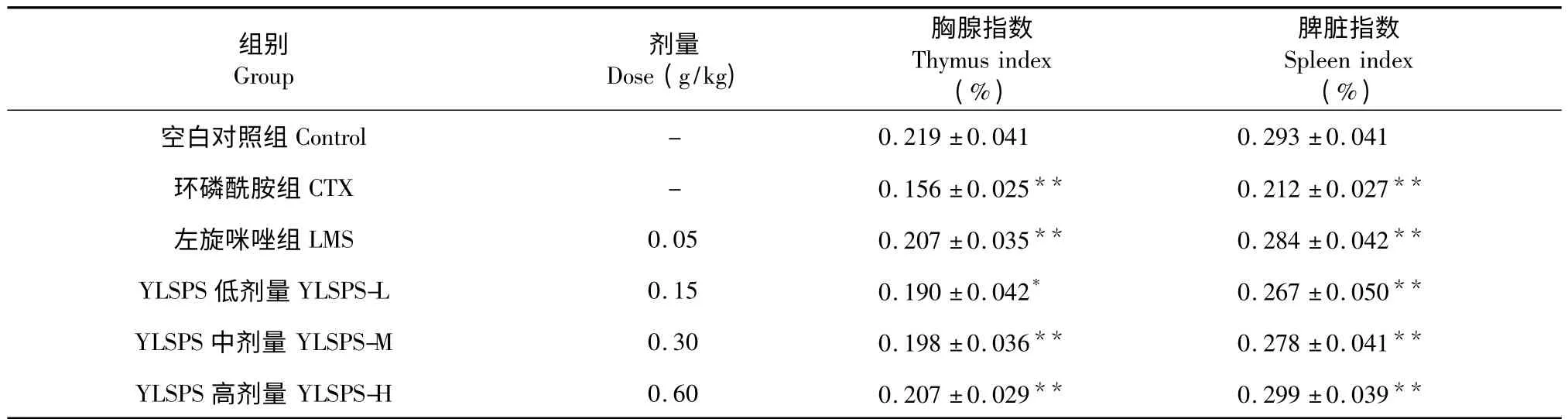
表1 玉郎伞多糖对免疫抑制小鼠胸腺指数、脾脏指数的影响(n=10,)Table 1 Effects of YLSPS on thymus index and spleen index of immunosuppressive mice (n=10,)
注:与空白对照组比较,* P <0.05,**P <0.01;与环磷酰胺组比较,* P <0.05,**P <0.01。下表同。Note:compared with the control,* P <0.05,**P <0.01;compared with the CTX group,* P <0.05,**P <0.01.Same as below.
3.2 对免疫抑制小鼠脾脏组织中LDH、ACP 活性的影响
与正常对照组比较,环磷酰胺组可明显降低LDH、ACP 的活性(P <0.01);给药后,玉郎伞多糖中、高剂量组可明显提高免疫抑制小鼠的LDH 活性和ACP 活性(P <0.01)(见表2)。
表2 玉郎伞多糖对免疫抑制小鼠脾脏组织中LDH、ACP 活性的影响(n=10,)Table 2 Effects of YLSPS on LDH,ACP activities of spleen of immunosuppressive mice (n=10,)

表2 玉郎伞多糖对免疫抑制小鼠脾脏组织中LDH、ACP 活性的影响(n=10,)Table 2 Effects of YLSPS on LDH,ACP activities of spleen of immunosuppressive mice (n=10,)
3.3 对免疫抑制小鼠肝、脾巨噬细胞吞噬功能的影响
与正常对照组比较,环磷酰胺组肝、脾巨噬细胞廓清指数K、吞噬指数α 显著低于正常对照组(P <0.01);给药后,玉郎伞多糖中、高剂量组可明显提高CTX 所致的免疫抑制小鼠的肝、脾巨噬细胞廓清指数K、吞噬指数α(P <0.01)。(见表3)
表3 玉郎伞多糖对免疫抑制小鼠肝、脾巨噬细胞吞噬功能的影响(n=10,)Table 3 Effects of YLSPS on the phagocytosis ability of macrophage of immunosuppressed mice (n=10,)
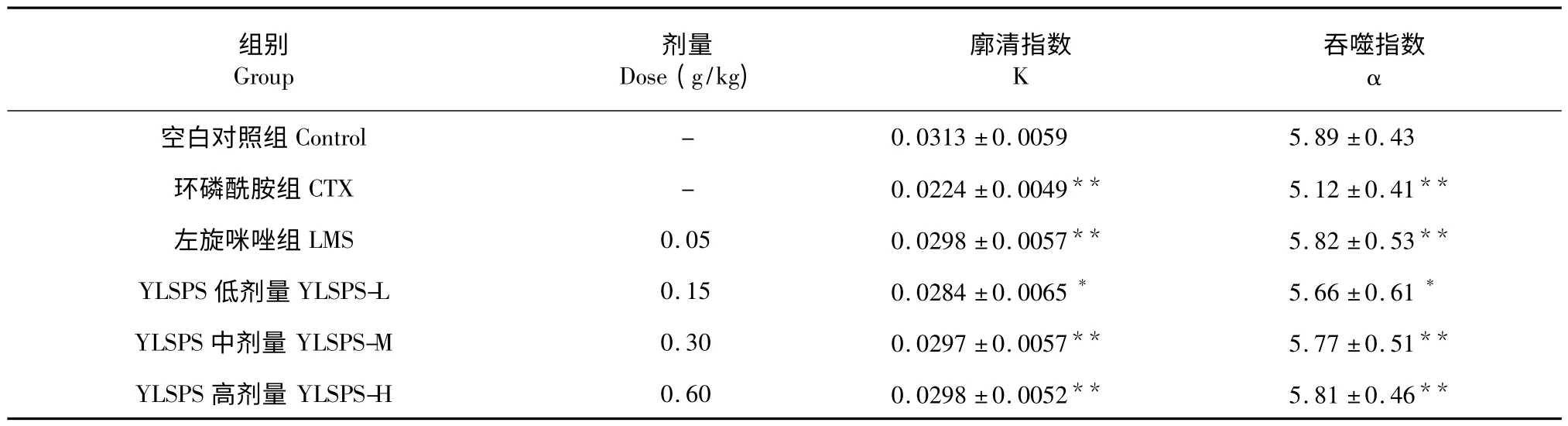
表3 玉郎伞多糖对免疫抑制小鼠肝、脾巨噬细胞吞噬功能的影响(n=10,)Table 3 Effects of YLSPS on the phagocytosis ability of macrophage of immunosuppressed mice (n=10,)
表4 玉郎伞多糖对免疫抑制小鼠迟发型超敏反应的影响(n=10,)Table 4 Effects of YLSPS on ear swellings of immunosuppressive mice (n=10,)

表4 玉郎伞多糖对免疫抑制小鼠迟发型超敏反应的影响(n=10,)Table 4 Effects of YLSPS on ear swellings of immunosuppressive mice (n=10,)
3.4 对环磷酰胺免疫抑制小鼠迟发型过敏反应(DTH)的影响
与正常对照组比较,环磷酰胺组耳肿胀度显著低于正常对照组(P <0.01);给药后,玉郎伞多糖中、高剂量组可明显提高CTX 所致免疫抑制小鼠的耳肿胀度(P <0.01)(见表4)。
3.5 对环磷酰胺免疫抑制小鼠抗应激能力的影响
从表5 实验结果可以看出,与环磷酰胺组相比较,玉郎伞多糖低、中、高剂量组均可以延长小鼠负重游泳时间和耐低温存活时间(P <0.05),尤其以高剂量组更为明显(P <0.01)。同时,玉郎伞多糖中、高剂量组也提高小鼠耐高温存活时间(P <0.05)。
表5 玉郎伞多糖对小鼠负重游泳时间、耐低温存活时间、耐高温存活时间的影响(n=10,)Table 5 Effects of YLSPS on loaded swimming time,low temperature survival time and high temperature survival time of immunosuppressive mice(n=10,)

表5 玉郎伞多糖对小鼠负重游泳时间、耐低温存活时间、耐高温存活时间的影响(n=10,)Table 5 Effects of YLSPS on loaded swimming time,low temperature survival time and high temperature survival time of immunosuppressive mice(n=10,)
从表6 实验结果可以看出,与环磷酰胺组相比较,玉郎伞多糖低、中、高剂量组均可提高小鼠在常压耐缺氧情况下的存活时间(P <0.05),以高剂量组明显(P <0.01)。而玉郎伞多糖的中、高剂量组可以提高小鼠的中毒性耐缺氧存活时间(P <0.05)。
表6 玉郎伞多糖对小鼠常压耐缺氧和中毒性耐缺氧存活时间的影响(n=10,)Table 6 Effects of YLSPS on survival times of immunosuppressive mice under normal pressure anoxia environment and nitrite poisoning anoxia environment(n=10,)

表6 玉郎伞多糖对小鼠常压耐缺氧和中毒性耐缺氧存活时间的影响(n=10,)Table 6 Effects of YLSPS on survival times of immunosuppressive mice under normal pressure anoxia environment and nitrite poisoning anoxia environment(n=10,)
4 讨论
目前研究表明,多糖具有免疫活性,且具有毒副作用小、多效性、双向调节性等特点[2]。玉郎伞多糖具有较强的抗氧自由基作用[3]和抗肿瘤及免疫调节活性[4]。机体的免疫功能通常由细胞免疫、体液免疫以及非特异性免疫反应组成[5]。脾脏和胸腺都是重要的免疫器官,湿重指数可反映它们的功能状况。巨噬细胞为机体免疫系统中重要的免疫细胞,具有吞噬细胞、诱发特异性免疫应答、参与免疫调节等多种作用,其吞噬指数是反映机体非特异性免疫功能的指标[6]。而LDH 广泛存在于机体的组织器官中和巨噬细胞的胞液内,其与巨噬细胞激活的程度相关,是巨噬细胞激活的标志之一[7]。ACP是高等动物体内巨噬细胞溶酶体酶的标志,它的高低也反映了巨噬细胞被激活的程度[8]。迟发型变态反应是由T 细胞介导的细胞免疫应答的一种类型,也是常见的一种免疫反应[9]。此外,长期应激导致多种疾病,如高血压、冠心病、甲亢、消化性溃疡等,慢性应激造成脂质和过氧化物长期积蓄可损害生物膜,导致细胞发生退行性变化,加速机体器官的老化。小鼠负重游泳时间、常压缺氧、低温和高温环境下的存活时间以及对亚硝酸盐中毒性缺氧耐受性是衡量药物抗应激的常用指标。本实验选择左旋咪唑作为阳性对照药,进一步研究玉郎伞多糖的免疫调节功能。
本实验结果显示,玉郎伞多糖能使小鼠胸腺指数和脾脏指数显著增加(P <0.05),这表明不同剂量组的玉郎伞多糖均可促进胸腺、脾脏组织细胞生长代谢,改善机体免疫功能。同时,玉郎伞多糖中、高剂量组可使机体LDH、ACP 活性上调(P <0.05),这表明玉郎伞多糖能够激活巨噬细胞。在本实验中,我们还发现玉郎伞多糖对环磷酰胺所致的免疫抑制小鼠肝、脾巨噬细胞吞噬能力有促进作用,可以增强小鼠非特异性免疫功能。同时,玉郎伞多糖中、高剂量能显著增强免疫低下小鼠的迟发型超敏反应,提示玉郎伞多糖能提高免疫低下小鼠的细胞免疫功能。另外玉郎伞多糖能延长小鼠负重游泳时间、常压缺氧存活时间、耐低温存活时间、耐高温存活时间,能增强小鼠的抗应激能力,使机体适应外界环境突发的变化。
综上所述,玉郎伞多糖可作用于免疫系统的多个环节,对免疫低下小鼠的非特异性免疫、特异性免疫均有一定增强作用,拮抗因CTX 而造成的免疫低下状态。
1 Dai XD(戴向东),Qiu CE(丘翠嫦),Dai B(戴斌),et al.玉郎伞的化学成分分析.Chin J Ethnomed Ethnopharm (中国民族民间医药杂志),2009,18(20):9.
2 He QT(贺青提),Zhang S(张松).Advances in the studies on the mechanism of immuno-potentiation effect of polysaccharides from edible-medicinal fungi.Acta Edulis Fungi(食用菌学报),2004,11(2):52-58.
3 Chen J(陈健),Huang YH(黄媛恒),Wang NP(王乃平),et al.玉郎伞多糖和皂苷对氧自由基清除作用研究.Pharmacol Clinics Chin Mater Med(中药药理与临床),2007,23:100-102.
4 Cai WE(蔡文娥),Zhang XD(张绪东),Huang RB(黄仁彬),et al.Study on immunological effect of Yulangsan polysaccharides.Lishizhen Med MaterMed Res(时珍国医国药),2011,22:1681-1683.
5 Yang Y(杨颖),Cai W(蔡玟),Huang JM(黄俊明).The effect of two forms of extracts of Radix Panacis Quinquefolii on immunomodulatory of mice.South China J Prevent Med(华南预防医学),2003,1:15-17.
6 Wang YF(王玉凤),Feng LY(凤良元),Yan SQ(鄢顺琴),et al.Effect of Fructus Broussonetiae on immunological function in immunosuppressive mice induced by cyclophosphamide.Chin Arch Tradit Chin Med(中华中医药学刊),2008,26:1023-1025.
7 Koike M,Sekigawa I,OkadaM,et al.Relationship betweenCD4(+)/CD8(+)T cell ratio and T cell activation in multiple myeloma:reference to IL-16.Leuk Res,2002,26:705-711.
8 Al-Sakkaf L,Pozzilli P,Tarn AC,et al.Persistent reduction of CD4/CD8 lymphocyte ratio and cell activation before the onset of type 1 (insulin-dependent)diabetes.Diabetologia,1989,32:322-325.
9 Li R(李荣),Li J(李俊),Hu CM(胡成穆),et al.Immunomodulative effect of hesperidin on immunodepressed mice.Chin Pharm Bull(中国药理学通报),2007,23:169-172.

