米黑毛酶提高大豆分离蛋白泡沫稳定性的研究
陈 卓 侯俊杰 杨晓泉
米黑毛酶提高大豆分离蛋白泡沫稳定性的研究
陈 卓 侯俊杰 杨晓泉
(华南理工大学轻工与食品学院食物蛋白质工程研究中心,广州 510640)
通过测定不同水解pH条件、不同水解时间、不同搅打起泡pH条件下大豆分离蛋白(SPI)的泡沫稳定性,结合SDS-PAGE分析,水解度分析及蛋白分子表面疏水性分析,为利用米黑毛酶水解大豆分离蛋白制备高泡沫稳定性大豆蛋白制品提供一定的理论依据。显示结果表明:SPI经米黑毛酶在pH 3.5处水解45~60 min后,回调pH至5.0搅打起泡的泡沫稳定性最优;随水解时间增长,SPI的泡沫稳定性有不同程度提高。通过酶解作用,伴随SPI的蛋白分子量减小,蛋白分子表面疏水性增加,泡沫的稳定性显著提高。
米黑毛酶 大豆分离蛋白 泡沫稳定性
大豆分离蛋白具有高营养价值和良好功能性质,在食品工业中的应用日趋广泛。大豆分离蛋白分子包含疏水性基团和亲水性基团,因而具有表面活性,能降低水的表面张力[1],在剧烈搅拌时形成泡沫,常用作食品中的乳化剂和界面稳定剂。同时在搅打稀奶油、冰淇淋、巧克力等充气食品中,蛋白质的泡沫性能对食品的结构起了重要的稳定作用[2]。
改善蛋白泡沫性能的3个关键因素是:减小蛋白分子量,增大蛋白分子表面疏水性以及改变蛋白分子的微结构[3]。相较于安全性不高的磷酸化法[4],蛋白质的酶法水解可以在不降低营养价值的前提下改善其理化和功能性质,且反应高效、温和、安全,是改善蛋白功能特性的更优手段。现有酶法水解技术虽然可以显著提高大豆蛋白的起泡能力,但同时也会降低其泡沫稳定性[5-6]。一般来说,提高起泡特性既要提高其起泡能力又要提高其泡沫稳定性,而对于蛋白质来说,提高其泡沫稳定性更有意义。
米黑毛酶能迅速、专一地打开 k-酪蛋白的Phe105-Met106键,作为凝乳酶广泛应用于制作干酪[7],但其在植物蛋白方面的应用报道较少。
在前人对米黑毛酶的高效凝乳作用机理的研究基础上[8-9],本研究试想利用米黑毛酶专一地打开SPI中某些化学键,使水解产物中亲水性和疏水性侧链基团的存在状态及分布发生变化,从而提高泡沫稳定性。本试验对不同水解pH条件、不同水解时间、不同搅打起泡pH条件下,SPI水解产物的泡沫稳定性进行了试验分析,结合SDS-PAGE分析,水解度分析及蛋白分子表面疏水性分析,探讨了利用米黑毛酶水解SPI制备高泡沫稳定性大豆蛋白制品的理论依据。本研究旨在开发一种高泡沫稳定性的大豆蛋白制品,实现更有目的性地对蛋白质进行改性。
1 材料与方法
1.1 材料与仪器
低温脱脂大豆粕购于山东禹王有限公司,粉碎过80目筛后储存于4℃下密闭容器中。豆粉蛋白质质量分数为(55.5±0.4)%,氮溶指数84.0%。所用化学试剂均为分析纯。米黑毛酶(Marzyare 150MG)购于丹尼斯克有限公司。
UV2300紫外可见分光光度计、F-7000日立荧光光谱仪:日立(Hita chi)公司;pHs-3C数显 pH计:上海雷磁仪器厂;APV-1000高压均质机:丹麦APV公司;rapid N cube杜马斯定氮仪:法国Elementar公司;Alp Ha-4冷冻干燥机:德国 MATRIN CHRIST公司;PYCZ-30垂直板电泳仪:北京六一仪器厂。
1.2 试验方法
1.2.1 大豆分离蛋白的制备
采用碱溶酸沉法[10]制备大豆分离蛋白,杜马斯定氮法测得蛋白质量分数为(90.80±0.26)%,SDS-PAGE检测纯度可达90%以上。
1.2.2 水解产物的制备
系列1:1 g/mL SPI溶液 50 mL,90℃水浴 30 min,冷却到室温,调 pH至3.5,加入0.2%米黑毛酶,于50℃水浴条件下反应,每隔15 min进行取样。水浴过程中通过滴加 1 mol/L HCl(1 mol/LNaOH)保持反应pH于3.5。样品85℃水浴15 min灭酶。
系列2:酶的底物调pH至7.0,水解反应保持pH于7.0,其他同系列1。
1.2.3 泡沫稳定性的测定
1 g/mL SPI溶液及不同酶水解的产物分别调pH至5.0和7.0,每份样品于转速12 000 r/min均质2 min。均质后快速倾倒至量筒,记录泡沫体积及泡液混合物总体积,计算泡液比。

1.2.4 聚丙烯酰胺凝胶电泳(SDS-PAGE)
根据Laemmli[11]的方法进行 SDS-PAGE分析,浓缩胶和分离胶质量浓度分别为5 g/mL和12 g/mL,考马斯亮蓝R-250染色。样品浓度为0.2,上样量为7μL。每条带的相对分子质量使用 Sigmamarker(Mr 14 400~97 400)作为标准相对分子质量标定。
1.2.5 水解度的测定
根据Nielsen[12]的方法进行水解度测定。OPA试剂:将7.620 g硼砂和200 mgSDS溶于重蒸水,然后定容至150 mL,摇匀配制成A液;160 mgOPA溶于4 mL乙醇制成B液;将B液加入A液,混合均匀,再加入176 mg DTT,定溶至200 mL,避光保存。样品为水解液40μL,稀释10倍后加入3 mLOPA试剂,混合均匀,37℃水浴2 min,在波长340 nm处测定吸光值。标准溶液为400μL丝氨酸溶液(质量浓度0.1 mg/mL)加入3 mL OPA试剂。空白组为400μL去离子水加入3 mL OPA试剂。

式中:X为样品中蛋白质含量,P为样品中蛋白质量分数,α=0.970,β=0.342,htot=7.8。
1.2.6 表面疏水性的测定(荧光探针ANS法)
表面疏水性是用1-苯氨基萘-8-磺酸(ANS)作为荧光探针进行测定[13]。将 1 g/mL SPI酶解液稀释成0.2 mg/mL酶解液样品。将浓度为 2.5 mmol/L的10μL ANS溶液分10次(每次1μL)加入8 mL样品溶液。使用荧光光谱仪分别在390 nm(激发波长)和470 nm(发射波长)下测定荧光强度。电压600 mV。每个样品平行测定5次。样品的荧光强度值扣除试剂空白值即为蛋白的相对荧光强度值F。已加入样品中的ANS的浓度记作L0。并以1/F和1/L0作回归曲线,计算表面疏水性指数(PSH)。

式中:Fmax为最大荧光强度,Kd为表面电离常数;
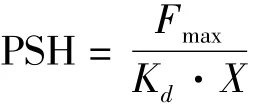
式中:X=0.2 mg/mL。
1.2.7 数据的统计与分析
除特殊说明外,每个试验均重复3次,每个测定均重复3次。结果表示为平均值±标准偏差。应用SPSS 11.5软件(SPSS Inc.,Chicago,IL,USA)中的One-Way ANOVA对所有数据进行方差分析,利用邓肯式多重比较对差异显著性进行分析;应用Pearson correlation test进行变量之间的相关性分析。P<0.05表示显著,P<0.01表示极显著。
2 结果与讨论
2.1 米黑毛酶对SPI水解度及组成的影响
2.1.1 水解度的分析
由图1结果可知,随着酶解时间增加,SPI的水解程度不断加深。在pH 3.5水解条件下米黑毛酶的水解效率较高,酶解60 min后水解程度最深,说明经米黑毛酶处理的SPI溶液,蛋白小分子数量增加较多,结合SDS-PAGE图谱,也可得到此结论。

图1 SPI经米黑毛酶在不同pH不同酶解时间处理后的水解度
2.1.2 SDS-PAGE电泳分析
由图2可知,在电泳图谱中,与原SPI样品相比,米黑毛酶于pH 7.0水解的样品中(图2:1~4),条带变化不明显,说明米黑毛酶在中性环境下,较难降解SPI各亚基。米黑毛酶于pH 3.5水解的样品中(图2:5~8),各亚基降解消失的程度明显,同时伴随有新的条带产生,酶解时间不同,SPI的蛋白小分子条带都有不同程度的增加。

图1 SPI经米黑毛酶在不同pH不同酶解时间处理后的SDS-PAGE电泳图谱
2.1.3 表面疏水性的分析
由表1可知,与SPI溶液相比,经米黑毛酶处理的样品的表面疏水性指数明显提升。分析认为,这是由于在酶处理过程中,维持大豆蛋白结构的次级键断开,埋藏于蛋白质分子内部的疏水基团暴露所致[14],从而提高了其表面疏水性。然而不同酶解时间的酶解液相比较,表面疏水性变化较小,有待进一步研究。
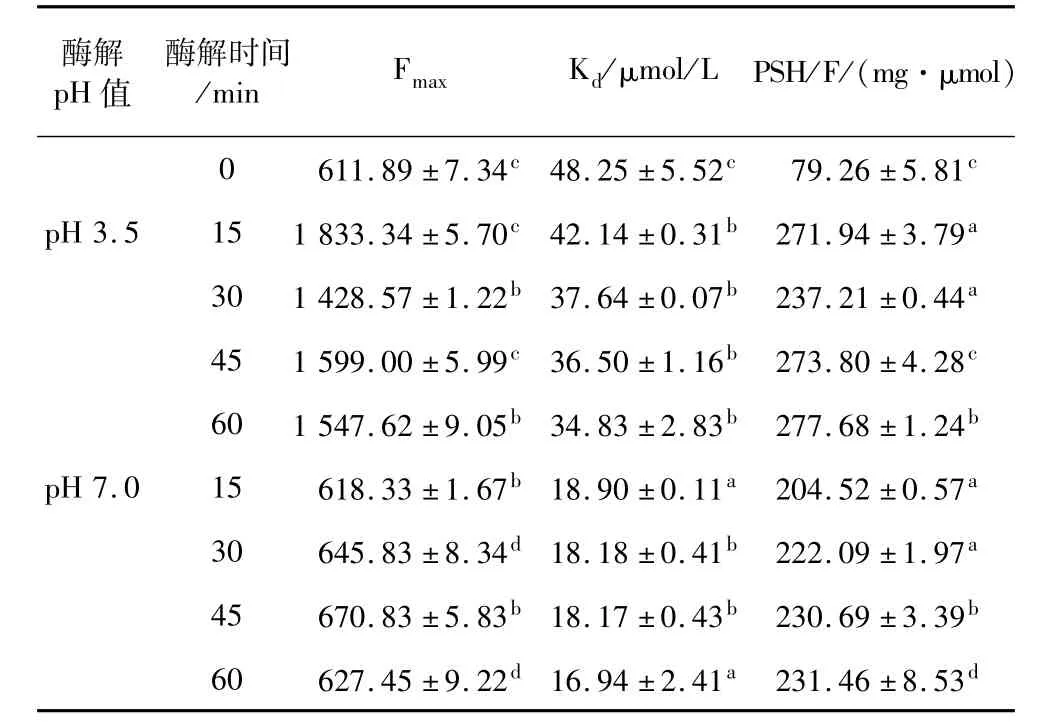
表1 SPI经米黑毛酶不同酶解条件处理的表面疏水性
2.2 pH 7.0酶解条件下米黑毛酶对SPI泡沫稳定性的影响
由图3结果可知,在pH 7.0中性条件下,SPI经米黑毛酶酶解不同时间后,再调至pH 7.0搅打起泡,随着时间的增加,泡沫稳定性急剧下降。由图4可知,若将酶解液调至pH 5.0搅打起泡,不同酶解时间的产物泡沫稳定性变化不明显,但都优于未经酶解的SPI溶液。总体分析认为,中性环境不利于米黑蛋白酶发挥活性。
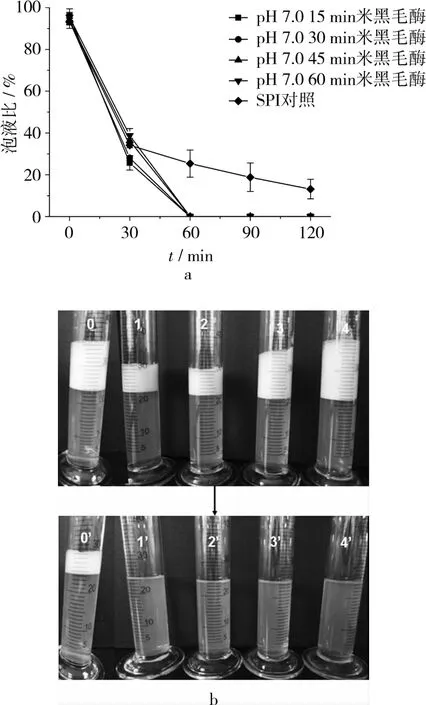
图3 pH 7.0处不同酶解时间米黑毛酶对SPI泡沫稳定性的影响(在pH 7.0处搅打起泡)


图4 pH 7.0处不同酶解时间米黑毛酶对SPI泡沫稳定性的影响(在pH 5.0处搅打起泡)
2.3 pH 3.5酶解条件下米黑毛酶对SPI泡沫稳定性的影响
由图5、图6结果可知,在pH 3.5酸性条件下,SPI经米黑毛酶酶解不同时间后,再调pH至7.0或5.0搅打起泡,随着时间增加,泡沫的稳定性也依次增加。由图5可知,SPI在pH 3.5处酶解45 min与酶解60 min的产物相比,泡液比没有明显变化,基本稳定在45%附近。由图6可知,若将酶解产物再回调pH至5.0搅打起泡,产物的泡液比最高能保持在50%附近,泡沫稳定性得到很大提高。
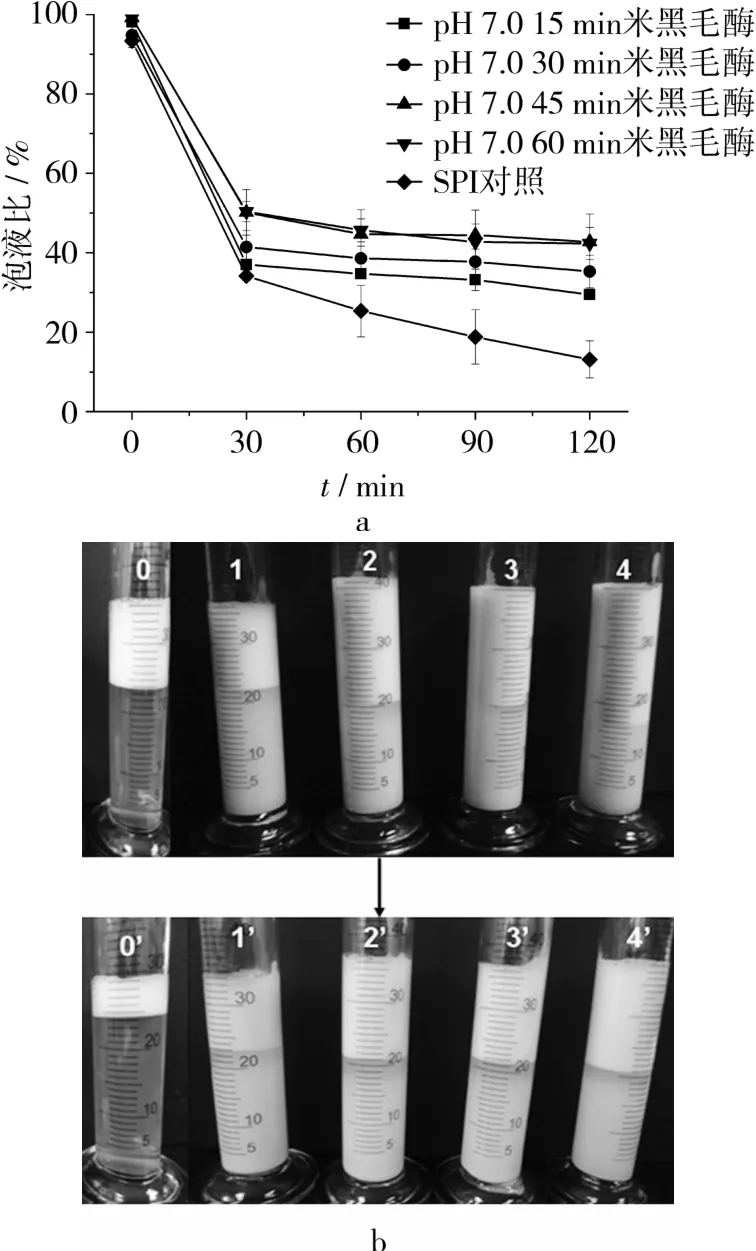
图5 pH 3.5处不同酶解时间米黑毛酶对SPI泡沫稳定性的影响(在pH 7.0处搅打起泡)

图6 pH 3.5处不同酶解时间米黑毛酶对SPI泡沫稳定性的影响(在pH 5.0处搅打起泡)
由图3~图6结果分析认为,米黑毛酶更适宜应用到酸性食品中,在中性食品中泡沫稳定性的改变并不显著。同时,在接近SPI等电点的pH 5.0处搅打起泡,泡沫稳定性都优于pH 7.0处搅打起泡的泡沫稳定性。分析认为,溶液pH值接近等电点时,产生的凝聚物有利于提高泡沫稳定性,且此时的泡沫均匀黏稠,气泡细密较小。综合SDS-PAGE、水解度、表面疏水性三者结果,分析认为,通过米黑毛酶在酸性条件下对SPI的水解,可以在一定程度上降低蛋白分子量,增加蛋白分子表面疏水性,达到提高泡沫稳定性的目的,这与Duyer等[3]的研究结果基本一致。
3 结论
本研究尝试利用米黑毛酶专一地打开SPI中某些化学键,使水解产物中亲水性和疏水性侧链基团的存在状态及分布发生变化,从而提高泡沫稳定性。在保持大豆蛋白良好的起泡能力的前提下,显著提高了泡沫稳定性,且效果持久明显,实现了更加有目的性地对蛋白质进行改性,提高了大豆蛋白的功能特性,有助于拓宽其在食品工业中作为配料应用的范围。
研究结果表明,SPI经米黑毛酶在pH 3.5处水解45~60 min后,回调pH至5.0搅打起泡的泡沫稳定性最优;随水解时间增长,SPI的泡沫稳定性有不同程度提高;酶解液在pH 5.0处搅打起泡的泡沫稳定性优于在pH 7.0处搅打起泡。通过酶解作用,伴随SPI的蛋白分子量减小,蛋白分子表面疏水性增加,泡沫的稳定性提高。
[1]王金梅.大豆蛋白热聚集行为及界面、乳化性质研究[D].广州:华南理工大学,2012
[2]丁汀.高乳化性大豆蛋白的制备及其应用研究[D].广州:华南理工大学,2011
[3]Dwyer M D,He Lizhong,Michael James,et al.The effects of acid hydrolysis on protein biosurfactant molecular,interfacial,and foam properties:pH responsive protein hydrolysates[J].Soft Matter,2012,8(19):5131-51399
[4]莫文敏,曾庆孝.蛋白质改性研究进展[J].食品科学,2000,21(6):6-10
[5]Yuan Boen,Ren Jiaoyan,Zhao Mouming,et al.Effects of limited enzymatic hydrolysis with pepsin and high-pressure homogenization on the functional properties of soybean protein isolate[J].LWT-Food Science and Technology,2012,46(2):453-459
[6]陈洁,何志勇,唐学燕,等.一种高效大豆蛋白起泡剂的制备方法:中国,200810195988.6[P].2009-02-18
[7]姜峰,张兰威.我国凝乳酶特性及其替代品的研究现状[J].食品研究与开发,2003,24(6):3-6
[8]Channe P S,Shewale JG.Influence of culture conditions on the formation of milk-clotting protease by Aspergillus niger MC4[J].World JMicrobiol Biotechnol,1998(14):11-15
[9]Hashem A M.Optimization of milk-clotting enzyme productivity by Penicillium oxalicum[J].Bioresource Technology,1999(70):203-207
[10]Iwabuchi S,Yamauchi F.Determination of glycinin-in andβ-conglycinin in soybean proteins by 8 mmol/L-une mological methods[J].Journal of Agricultural and Food Chemistry,1987,35(2):200-205
[11]Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227:680-685
[12]Nielsen P M,Petersen D,Dambmann C.Improved method for determining food protein degree of hydrolysis[J].Journal of Food Science,2001,66(5):642-646
[13]Wang Jinmei,Yang Xiaoquan,Yin Shouwei,et al.Structural rearrangement of ethanol-denatured soy proteins by high hydrostatic pressure treatment[J].Journal of Agricultural and Food Chemistry,2011,59(13):7324-7332
[14]Sun Xiangdong.Enzymatic hydrolysis of soy proteins and the hydrolysates utilisation[J].International Journal of Food Science and Technology,2011,46(12):2447-2459.
The Enhancement Effects of Mucor Miehei on the Foam Stability Properties of Soybean Protein Isolate
Chen Zhuo Hou Junjie Yang Xiaoquan
(Research and Development Center of Food Proteins,College of Light Industry and Food Sciences,South China University of Technology,Guangzhou 510640)
The foam stability properties of SPI were measured at different pH and different time in this study with the analysis on the SDS-PAGE,degree of hydrolysis and surface hydrophobicity,providing theoretical foundation for the SPI products with high foam stability prepared by Mucor miehei.The results showed that the sample with the best foam stability properties was hydrolysed by Mucor miehei at pH 3.5 for 45~60 min;then it turned pH to 5.0.With the increase of time,the foam stability properties of SPI were improved at different degree.Through enzymatic hydrolysis,the foam stability properties of SPI were enhanced substantially with the decrease of SPI protein molecule weights and the increase of surface hydrophobicity.
soybean protein isolates,Mucor miehei,foam stability
TS21
A
1003-0174(2014)03-0052-05
“十二五”国家科技支撑计划(2012BAD33B10-2,2012BAD34B04-2),国家自然科学基金(31130124)
2013-04-17
陈卓,女,1989年出生,硕士,植物蛋白加工与利用
杨晓泉,男,1965年出生,教授,博士生导师,植物蛋白加工与利用

