慢性淋巴细胞性白血病患者miR-9 -3 甲基化异常及其意义
周 毅 任国敏 杨聪慧 任春霞 孟庆鹏
DNA 甲基化是指通过化学修饰在DNA 甲基转移酶的作用下,以S -腺苷甲硫氨酸(SAM)为甲基供体,将甲基(-CH3)基团转移到胞嘧啶和鸟嘌呤(CpG)二核昔酸胞嘧啶的5'位碳原子上,导致5 -甲基胞嘧啶的形成[1]。肿瘤抑制基因CpG 岛相关启动子的基因特异性DNA 甲基化是众多人类肿瘤标志物[2-3]。多个肿瘤抑制基因的甲基化涉及白血病,淋巴瘤和骨髓瘤的信号通路的失调,由此表明肿瘤抑制基因的甲基化在血液癌症发病机制中的重要性[4-6]。值得注意的是,肿瘤抑制基因DNA 甲基化在慢性淋巴细胞性白血病的发病或预后中发挥作用[7]。慢性淋巴细胞白血病是欧美成人最常见的白血病类型,我国较少见,为主要源于B 淋巴细胞的单克隆性小淋巴细胞疾病[8]。在本实验中,采用甲基化特异性聚合酶链反应(MSP)技术研究了miR -9 -3 的甲基化,旨在确定其在慢性淋巴细胞性白血病的致病作用。
1 材料与方法
1.1 研究对象
慢性淋巴细胞性白血病共78 例,均来自内蒙古牙克石市人民医院。男51 例(65.4%),女27 例(34.6%),年龄37~91 岁,平均年龄65.0 岁,经诊断符合白血病FAB 国际诊断标准。所有病例均为新诊断且未接受过放化疗、诱导分化及骨髓移植等特殊治疗。采集肝素抗凝骨髓1 ~2 ml/份,收集骨髓单个核细胞,于-80℃保存。8 例正常供髓者单个核细胞设为对照组(取自健康志愿者外周血B 细胞CD19,N =3;取自健康志愿者外周血血浆,N =2;取自健康志愿者骨髓单个核细胞,N=3)。
1.2 细胞株培养
人类白血病细胞株CLL-AAT、MEC1、MEC2、I83 -E95、WAC3CD5 +、HG3 和232B4 由内蒙古牙克石市人民医院血液病科赠送。细胞分别保存在含有10%胎牛血清的RPMll640 营养培养基(含青霉素100 U/ml 和链霉素100 ug/ml),置于320%O2、5%CO2、37℃培养箱培养的细胞培养箱培养。每48 ~72 h 用含有0.02%EDTA、0.01%胰蛋白酶的消化液消化后,进行常规传代培养。实验采用对数生长期细胞。
1.3 甲基化特异性聚合酶链反应(MSP)
按照QIAampDNAMini Kit(QIAGEN,Germany)的操作步骤结合DNA/RNA 提取仪(QIAcube)输入程序即可快速抽提78 例慢性淋巴细胞性白血病患者骨髓标本和7 种慢性淋巴细胞性白血病细胞株DNA,同样方法提取8 例正常对照提取DNA。每个样品用两组引物,其中一个针对修饰的甲基化DNA(M),另一个是针对修饰的未甲基化DNA(U)。重亚硫酸氢盐处理:加入新鲜配制的20 mmol /L 氢醌12.6 ul 和4.8 mol/L 亚硫酸氢钠(pH =5.0)320 ul,PCR 仪上进行下面循环:55 ℃15 min,95 ℃30 s,一共20 个循环。以EZ DNA Methylation kit 对基因组DNA 进行修饰。修饰后的DNA 溶解于20 ul 的M-Elution Buffer,反应产物在20g/L 的琼脂糖凝胶上电泳,在紫外灯下观察结果。
1.4 MSP 测序
首先应用亚硫酸钠对DNA 进行化学修饰,并用作模板,MSP 检测miR -9 -3 基因启动子区DNA 序列。将DNA 中所有未甲基化的胞嘧啶(C)转化成为胸嘧啶(T),但有甲基化修饰的C 经亚硫酸钠处理后仍保持为C。该步骤应用EpiTect Bisulfite Kit(QIAGEN,Germany),按照说明书完成。使用PSQ 检测设计软件设计引物。正向引物:5' -GAAGGGGGTTGGGATTTGA -3';反向引物:5' - ATTTCTCCCCTACTCCCC-3'。
1.5 5 -氮杂-2' -脱氧胞苷(5 -AzaDc)处理
取细胞在对数生长期的I83 -E95 和WAC3CD5 +细胞株,按照1 ×106个细胞/ml 的密度接种于含10%小牛血清的RPMI-1640 培养液,5%CO2、37℃的条件下培养。用终浓度为0.5 uM 的5 -AzaDc 处理,每24 h 更换新鲜的5 -AzadC,在第0 天和第5 天分别收获细胞。
1.6 Western blot 检测NF-κB1
I83 -E9548 细胞株转染48 h 后收集细胞。加入RIPA裂解液(50 mM 的Tris -HCl,pH =7.4,150 mM 氯化钠,0.2%SDS,1%TritonX-100,2 mM EDTA),Bradford 法测定蛋白浓度,取20 ug 蛋白,进行10%SDS -PAGE 电泳。电泳完毕后,PAGE 胶上的蛋白用Bio -Rad 微型电转移至0.2 um 的硝酸纤维素膜上。硝酸纤维素膜加入NF -κB1,4℃下孵育24 h,然后将膜洗涤,加入抗兔辣根过氧化物酶标记的抗兔二抗,室温下反应1 h 洗膜,曝光,X -胶片经显影、定影后扫描记录。以Anti-actin 为内对照。
2 结果
2.1 慢性淋巴细胞性白血病miR-9 -3 的MSP 结果
78 例慢性淋巴细胞性白血病患者中65 例miR-9 -3 甲基化,MSP 阳性率为83%(见图1);所有8 例正常对照组(N1至N8)miR-9 -3 全部呈未甲基化状态(见图2);7 种慢性淋巴细胞性白血病细胞株miR -9 -3 甲基化表达谱显示:I83 -E95 和WAC3CD5 +细胞株显示miR -9 -3 完全甲基化,232B4,CLL-AAT 和HG3 部分甲基化,而MEC1 和MEC2完全未甲基化(见图3)。miR -9 -3MSP 产物序列分析显示,与miR-9 -3 原序列相比,除了甲基化的C 外,所有的C均被转化为T,而CpG 位点中被甲基化的C 未被转化。说明我们的转化方案不仅是高效的,也是特异的(见图4)。
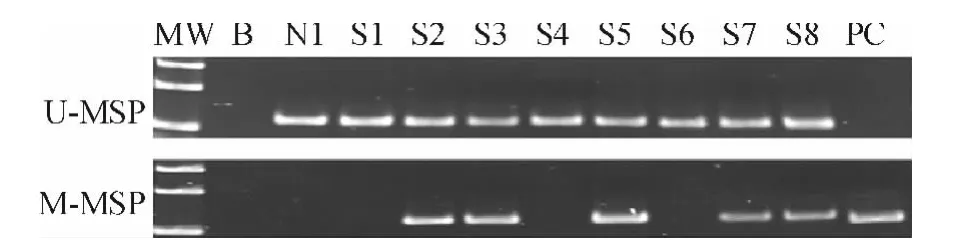
图1 慢性淋巴细胞性白血病患者的miR-9 -3MSP 结果

图2 对照组的miR-9 -3MSP 结果
2.2 5 -AzaDc 对miR-9 -3 甲基化程度的影响
结果表明,处理前I83 -E95 和WAC3CD5 +细胞株miR-9 -3 呈甲基化状态,而用5 -AzaDc 处理后,I83 -E95 和WAC3CD5 +细胞株miR-9 -3 呈未甲基化状态。

图3 慢性淋巴细胞性白血病细胞株的miR-9 -3MSP 结果
2.3 转染miR-9 -3 对I83 -E9548 细胞株NF -κB1 蛋白水平的影响
I83-E9548 细胞株转染48h 后收集细胞,提取细泡的蛋白,采用用Western blot 法来比较各组细胞内NF -κB1 蛋白P105 和P50 的含量。转染miR -9 - 3 后NF - κB1 蛋白P105/50 表达水平降低。如图6 所示,miR -9 -3 组与对照组相比NF-κB1 蛋白水平降低。

图4 miR-9 -3 基因启动子区DNA 序列MSP 测序结果
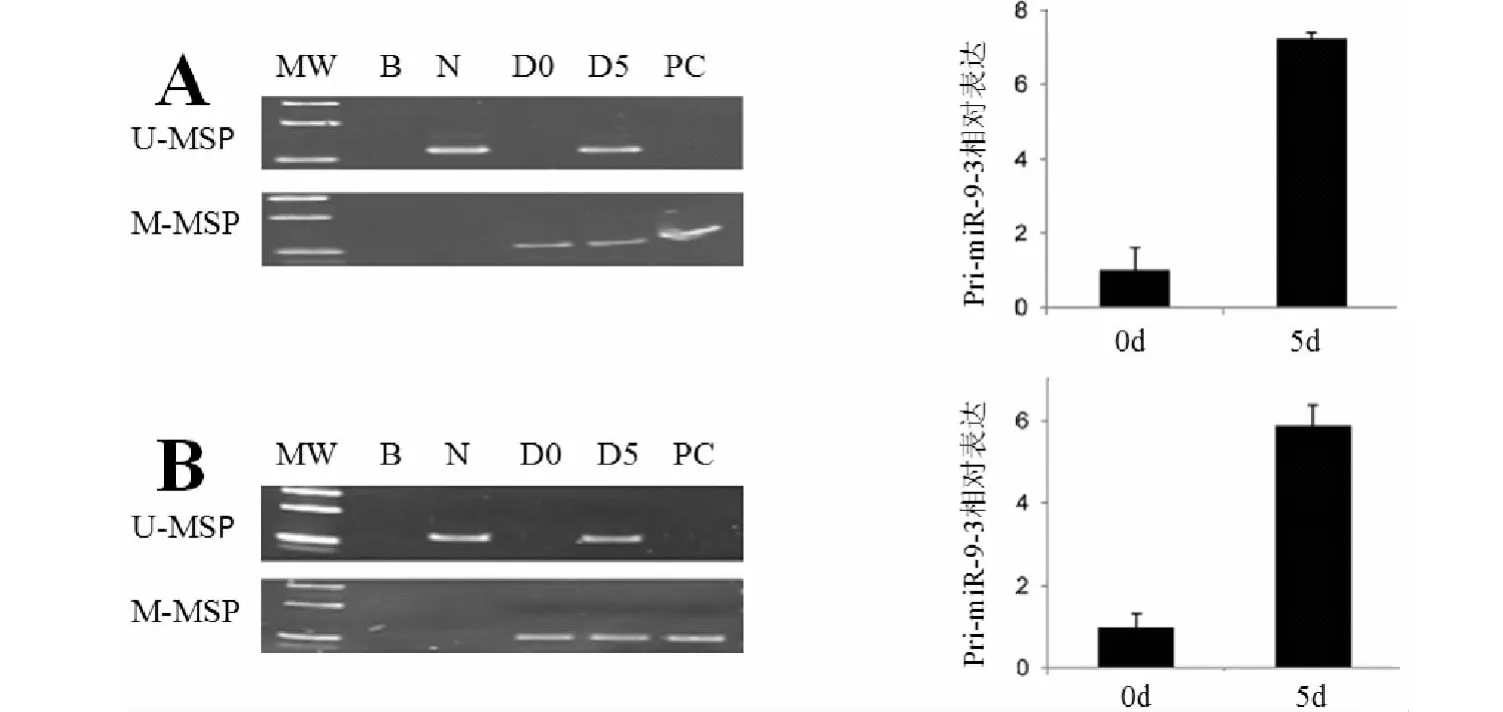
图5 5 -AzadC 对I83 -E95 和WAC3CD5 +细胞株治疗作用

图6 I83 -E9548 细胞株NF-κB1 蛋白水平的变化
3 讨论
成熟的microRNA(miRNA)是一类长度约21 -25nt 的真核生物内源性非编码单链RNA 分子,它在细胞内通过碱基互补与相应的信使RNA(mRNA)的3’- 非编码区(3’-URT)结合,使其降解或抑制其翻译,在细胞的分化、增生、凋亡、个体发育及机体代谢中起着重要作用[9],其功能是抑制其靶蛋白的表达[10]。在癌变过程中,miRNA 可分为致癌基因和抑癌基因的miRNA[9]。最近研究表明,癌症患者抑癌基因的miRNA 异常DNA 甲基化沉默。以往的研究还确定一些抑癌基因的miRNA 甲基化参与慢性淋巴细胞性白血病发病,其中包括了miR -203,miR -124 -1,miR -181a/b,miR-107 和miR-424[10]。
在人类中,有三个独立的miR-9 基因(miR -9 -1 位于1 号染色体上;miR-9 -2 位于5 号染色体上;miR -9 -3 也位于5 号染色体上)具有相同的miR -9 序列。miR -9 即可以是致癌基因的miRNA 也可以是抑癌基因的miRNA,取决于癌症或组织类型[11]。例如,miR -9 过表达已被证明能提高乳腺癌细胞或胶质母细胞瘤转移或侵袭,表现为致癌作用,反之,miR-9 通过结合于3'非翻译区(3'非编码区)的NF-κB1 的mRNA,抑制NFκB1 翻译卵巢肿瘤细胞,从而抑制细胞增殖,因此表现出肿瘤抑制功能。本实验主要研究miR-9 独立基因之一miR-9 -3 的甲基化。
本实验发现,在I83 -E95 细胞株miR -9 -3 完全甲基化导致细胞增殖减少并且增强凋亡。
I83 -E95 和WAC3CD5 +细胞株处理前二者均呈高甲基化状态,而5 -AzadC 处理后都发生脱甲基化,呈未甲基化状态。这些都说明5 -AzaDc 具有诱导miR-9 -3 去甲基化的能力,这种能力可能与5 -AzaD 降低了miR -9 -3 表达有关。有人认为5 -AzaDc 作用机制是先与靶基因结合,再与DNA 甲基转移酶结合,形成一个不可逆的复合体,从而阻断甲基转移酶的活性。
有研究表明[12],miR-9 -3 可以通过调控NF -κB1 蛋白抑制慢性淋巴细胞性白血病细胞的生长,miR -9 -3 在慢性淋巴细胞性白血病细胞中是低表达的,而增加miR -9 -3可以抑制细胞的体外生长,另外miR -9 -3 直接作用于NF-κB1 的3’UTR 区,说明NF -κB1 是慢性淋巴细胞性白血病中miR-9 -3 的重要的靶点,当miR -9 -3 高表达时NF-κB1 的mRNA 和蛋白都被抑制。在慢性淋巴细胞性白血病中是否也存在这种相关,本实验设想通过减弱或抑制miR-9 -3 的表达,观察其对慢性淋巴细胞性白血病细胞NF -κB1 的表达,为下一步慢性淋巴细胞性白血病的基因治疗奠定实验基础。
[1] ESTELLER M. Epigenetics in cancer[J]. N Engl J Med,2008,358:1148 -1159.
[2] CHIM CS,LIANG R,KWONG YL.Hypermethylation of gene promoters in hematological neoplasia[J]. Hematol Oncol,2002,20:167 -176.
[3] JONES PA,BAYLIN SB:The epigenomics of cancer[J]. Cell,2007,128:683 -692.
[4] GONZALEZ-ZULUETA M,BENDER CM,YANG AS,NGUYEN TD,et al. Methylation of the 5' CpG island of the p16/CDKN2 tumor suppressor gene in normal and transformed human tissues correlates with gene silencing[J]. Cancer Res,1995,55:4531 -4535.
[5] CHIM CS,PANG R,FUNG TK,CHOI CL,LIANG R.Epigenetic dysregulation of Wnt signaling pathway in multiple myeloma[J]. Leukemia,2007,21:2527 -2536.
[6] CHIM CS,FUNG TK,WONG KF,LAU J,LIANG R:Frequent DAP kinase but not p14 or Apaf -1 hypermethylation in B -cell chronic lymphocytic leukemia[J].J Hum Genet,2006,51:832 -838.
[7] RAVAL A,TANNER SM,BYRD JC,ANGERMAN EB,et al.Downregulation of Death-Associated Protein Kinase 1 (DAPK1)in Chronic Lymphocytic Leukemia[J]. Cell,2007,129:879 -890.
[8] 姚玉芹,薛重重,杨丽萍. CD40 -CD40L 与B 细胞肿瘤治疗研究进展[J].现代医院,2013,13(5):17 -19.
[9] 黄秀颜,徐 新. miRNA 与心律失常[J]. 现代医院,2013,13(9):11 -131.
[10] CALIN GA,CROCE CM. MicroRNA signatures in human cancers[J]. Nat Rev Cancer,2006,6:857 -866.
[11] CHEN CZ. MicroRNAs as oncogenes and tumor suppressors[J].N Engl J Med,2005,353:1768 -1771.
[12] WANG LQ,LIANG R,CHIM CS. Methylation of tumor suppressor microRNAs:lessons from lymphoid malignancies[J]. Expert Rev Mol Diagn,2012,12:755 -765.
[13] TSAI KW,LIAO YL,WU CW,HU LY,LI SC,CHAN WC,et al. Aberrant hypermethylation of miR -9 genes in gastric cancer[J].Epigenetics,2011,6:1189 -1197.
[14] ZHANG H,QI M,LI S,QI T,MEI H,et al.microRNA-9 targets matrix metalloproteinase 14 to inhibit invasion,metastasis,and angiogenesis of neuroblastoma cells[J]. Mol Cancer Ther,2012,11:1454 -1466.

