血清及腹水肿瘤标志物对良恶性腹水的鉴别诊断价值*
窦 倩, 商海涛, 叶 进, 徐可树, 侯晓华, 宋宇虎, 刘 芳
华中科技大学同济医学院附属协和医院 1消化内科2血液内科,武汉430022
腹水是一种病因较多、较常见的临床体征,其常见的病因有肝硬化、结核性腹膜炎、恶性肿瘤、心功能衰竭、肾病综合征、胰腺炎、窦状隙闭塞综合征、Budd-Chiari综合征、手术后淋巴漏[1]。在各种病因中,恶性肿瘤约占腹水病因的10%~20%[2]。因此,鉴别良性和恶性腹水对疾病的诊断、治疗及预后有重要意义。
肿瘤标志物是肿瘤细胞和组织产生并释放的物质,常以抗原、酶、激素等代谢产物的形式存在于肿瘤细胞内或宿主体液中,根据其生化或免疫特性可以识别或诊断肿瘤,因此在临床上得到广泛运用[3-5]。近些年来,部分研究利用肿瘤标志物来鉴别良恶性腹水,但此类回顾性研究病例数较少,且部分结论存在差异,其临床运用价值受到限制。鉴于此,本研究收集435例不同病因且诊断明确的良恶性腹水患者的临床资料,分析血清及腹水肿瘤标志物(CEA、CA19-9、CA12-5、CA15-3),以探讨其在鉴别诊断良恶性腹水中的价值。
1 资料与方法
1.1 一般资料
回顾性分析2002至2012年就诊于华中科技大学同济医学院附属协和医院及青岛大学附属医院的腹水患者,总计435例。良性腹水患者224例,分为两组:门脉高压组(160例),非门脉高压组(64例)。门脉高压组包括肝硬化(含乙肝、丙肝、乙醇性、血吸虫、自身免疫性、非乙醇性脂肪肝、隐源性肝硬化)151例、心力衰竭1例、布加氏综合征6例、肝小静脉闭塞2例。非门脉高压组包括结核性腹膜炎58例、急性胰腺炎2例、肾病综合征1例、继发性腹膜炎2例、结缔组织病1例。恶性腹水患者211例,包括胃癌54例、结肠癌18例、胰腺癌14例、肝癌10例、胆管癌5例、妇科肿瘤28例、腹膜浆液性黏液癌6例、腹膜间皮瘤1例、肺癌1例和不明来源的恶性肿瘤74例。所有患者均经临床及病理学证实为良性或恶性腹水患者。原发性肝癌造成的恶性腹水诊断如下:①影像学检查(CT或/和MRI)或病理诊断证实;②排除胃肠道转移;③血清腹水白蛋白梯度(serum ascites albumin gradient,SAAG)低于1.1 g/L的,以此排除门脉高压造成腹水。
1.2 方法
所有患者(良性腹水组、恶性腹水组)均行腹腔穿刺术,检测血清及腹水肿瘤标志物(CEA、CA19-9、CA12-5、CA15-3)。腹水及血清 CEA、CA19-9、CA12-5、CA15-3检测均采用化学发光微粒子免疫检测 法 (Fujirebio Diagnostics Inc.,Malvern,PA 19355,USA)。
1.3 数据处理
应用SPSS 13.0软件进行统计分析,计量资料以均数±标准差(±s)表示,采用方差分析,计数资料以百分率表示,采用χ2检验,以P<0.05为差异有统计学意义。分析良性腹水组、恶性腹水组血清和腹水 CEA、CA19-9、CA12-5、CA15-3水平,并计算4种肿瘤标志物单独或联合检测诊断良恶性腹水的特异度、敏感度、诊断准确度。运用MedCalc统计软件绘制受试者工作特征曲线(receiver operating characteristic curve,ROC)。敏感度(%)=真阳性/(真阳性+假阴性)×100%;特异度(%)=真阴性/(真阴性+假阳性)×100%;诊断准确度(%)=(真阳性+真阴性)/(真阳性+真阴性+假阳性+假阴性)×100%。
2 结果
2.1 肿瘤标志物的分布情况
在本研究中,共收集435例有腹水的病例,良性腹水患者224例,恶性腹水患者211例。根据以往和本研究数据资料的ROC曲线(已投稿),我们首先预设腹水及血清肿瘤标志物的临界值:CEA为50ng/mL,CA19-9为 200U/mL,CA12-5为 350 U/mL,CA15-3为75U/mL。结果(表1)显示:恶性腹水的患者,其血清和腹水CEA、CA19-9、CA15-3高于临界值的比例明显高于良性腹水组,差异有统计学意义(均P<0.05);而血清和腹水CA12-5在良恶性腹水的患者中无明显差异(均P>0.05)。这就表明,血清和腹水肿瘤标志物CEA、CA19-9、CA15-3在良恶性腹水鉴别诊断中具有重要的参考价值。

表1 在预定的临界值范围内各种肿瘤标志物在良恶性腹水患者中阳性比率Table 1 The positive rate of tumor markers(within the predetermined cut-off values)in patients with benign or malignant ascites
2.2 肿瘤标志物单独及联合检测对恶性腹水诊断价值的评估
为了更好评价肿瘤标志物对恶性腹水的诊断价值,本文计算各种肿瘤标志物的诊断敏感度、特异度及准确度。血清CEA、CA19-9及CA15-3在诊断恶性腹水中敏感度较低、特异度高、诊断准确度波动于55%~69%;而3种肿瘤标志物的联合检测显示:在特异度无明显降低情况下,其诊断敏感度和准确度得到一定的提高;这表明,在良恶性腹水的鉴别诊断中,血清肿瘤标志物的联合检测明显优于单独检测(表2)。此外,我们进一步评估腹水肿瘤标志物的诊断价值。与血清类似,腹水肿瘤标志物的联合检测明显优于单独检测(表2)。在血清和腹水肿瘤标志物诊断价值的比较中,我们发现,腹水CEA、CA19-9和CA15-3的诊断特异度基本同于血清CEA、CA19-9和 CA15-3;而腹水 CEA、CA19-9和CA15-3的诊断敏感度和准确度却明显优于血清上述标志物。联合检测腹水肿瘤标志物,其诊断敏感度、特异度和诊断准确度为85.45%、97.32%和91.53%;这就表明:联合检测腹水肿瘤标志物对于良恶性腹水的鉴别诊断价值高,见表2。
2.3 肿瘤标志物的ROC曲线
为了更好评价肿瘤标志物的诊断价值,我们绘制各种肿瘤标志物的受试者工作特征曲线(ROC曲线)。如果ROC曲线下面积<0.7,则通过该指标不能有效进行鉴别诊断[6]。根据ROC曲线(图1),提示腹水CEA、CA19-9和 CA15-3可以作为鉴别良、恶性腹水的指标,其曲线下面积分别为0.91、0.88和0.79,其中腹水CEA诊断价值最高。
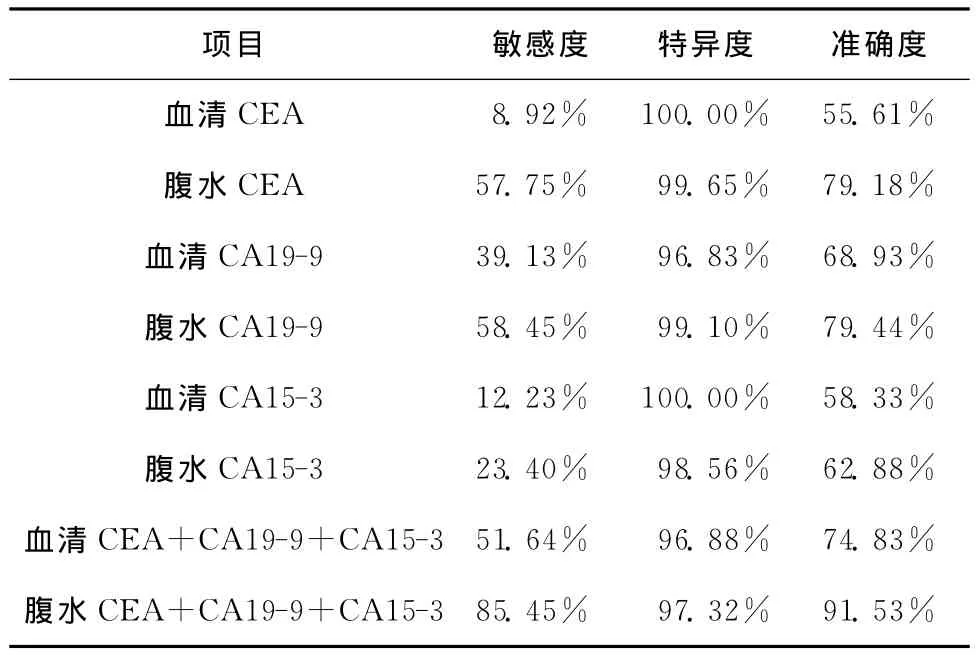
表2 良恶性腹水中血清和腹水肿瘤标志物的敏感度、特异度及诊断准确度Table 2 Sensitivity,specificity,and diagnostic accuracy of tumor markers in the serum or ascites of patients with benign or malignant ascites
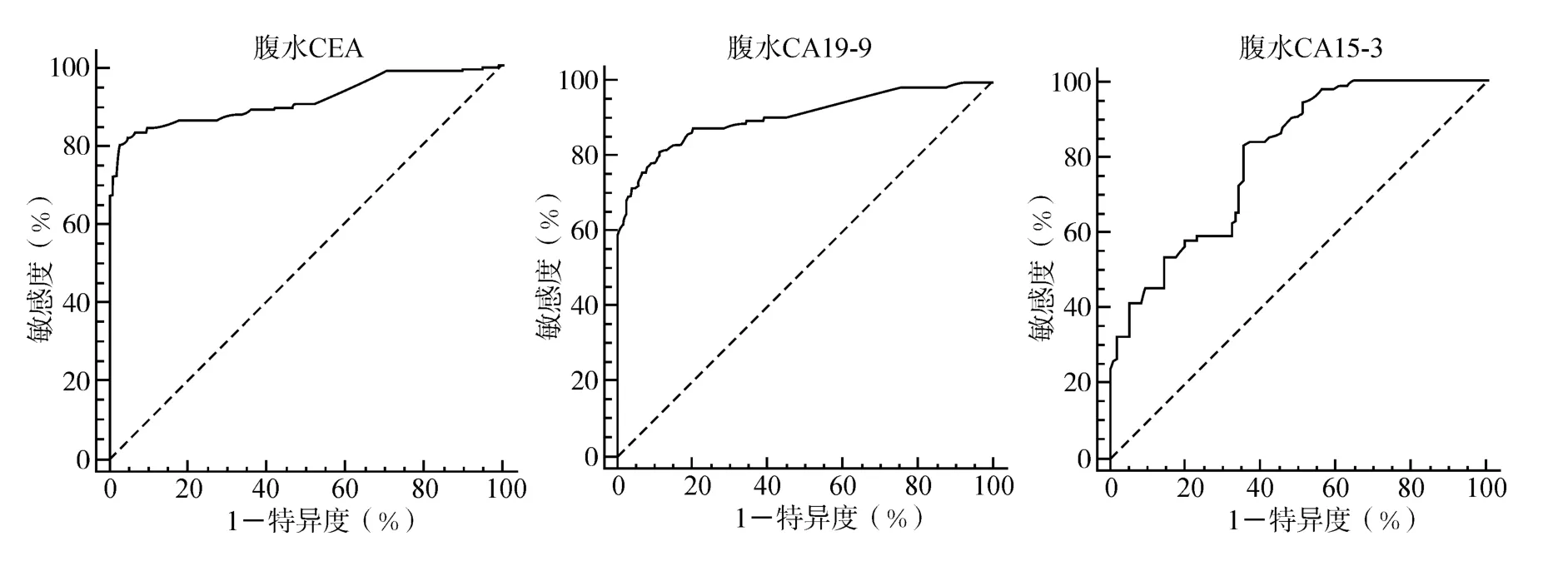
图1 腹水肿瘤标志物的ROC曲线Fig.1 ROC curves of ascitic tumor markers
3 讨论
恶性肿瘤为腹水的一个较常见的病因[7],细胞学检查被认为是诊断恶性腹水的“金标准”。腹水中的肿瘤细胞通常由腹膜转移而来,肿瘤细胞在淋巴转移过程中漏出或渗出到腹水中,其特异度高达100%,但敏感度仅为40%~60%[8]。因此筛选特异、敏感且方便应用于临床的诊断指标,是临床急需并具有实用意义的研究课题。肿瘤标志物在临床上主要用于对原发肿瘤的发现、肿瘤高危人群的筛选、良性和恶性肿瘤的鉴别诊断、肿瘤发展程度的判断、肿瘤治疗效果的观察和评价以及肿瘤复发和预后的预测等。鉴于此,血清及腹水肿瘤标志物已成为鉴别诊断良恶性腹水的重要策略之一。但因目前此类研究病例数较少,且部分结论存在差异,故诊断价值有待进一步评估。为进一步确定肿瘤标志物的诊断价值,我们建立较大规模的样本库(435例),评价血清和腹水肿瘤标志物单一和联合检测的诊断效能,进而确定其诊断价值。
在本研究中,恶性腹水患者血清及腹水肿瘤标志物CEA、CA19-9、CA15-3高于预定临界值的比例均显著高于良性腹水患者,差异有统计学意义(均P<0.05);而血清和腹水CA12-5,在良恶性腹水中无明显差异(均P>0.05)。CA12-5已经广泛应用于监测卵巢肿瘤的发生,是区分良恶性疾病的一种常用的非侵入性方法,但既往研究已经证实其在良恶性腹水的鉴别诊断中无意义,本研究亦验证此结论[9]。Tuzun等[10]研究提示,在恶性腹水中,血清和腹水肿瘤标志物相关性高,腹水检测并不优于血清检测。而本研究提示,对于良恶性腹水患者来说,腹水肿瘤标志物的诊断准确度高于血清肿瘤标志物,尤其是腹水CEA、CA19-9、CA15-3联合检测,其诊断准确度大大提高。因本研究样本量明显大于上述研究,且 Tuzun 等[10]和 Chen 等[11]研究发现 腹 水CEA水平明显高于血清CEA水平。因此,我们建议在临床实践中,需检测腹水肿瘤标志物,而并非仅仅检测血清肿瘤标志物。
为了评价腹水肿瘤标志物在良恶性腹水鉴别诊断中的优劣,我们绘制了ROC曲线。ROC曲线下面积(area under ROC curves,AUC)的大小表明了诊断试验准确度的大小,一般认为AUC在0.50~0.70诊断价值较低,在0.70~0.90时诊断价值中等,在0.90以上时诊断价值较高[6]。在本研究中,腹水CEA、CA19-9和 CA15-3曲线下面积分别为0.91、0.88和0.79,这就表明腹水CEA具有明确的诊断价值。
血清及腹水肿瘤标志物的单一项目检查,其诊断的敏感度较低;腹水肿瘤标志物联合检测(CEA+CA19-9+CA15-3),敏感度、特异度及准确度分别是85.45%、97.32%、91.53%,显示了优异的诊断效能;敏感度明显优于细胞学检测,特异度基本等同于细胞学检测;因此腹水肿瘤标志物的联合检测对于恶性腹水的诊断具有优异的诊断价值。
综上所述,在实际临床工作中,对良恶性腹水的鉴别诊断仍有一定的困难,腹水化验检查尤其是腹水肿瘤标志物联合检测具有重要的临床价值,其具有敏感度及特异度高、简单且无创的优点。
[1] Runyon B A.Management of adult patients with ascites due to cirrhosis[J].Hepatology,2004,39(3):841-856.
[2] Becker G,Galandi D,Blum H E.Malignant ascites:systematic review and guideline for treatment[J].Eur J Cancer,2006,42(5):589-597.
[3] Martinez-Vea A,Gatell J M,Segura F,et al.Diagnostic value of tumoral markers in serous effusions:carcinoembryonic antigen,alpha1-acidglycoprotein,alpha-fetoprotein,phosphohexose isomerase,and beta 2-microglobulin[J].Cancer,1982,50(9):1783-1788.
[4] Shahab N.Tumor markers in malignant ascites[J].Arch Intern Med,2002,162(8):949-950.
[5] Tuzun Y,Yilmaz S,Dursun M,et al.How to increase the diagnostic value of malignancy-related ascites:discriminative ability of the ascitic tumour markers[J].J Int Med Res,2009,37(1):87-95.
[6] Zweig M H,Campbell G.Receiver-operating characteristic(ROC)plots:a fundamental evaluation tool in clinical medicine[J].Clin Chem,1993,39(4):561-577.
[7] Runyon B A.Care of patients with ascites[J].N Engl J Med,1994,330(5):337-342.
[8] Pinto M M.CA-15.3assay in effusions:comparison with carcinoembryonic antigen and CA-125assay and cytologic diagnosis[J].Acta Cytol,1996,40(3):437-442.
[9] Runyon B A.Management of adult patients with ascites due to cirrhosis:an update[J].Hepatology,2009,49(6):2087-2107.
[10] Tuzun Y,Celik Y,Bayan K,et al.Correlation of tumour markers in ascitic fluid and serum:are measurements of ascitic tumour markers a futile attempt?[J].J Int Med Res,2009,37(1):79-86.
[11] Chen S J,Wang S S,Lu C W,et al.Clinical value of tumour markers and serum-ascites albumin gradient in the diagnosis of malignancy-related ascites[J].J Gastroenterol Hepatol,1994,9(4):396-400.

