离子液体(C14mimBr)在混合溶剂中胶束行为的研究
何 怡, 孙 蕾, 赵丹丹, 韩春玉, 刘春生, 罗根祥
(辽宁石油化工大学化学与材料科学学院,辽宁抚顺113001)
离子液体(ionic liquids)是低温(<100 ℃)下呈液态的,由较大的有机阳离子和阴离子构成的盐,也称作“室温熔融盐”[1-2]。与传统有机溶剂相比,离子液体具有液态温度范围宽、挥发性低、热稳定性好、毒性低、电导率较高、电化学窗口宽等特性[3-4]。离子液体因其独特的物理化学性质,使其作为选择性介质在催化、分离和电化学中发挥重要作用,并引起了广泛关注。M Moniruzzaman等[5]以阴离子表面活性剂双(2-乙基-1-己基)磺化琥珀酸钠(AOT)和离子液体型表面活性剂1-辛基-3-甲基咪唑双(三氟甲基磺酰)胺盐([Cnmim][Tf2N])为主表面活性剂,以正己醇为助表面活性剂,加入少量水形成离子液体包水型微乳液。该微乳液对很多生物酶和蛋白都有很好的溶解性。因此离子液体聚集行为的研究对理解离子液体如何在实际应用中发挥作用至关重要。
本文研究了乙二醇(EG)以及温度对于溴代-1-十四烷基-3-甲基咪唑(C14mimBr)在水溶液中胶束形成的影响。通过临界胶束浓度(CMC)、反离子缔合度(g)及热力学参数等研究离子液体在混合体系中的表面特性。
1 实验部分
1.1 试剂与仪器
试剂:乙二醇(分析纯,沈阳东兴化学试剂有限公司);N-甲基咪唑(分析纯,北京金龙化学试剂有限责任公司);溴代十四烷(分析纯,北京金龙化学试剂有限责任公司);乙酸乙酯(分析纯,沈阳新兴试剂公司)。
仪器:DDS-307型电导率仪(上海精密科学仪器有限公司雷磁仪器厂);501超级恒温水浴(江苏金坛市大地自动化仪器厂);SYZ-A 型石英亚沸蒸馏器(江苏省金坛市佳美仪器有限公司)。
1.2 离子液体的合成
无溶剂条件下,在配有回流冷凝管和恒压滴液漏斗的三颈烧瓶中加入0.1mol N-甲基咪唑,通入N2保护,用恒压滴液漏斗慢慢滴加0.1mol溴代十四烷,边滴加边搅拌,回流反应12h,反应温度为343.15~353.15 K。将所得的粗产品用乙酸乙酯重结晶3次,再将中间体在333.15K 下真空干燥8 h,得到白色蜡状固体[6-7]。
1.3 实验方法
配置不同浓度的表面活性剂溶液,充分混合、恒温后,采用电导率仪测量样品的电导率,每个样品至少 测 量3次,取 平 均 值。温 度 变 化 为2 9 8.1 5~318.15K,间隔为5K,乙二醇体积分数变化为10%~30%,间隔为5%。
2 结果与讨论
2.1 临界胶束浓度(CMC)和反离子缔合度(g)
测定了在298.15~318.15K 时C14mimBr在乙二醇体积分数分别为10%、15%、20%、25%、30%的水溶液中的电导率。图1是乙二醇体积分数为25%时在不同温度下C14mimBr电导率随浓度的变化关系。
由图1可以看出,C14mimBr的电导率随浓度变化有明显的转折点,在转折点之前,随离子液体溶液浓度的变化,体系的电导率值大幅增加;转折点之后,电导率增大趋势趋于缓和,这一转折点所对应的浓度即为C14mimBr的临界胶束浓度(CMC)[8]。无论在临界胶束浓度之前和之后,电导率和表面活性剂的浓度都是线性相关的,CMC 之后的斜率与CMC之前的斜率的比值即为反离子解离度k0[9],反离子缔合度g=1-k0。
图2是303.15K 时混合体系的lg(CMC)对乙二醇的体积分数的变化。

图1 不同温度下C14mimBr在乙二醇体积分数为25%的混合溶液中电导率随浓度变化曲线Fig.1 Electric conductivities versus surfactant concentration for C14mimBr in 25%EG+water mixtures at different temperatures

图2 303.15K 时lg(CMC)对助溶剂EG 的体积分数变化Fig.2 lg(CMC)versus the volume fraction of the co-solvent EG at 303.15 K
图2可以看出lg(CMC)与EG 体积分数的增加呈线性相关,这种关系可以表示为:
lg(CMC)mix=lg(CMC)w+kφ
其中下角标mix表示助溶剂EG 和水的混合溶剂,w 表示水,k 是一个常数,φ 是乙二醇的体积分数。助溶剂的介电常数和它的疏水基团对于胶束的形成影响很大[10]。乙二醇是助溶剂,它的加入使得胶束化的临界胶束浓度增大,疏水基团之间的相互作用破坏了表面活性剂周围的水结构,不利于胶团形成,对于胶束化起了主导作用[11]。
表1是通过作图计算所得到的临界胶束浓度和反离子缔合度的值。
由表1 可以看到,在一定温度下,CMC 随EG浓度的增大而增大。这可能由两种因素引起:第一,EG 的加入降低了溶液本体相的内聚能密度,因而增加了C14mimBr单体的溶解性,使得CMC 增大;第二,EG 的加入使得水的介电常数下降,导致胶束中离子头基间的相互排斥力增加,CMC增大。

表1 不同温度下C14mimBr在乙二醇+水混合溶液中的临界胶束浓度(CMC)和反离子缔合度(g)Table 1 Critical micelle concentration and degree of counterion association(g)for C14mimBr in EG+water mixtures at different temperatures
另外,由表1可知,当乙二醇体积分数一定时,在所测温度范围内CMC 随温度的升高而增大。温度对于临界胶束浓度的影响存在两个对立的因素:(1)升高温度表面活性剂的亲水基团的水合作用下降,有助于胶团的形成;(2)升高温度也导致表面活性剂疏水基团周围水结构的破坏,不利于胶团的形成。从表1的数据可以看出是第二种因素起了主导作用。
2.2 热力学参数
表面活性剂体系的热力学参数[12-13],胶束化标准吉布斯自由能(ΔG⊖m)、焓变(ΔH⊖m)、熵变(ΔS⊖m)可以通过以下公式计算得到:

式中CMC为表面活性剂溶液的临界胶束浓度。利用表1中的数据CMC和g 值计算得到ΔG⊖m值。
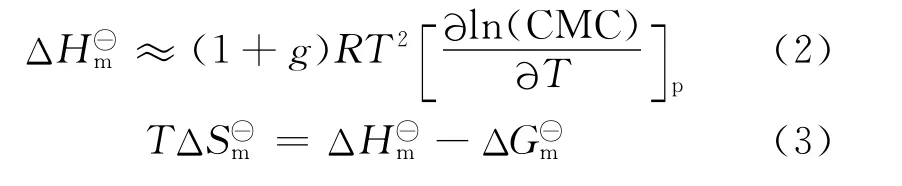


由以上公式计算得到C14mimBr胶束化过程的热力学参数列于表2中。

图3 不同溶剂与温度关系曲线Fig.3 Plots of lnCMC versus temperature for different solvent compositions

表2 不同温度下EG-水的混合体系中C14mimBr胶束化的热力学参数Table 2 Thermodynamic parameters of micellization of C14mimBr in EG-water mixtures at different temperatures
3 结论
[1] 张金生,边鲁宁,李丽华.离子液体的合成研究与应用进展[J].化学与生物工程,2007,24(l):7-9.
[2] 邹汉波,董新法,林维明.离子液体及其在绿色有机合成中的应用[J].化学世界,2002,2:107-110.
[3] Welton T.Room-temperature ionic liquids solvents for synthesis and catalysis[J].Chem.Rev.,1999,99:2071-2083.
[4] Earle M J,Seddon K R.Ionic liquids green solvents for the future[J].Pure Appl.Chem.,2000,72:1391-1398.
[5] Moniruzzaman M,Kamiya N,Nakashima K,et a1.Water-in-ionic liquid microemulsions as a new medium for enzymatic reactions[J].Green Chem.,2008,10(5):497-500.
[6] Mukai T,Yoshio M,Kato T,et al.Anisotropic ion conduction in a unique smectic phase of self-assembled amphiphilic ionic liquids[J].Chem.Commun.,2005,10:1333-1335.
[7] Wasserscheid P,Welton T.Ionic liquids in synthesis[J].Wiley-VCH,Weinheim.,2008,2:721.
[8] Bakshi M S,Kaur G.Effects of glycol additives on the mixed micelle formation by hexadecyltrimethylammonium bromide+dodecylpyridinium chloride mixtures[J].J.Mol.Liq.2000,88:15-32.
[9] Lianos P,Lang J.Static and dynamic properties of sodiump-(1-propylnonyl)benzene sulfonate micelles[J].J.Colloid Interface Sci.,1983,96:222-228.
[10] Alizadeh N,Gharibi H,Shamsipur M.Electrochemical study of the micellization of hexadecylpyridinium bromide in binary methanol-water mixtures[J].Bull.Chem.Soc.Jpn.,1995,68:730-733.
[11] Ruiz C C.Fluorescence anisotropy of probes solubilized in micelles oftetradecyltrymethylammonium bromide:effect of ethylene glycol added[J].J.Colloid Interface Sci.,2000,221:262-267.
[12] Carnero R C,Molina-Bolivar J A,Aguiar J,et al.Effect of ethylene glycol on the thermodynamic and micellar properties of Tween 20[J].Colloid Polym.Sci.,2003,281:531-541.
[13] Jie Y,Dong W,Fang B,et al.Investigation of the thermodynamic properties of the cationic surfactant CTAC in EG+water binary mixtures[J].J.Solution Chem.,2010,39:1501-1508.
[14] 凌锦龙,徐敏红,洪迪,等.乙二醇对烷基三甲基溴化铵胶团化行为的影响[J].化学研究与应用,2012,2:322-326.
[15] Ruiz C C.Thermodynamics of micellization of tetradecyltrimethylammonium bromide in ethylene glycol–water binary mixtures[J].Colloid.Polym.Sci.,1999,277:701-707.
[16] Callaghan A,Doyle R,Alexander E.Thermodynamic properties of micellization and adsorption and electrochemical studies of hexadecylpyridinium bromide in binary mixtures of 1,2-ethanediol with water[J].Langmuir,1993,9:3422-3426.

