溶胶沉淀法合成修饰氧化铕溶胶与特性表征
郑立群, 陈前火,李 清, 刘 情, 生 瑜, 章文贡
(1.福建师范大学化学与化工学院,福建福州350007;2.福建省污染控制与资源循环利用重点实验室,福建师范大学环境科学与工程学院,福建福州350007;3.福建省高分子材料重点实验室,福建福州350007)
团簇或量子点(Quantum Dots)的狭义尺寸是指在0.1~1nm 的原子、离子或分子聚集体[1]。但1~10nm 的低纳米尺寸颗粒往往也因其具有强烈的小尺寸效应,和团簇一样拥有类似原子的所谓“膺原子”或“人造原子”许多特性。所以广义而言,团簇通常指包括低维纳米尺寸及在0.1~10nm 的团簇粒子。因为团簇粒子比一般纳米粒子在三维空间中受到更为严格约束,所以团簇粒子具有更强烈的纳米特性,在性质上明显不同于一般的纳米材料,更不用说普通的体相材料[1],从而成为科学研究前沿领域的热门课题。如今,半导体量子点在量子器件和未来纳米光电子学、量子计算机和生命科学等方面的研究和重大应用前景,得到各国研究者的极大关注。
稀土离子具有丰富的能级和4f电子的跃迁特性,使得稀土离子拥有独特的发光特性,如具有窄带波长发射(10~20nm)、荧光寿命长(10-2~10-6s)、理论发光效率高(100%)等,在光传感器、激光、电致发光器件、光学影像、计算设备等方面获得了广泛的应用[2]。由于Eu3+会发出613nm 的特征红光,Tb3+会发出549nm 的特征绿光,所以在用于合成荧光材料方面受到了研究者的青睐。
用典型固相反应法得到的荧光粉的粒径为5~20μm,因粒径较大而不宜用于高分辨率显示器或低压电致发光器件,而采用简单研磨降低荧光粉的粒径会显著降低荧光粉的发光效率[3-4]。气相沉积法[5]和脉冲激光轰击法[6]都可用来制备粒径小于100nm 的粒子,但是方法复杂,成本高,不利于实际的应用。由于溶胶凝胶法合成温度比固相反应法低,产物的纯度高、均匀性好、粒径小等特点,获得广泛的应用[7]。溶胶沉淀法,作为其中的一种溶胶-凝胶法,在合成发光材料中得到了广泛的应用[8-11]。G Wakefield 等[12-13]采 用 此 法 以 三 辛 基 氧 化 膦(TOPO)为修饰剂制备得到纳米氧化铽和氧化铕粒子,但没有讨论不同的修饰剂或多种修饰剂及pH对溶胶荧光强度的影响,而修饰剂种类和数量及pH 对荧光强度具有很大的影响。
本文主要以甲醇为介质,噻吩甲酰三氟丙酮(TTA)、1,10-邻菲罗啉(phen)作为修饰剂,采用溶胶沉淀法制备得到粒径较小,在紫外光照射下能发出强红色荧光的修饰纳米氧化铕甲醇溶胶,并通过高分辨透射电镜(HRTEM)和选区衍射(SED)、可见-紫外吸收光谱(UV-Vis)和荧光光谱等方法对溶胶进行了表征,重点探讨了pH 对其发光性能的影响。
1 实验部分
1.1 试剂
氧化铕(分析纯,纯度≥99.99%,国药集团化学试剂公司生产);噻吩甲酰三氯丙酮(TTA,分析纯,纯度≥99.0%,Fluka公司生产);甲醇(分析纯,纯度≥99.7%,国药集团化学试剂公司生产);1,10-邻菲罗啉(phen)(分析纯,纯度≥99.0%,国药集团化学试剂公司生产);浓盐酸和氢氧化钠均为分析纯试剂。
1.2 实验步骤
准确称取一定量的Eu2O3加入过量的6mol/L的盐酸,加热搅拌使之溶解并蒸发至干,得到白色粉末状固体EuCl3·6H2O。冷却后,用无水甲醇溶解配置成0.005mol/L的溶液备用。
准确称取一定量的TTA,加入无水甲醇,配制成0.005 mol/L 的 溶 液 备 用。同 理 配 置0.005 mol/L的phen甲醇溶液和0.005mol/L的phen与TTA 的混合甲醇溶液(其中TTA 与phen 的浓度均是0.005mol/L)备用。
准确称取一定量的固体NaOH 溶于甲醇溶液,分别配置成浓度分别为0.005、0.01、0.02、0.06、0.10、0.15、0.20、0.30 mol/L 的NaOH 甲 醇 溶 液备用。
室温下,将5mL 0.005mol/L EuCl3甲醇溶液在不断搅拌下加入5mL 0.005mol/L phen甲醇溶液或phen和TTA 的混合甲醇溶液中,继续搅拌10 min,再加入0.5 mL 0.005 mol/L NaOH 甲醇溶液,再搅拌10min,便得到氧化铕甲醇溶胶。用同样方法得到不同NaOH 浓度的纳米氧化铕甲醇溶胶。
1.3 表征方法
紫外可见光谱:采用Cary 50型紫外-可见分光光度计(Varian公司)来测定,将得到的溶胶用无水乙醇稀释50倍,参比为无水乙醇。
荧 光 光 谱:采 用FL/FS 920 型 荧 光 光 谱 仪(Edinburgh Analytical Instrument公司),其激发光源为450 W的氙灯,入射和出射狭缝宽度分别为1.5nm 和1.0nm。
高分辨率透射电镜:采用FEI F20 透射电子显微镜(Philips公司)来观察溶胶样品中纳米颗粒的粒径和分散状况。纳米氧化铕有机溶胶用超声波分散后取8滴溶胶样品逐滴滴加于喷碳镀膜铜网上。
2 结果与讨论
稀土离子的荧光发射强度主要取决于以下两个因素:激发能量向发光中心离子传递的效率和中心离子发生辐射跃迁的几率。稀土配合物发光机理如下:当配体吸收紫外光后就由单重态S0跃迁到单重激发态(S1)。由于单重激发态寿命很短,很快便通过系间穿越到亚稳的三重态(T),然后由最低激发三重态(T1)把能量传递给稀土离子的振动能级。此时,稀土离子的基态电子受到激发跃迁到激发态,当电子由激发态回到基态时发射出中心稀土离子的特征荧光。所以,稀土纳米溶胶的发光强度一般取决于两个因素,即激发能量向发光中心传递的效率和中心稀土离子发生辐射跃迁的几率[14]。因为不同稀土离子的激发态能级不同,此外,配体的最低三重态能级一定要高于稀土离子的激发态能级,所以对于不同的稀土离子,与其匹配的配体也是不一样。由于TTA 和phen的三重态能级和铕离子的激发态能级可以很好地匹配[15],所以在本研究中,选用TTA 与phen来修饰纳米氧化铕粒子。
2.1 不同配体修饰释剂的影响
在NaOH 浓度(0.005mol/L)相同的条件下,在氯化铕甲醇溶胶中加入适量的修饰剂,可制得修饰氧化铕甲醇溶胶。修饰氯化铕甲醇溶胶在紫外光照射下会发出红色的荧光,图1为不同修饰剂的氧化铕甲醇溶胶的荧光光谱。
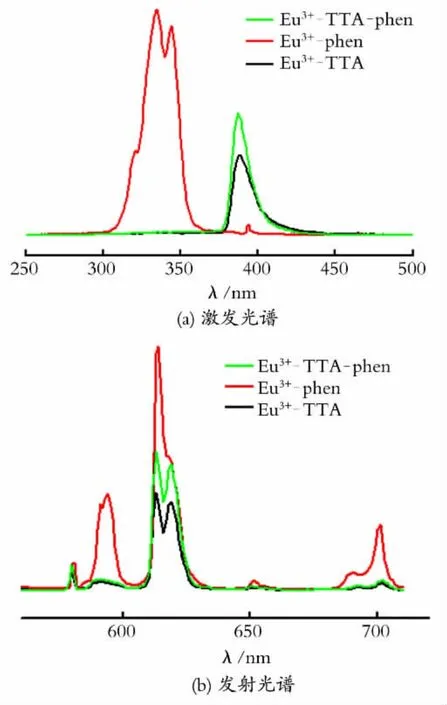
图1 不同修饰剂的氧化铕甲醇溶胶的荧光光谱Fig.1 Fluorescence spectra of the Eu2O3 methanol colloids with different combinational ligands
图1(a)是以613nm 为监测波长得到的激发光谱,在300~450nm 内出现激发峰,Eu3+-phen溶胶二个激发峰的峰值波长分别为334nm 和344 nm,Eu3+-TTA 的峰值波长为388nm,Eu3+-TTA-phen的峰值波长为383nm。以峰值波长为激发光,得到如图1(b)所示的荧光发射光谱。发现尽管采用不同的修饰剂,但得到氧化铕甲醇溶胶的发射光谱在550~725nm 均出现了Eu3+的5个特征荧光发射峰[16],分别对应于5个Eu3+的跃迁:即5D0→7F0(580nm)、5D0→7F1(591nm)、5D0→7F2(613 nm)、5D0→7F3(651nm)、5D0→7F4(702nm)能级间的跃迁。这5个跃迁中,位于613nm 的5D0→7F2最强,而且发射谱线尖锐,说明氧化铕甲醇溶胶的色纯度很高。5D0→7F2跃迁处还存在另外一个较小的肩峰(619nm),这是晶体场使5D0→7F2分裂出两条特征峰[17,18]。5D0→7F2(613nm)的电偶极跃迁远大于5D0→7F1(591nm)的磁偶极跃迁,说明配合物以发射红光为主,且荧光单色性好。从图1(b)还可观察到以phen为修饰剂所得到的溶胶的荧光在613 nm 发射强度最大,TTA 作为修饰剂所得到溶胶的荧光强度要小的多,而以TTA 与phen复合修饰剂所得到的溶胶的荧光强度则介于二者之间。
用无水乙醇将以上3种溶胶分别稀释50倍,得到紫外-可见吸收光谱(见图2)。由图2 可见,以phen修饰的溶胶在230nm 和265nm 出现了强紫外吸收峰,属phen 的π→π*跃迁吸收峰;以TTA为修饰剂得到的溶胶在273nm 和347nm 左右出现了强紫外吸收峰,属TTA 的π→π*跃迁吸收峰;同样,以TTA-phen 为修饰剂得到的溶胶在231、263、347nm 出现了强紫外吸收峰.相比前两种配合物Eu3+-TTA-phen 配合物均有出现phen 和TTA 的π→π*特征跃迁吸收峰。由于在202nm 处出现的吸收峰很小,说明生成的氧化铕溶胶有一定程度的团聚[19]。
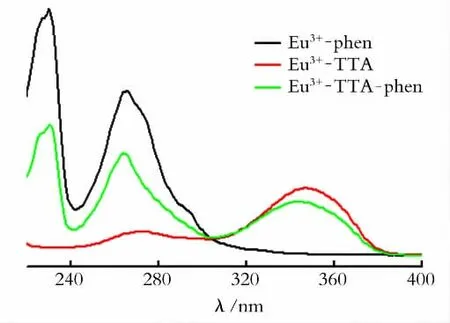
图2 不同修饰剂的氧化铕甲醇溶胶的紫外可见光谱Fig.2 UV-visible absorption spectra of the europium oxide methanol colloids with different ligands
2.2 不同NaOH 浓度的影响
配体与金属离子配位时,配体的酸效应和金属离子的水解效应是一定要考虑的两个因素。当NaOH 浓度增大时,配体的酸效应较弱,有利于配体与Eu3+配位,使更多的配体能将吸收到的能量传递给Eu3+,从而使溶胶的荧光强度增强。另一方面,如果NaOH 浓度太大时,金属离子的水解效应增强,Eu3+发生水解而产生Eu(OH)3沉淀而团聚在一起,同时也使得原来与Eu3+配位的有机配体无法与Eu3+配位,进而降低溶胶的荧光强度。所以应该控制加入NaOH 溶液的浓度,以期得到具有较强发光强度的修饰氧化铕溶胶。
2.2.1 NaOH 浓度对Eu3+-phen溶胶的影响 图3为不同NaOH 浓度下以phen为修饰剂得到的氧化铕溶胶的荧光光谱图,其中图3(a)为监测613nm发射光得到的激发光谱,图3(b)为以激发谱峰值波长为激发光得到的发射光谱,图3(c)为溶胶在613 nm 处的荧光发射强度随NaOH 浓度的变化图。
从图3 可以看出,NaOH 浓度不同时,各种溶胶的激发光谱和发射光谱的峰形与前面测试结果相似,峰值强度随浓度的增加而增大,当NaOH 浓度为0.02mol/L时达到最大,其在334nm 的激发峰强度为88 900(a.u.),然后随NaOH 浓度增大而减小。当NaOH 浓度为0.20mol/L和0.30mol/L时激发峰为单峰,峰值波长为350nm,而且激发峰的强度显著下降,特别是0.30mol/L 时,激发峰的峰值强度更小,仅为2 720(a.u.)。在实验过程中发现这两个浓度下均生成了Eu(OH)3沉淀,可能原因是在较高的NaOH 浓度下,Eu3+水解并生成Eu(OH)3沉淀,原先配位的配体从Eu3+表面脱落下 来。从图3(b)中可以看出,当NaOH浓度为0.02mol/L 时,溶胶在5D0→7F2(613nm)跃迁的荧光强度达到最大,其强度为1.3×105(a.u.)。当NaOH 浓度超过0.20mol/L时,Eu3+-phen溶胶的荧光强度已经非常弱了。
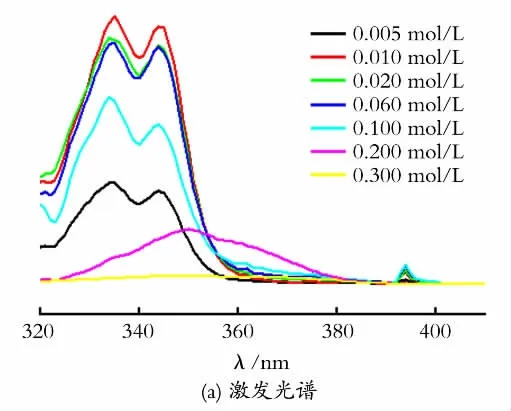
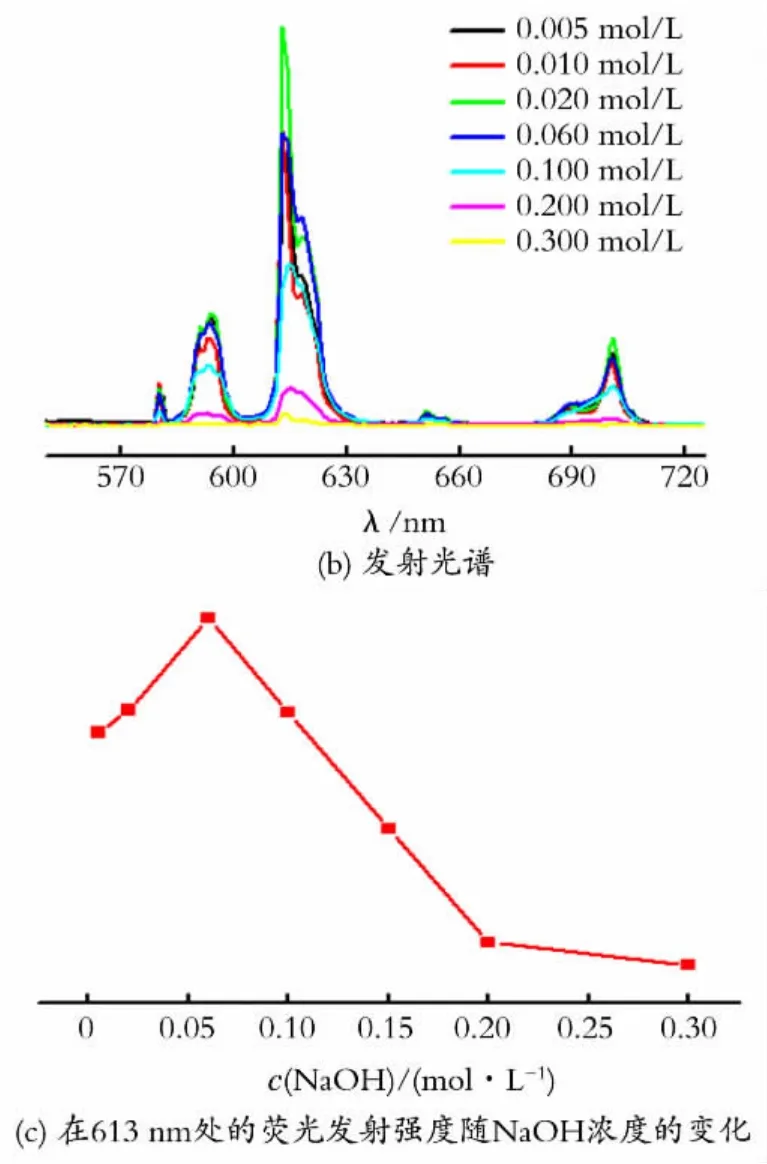
图3 Eu3+-phen溶胶在不同NaOH 浓度下的荧光光谱Fig.3 The fluorescence spectrum of Eu3+-phen colloids with different concentration of NaOH
以无水乙醇为溶剂将不同NaOH 浓度下的Eu3+-phen溶胶稀释50倍得到的紫外-可见吸收光谱如图4所示。由图4可见,Eu3+-phen体系在各NaOH 浓度下的特征紫外吸收峰的位置基本不变,各溶胶在230nm 和265nm 处均出现了属于phen的π→π*特征吸收峰;当NaOH 浓度为0.02mol/L时,紫外的吸收峰的强度最小,表明在此浓度下游离的phen的浓度达到最小值,说明phen与Eu3+配位的量达到最大,由于只有与Eu3+配位的配体才能将能量传递给Eu3+,所以此时溶胶的荧光发射强度也最大。2.2.2 NaOH 浓度对Eu3+-TTA-phen 溶胶的影响 以TTA 和phen(TTA 和phen的浓度均为0.005mol/L)作为修饰剂在不同NaOH 浓度下的氧化铕溶胶的荧光光谱见图5。
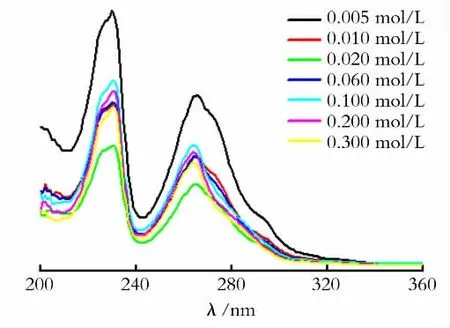
图4 Eu3+-phen甲醇溶胶在不同NaOH浓度下的紫外可见吸收光谱Fig.4 UV-visible absorption spectra of the Eu3+-phen methanol colloids with different concentration of sodium hydroxide
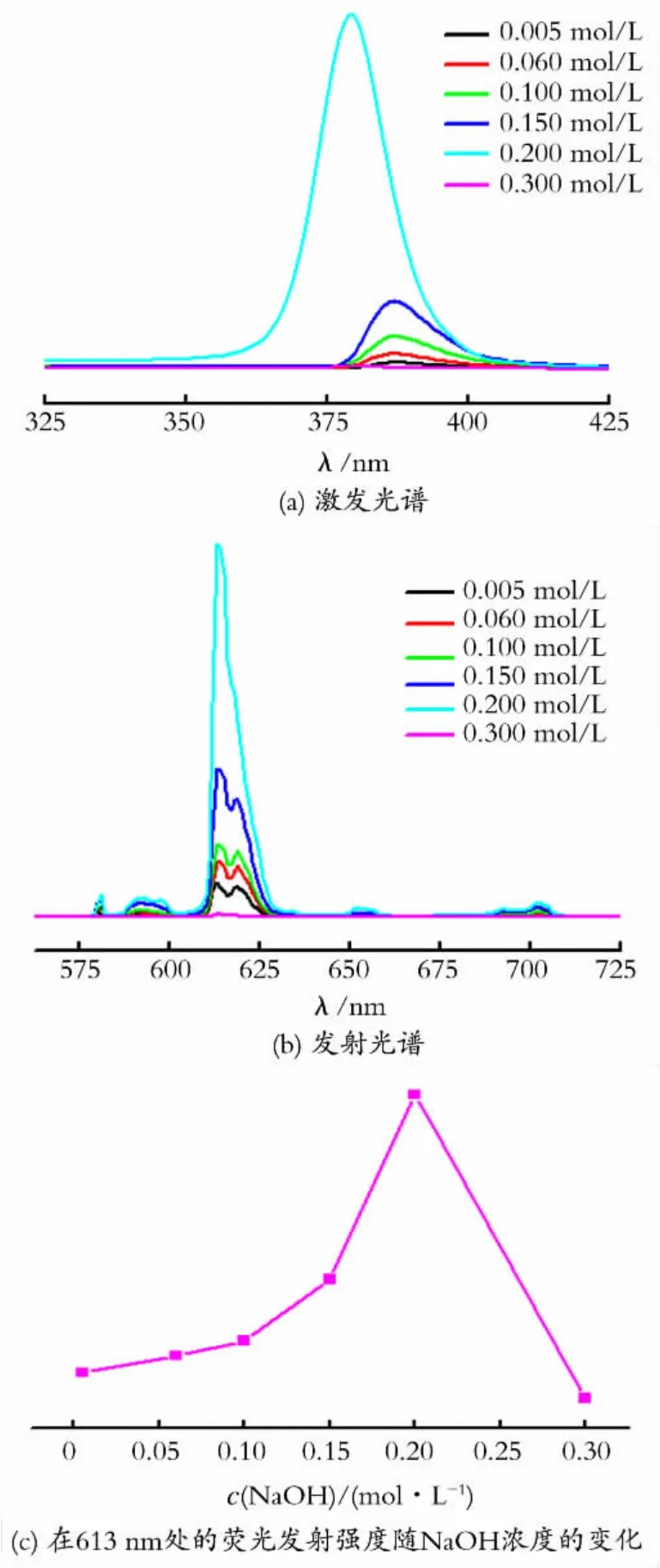
图5 Eu3+-TTA-phen溶胶在不同NaOH浓度下的荧光光谱Fig.5 The fluorescence spectrum of Eu3+-TTA-phen colloids with different concentration of NaOH
图5(a)为监测613nm 发射得到的激发光谱,图5(b)为以激发谱峰值波长为激发光得到的发射光谱,图5(c)为Eu3+-TTA-phen溶胶在613nm 处的荧光发射强度随NaOH 浓度的变化图。从图5(a)中可看出,激发峰的荧光强度随着NaOH 浓度的增大而变大,当NaOH 浓度为0.20 mol/L 时激发峰强度达到最大,其强度为1.01×106(a.u.),然后随NaOH 浓度增大而减小;同时激发光谱峰值波长随NaOH 浓度增大向短波方向移动,从387nm移动到380nm。以激发谱峰值波长为激发光,得到在613nm 处的荧光发射强度也随NaOH 浓度的增加而增大,当NaOH 浓度为0.20 mol/L 时达到最大,其荧光发射峰强度为5.58×105(a.u.),然后随NaOH 浓度增大而减小。
以无水乙醇为溶剂稀释50倍后的Eu3+-TTAphen溶胶的紫外-可见吸收光谱如图6所示。由图6可知,不同NaOH 浓度下制得的Eu3+-TTA-phen溶胶在231nm 和265nm 处均出现了phen的特征紫外吸收峰,在347nm 处出现了TTA 的特征紫外吸收峰。当NaOH 浓度达到0.20 mol/L 时,位于231nm 和265nm 处的紫外吸收峰最小,说明溶胶中游离的phen的浓度最小,即与Eu3+配位的phen量达到最大。当NaOH 的浓度到0.30 mol/L 时,位于231nm 和265nm 处的紫外吸收峰强度变大,说明有部分phen配体从Eu3+的表面上脱落下来。另一方面,随着NaOH 浓度的增大,位于342nm 处的TTA 的特征紫外吸收峰强度减弱。当NaOH 的浓度达到0.30mol/L时,位于342nm 处的紫外吸收峰最小,说明在此条件下,游离的TTA 的浓度很小,也就是说,大部分的TTA 都与Eu3+配位。说明当NaOH 浓度达到0.30mol/L 时,TTA 还能与Eu3+配位,但部分phen 从Eu3+表面脱落下来,留下的空位被羟基取代。羟基的存在使体系的无辐射跃迁增加,从而使体系的荧光强度减弱。
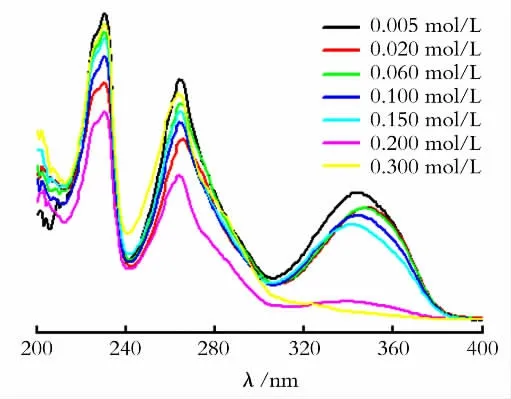
图6 Eu3+-TTA-phen溶胶在不同NaOH浓度下的紫外可见光谱Fig.6 UV-visible spectra of Eu3+-TTA-phen colloids with different concentration of NaOH
2.2.3 Eu3+-phen和Eu3+-TTA-phen两种体系的比 较 分 析 在Eu3+-TTA-phen 体 系 中,随 着NaOH 浓度的增加配合物的发射强度明显增加,当NaOH 浓度达到0.20 mol/L 时,配合物发光强度达到最大值。而在Eu3+-phen体系中,当NaOH 浓度达到0.02mol/L时,配合物发光强度就达到最大值。比较两组体系的最大的荧光发射强度值可知,Eu3+-TTA-phen溶胶是Eu3+-phen-NaOH 体系的4.3倍,说明使用复合修饰剂能够得到较强荧光发射强度的修饰氧化铕溶胶,主要的原因如下:
(1)TTA 是很好的获光中心,它的三重态能级(能量为20 300cm-1)与Eu3+的5D0能级(能量为17 260cm-1)较为匹配,二者的能级差小于4 000 cm-1,所以可以发生高效率的配体-金属间的能量传递[15]。羟基的振动是使体系中的能量得以非辐射跃迁方式释放的一个重要途径。TTA 进入Eu3+配位壳层可以置换出与Eu3+络合的水分子配体,减少Eu3+配位壳层中的羟基而使体系的荧光强度剧增。
(2)由 于 配 体phen 的 三 重 态 能 级(22 312 cm-1)高于TTA 的三重态能级(20 300cm-1),phen可以通过配体间能量传递的方式将其能量传递给TTA,再由TTA 将能量传递给Eu3+而使Eu3+发光增强。此外,由于TTA 和phen的协同配位,使Eu3+的局域对称性比在Eu3+-phen体系中更低,从而使f-f跃迁进一步解禁,进而使发光强度增大[20]。
2.3 氧化铕纳米粒子有机溶胶的HRTEM 图像
为了研究修饰氧化铕溶胶中粒子的结构,以加入TTA 和phen为修饰剂,NaOH 甲醇溶液的浓度为0.20mol/L的条件下制备得到的氧化铕甲醇溶胶逐滴滴加到喷碳镀膜铜网上,从而得到溶胶粒子的HRTEM 图像。图7为以TTA 和phen为修饰剂,NaOH 甲醇溶液的浓度为0.20 mol/L 条件下制得的氧化铕纳米粒子的HRTEM 图像及选区衍射图。
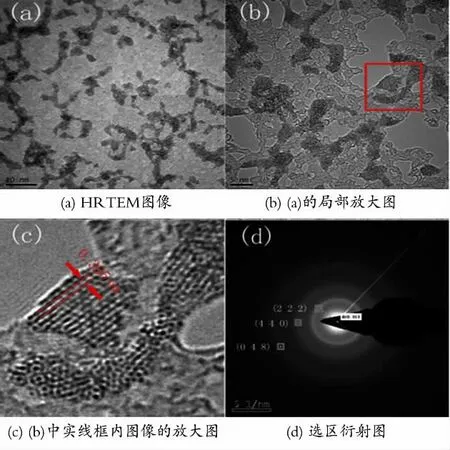
图7 TTA-phen作为修饰剂的氧化铕甲醇溶胶的高分辨透射电镜Fig.7 HRTEM image of the europium oxide methanol colloids with TTA-phen as modifier
从图7(a)和7(b)的HRTEM 图中可以看出,修饰氧化铕纳米粒子呈现比较均匀的分布,其平均粒径为10 nm 以内,从图像看,纳米粒子已有一定程度的团聚。图7(c)为图7(b)的局部放大图,从中可以明显看到其中粒子的晶线,其晶面间距为0.305nm。图7(d)为选区衍射图,该衍射图有3个衍射环,其中的数字为3个环所对应的衍射面,其晶面间距以及JCPDS卡片(86-2476)中氧化铕的晶面间距见表1。
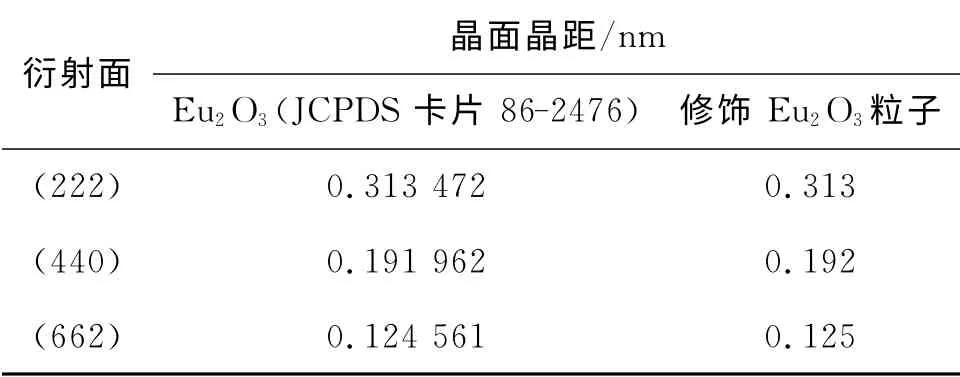
表1 修饰氧化铕纳米粒子和JCPDS卡片(86-2476)的衍射面和晶面间距Table 1 The diffracting plane and interplanar spacing of the coordinated Eu2O3particles,together with that of JCPDS card(86-2476)
从表1中可以看出,修饰氧化铕粒子的晶面间距与JCPDS卡片(86-2476)中氧化铕的晶面间距很相近[21],说明该纳米粒子内层的晶体物质为氧化铕微晶。因而可以得出修饰氧化铕纳米粒子的内核为氧化铕微晶,而位于表面的铕离子与有机配体的配位原子通过配位键结合,形成了表面的铕离子被配体所修饰的纳米氧化铕粒子。
3 结论
采用溶胶沉淀法制备修饰纳米氧化铕有机溶胶。通过UV-Vis、HRTEM、选区衍射和荧光光谱等方法对修饰氧化铕溶胶的结构与光学性能进行了表征。研究结果表明,以TTA 和phen为修饰剂制备的Eu3+-TTA-phen溶胶粒子的内核为氧化铕微晶,其表面原子与有机配体配位。修饰氧化铕溶胶粒子分布均匀,其平均粒径为5nm。当NaOH 的浓度为0.02mol/L时,Eu3+-phen溶胶的荧光发射强度达到最大,而对于Eu3+-TTA-phen 溶胶来说,NaOH 的浓度为0.20mol/L 时,其荧光发射强度最大,且Eu3+-TTA-phen 溶 胶 的 最 大 荧 光 发 射强度是Eu3+-phen溶胶的最大发光强度的7.8倍,主要的 原 因 是 在Eu3+-TTA-phen 体 系 中 引 入 了TTA 后具有更加高效的配体之间以及配体与金属之间能量传递体系,TTA 与phen的协同配位,改变Eu3+的局域对称性。本制备方法简单,得到的溶胶的荧光发光强度大,可用于制备优良的发光材料。
[1] Sutherland A J.Quantum dots as luminescent probes in biological systems[J].Current Opinion in Solid State &Materials Science,2002,6:365-370.
[2] Fu Y J,Wong T K S,Yan Y K,et al.Synthesis,characterization and luminescent properties of a europium (III)complex[J].Thin Solid Film,2002,417(102):78-84.
[3] Qiao Y M,Zhang X B,Ye X,et al.Photoluminescent properties of Sr2SiO4:Eu3+and Sr2SiO4:Eu2+phosphors prepared by solid-state reaction method[J].Journal of Rare Earths,2009,27(2):323-326.
[4] Qiao Y Q,Chen D H.Synthesis of(Sr0.85Zn0.15)3(PO4)2:Eu3+by a modified solid-state reaction and its luminescent properties for ultraviolet light emitting diodes[J].Powder Technology,2009,194(3):187-191.
[5] Manalert R,Rahaman M N.Sol-gel processing and sintering of yttrium aluminum garnet(YAG)powders[J].Journal of Materials Science,1996,31(13):3453-3458.
[6] Kim J C,Lee J W,Park B Y,et al.Characteristics of Fe/SiO2nanocomposite powders by the chemical vapor condensation process[J].Journal of Alloys and Compounds,2008,449(1-2):258-260.
[7] Zak A K,Majid W H A.Characterization and X-ray peak broadening analysis in PZT nanoparticles prepared by modified sol-gel method[J].Ceramics International,2010,36(6):1905-1910.
[8] Hullavarad N V,Hullavarad S S.Synthesis and characterization of monodispersed CdS nanoparticles in SiO2fibers by sol-gel method[J].Photonics and Nanostructures-Fundamentals and Applications,2007,5(4):156-163.
[9] Jose G,Joseph C,Ittyachen M A,et al.Structural and optical characterization of CdSe nanocrystallites/rare earth ions in sol-gel glasses[J].Optical Materials,2007,29(11):1495-1500.
[10] Znaidi L.Sol-gel-deposited ZnO thin films:A review[J].Materials Science and Engineering B,2010,174(1-3):18-30.
[11] Luo J,Qu D,Tikhonov A,et al.Monodisperse,high refractive index,highly charged ZnS colloids self assemble into crystalline colloidal arrays[J].Journal of Colloid and Interface Science,2010,345(1-2):131-137.
[12] Wakefield G,Keron H A,Dobson P J,et al.Structural and optical propertyes of terbium oxide nanoparticles[J].Journal of Physics and Chemistry of Solids,1999,60:503-508.
[13] Wakefield G,Keron H A,Dobson P J,et al.Synthesis and properties of sub-50-nm europium oxide nanoparticles[J].Journal of Colloid and Interface Science,1999,215:179-182.
[14] Tanner P A,Yan B,Zhang H J.Preparation and luminescence properties of sol-gel hybrid materials incorporated with europium complexes[J].Journal of Materials Science,2000,35(17):4325-4328.
[15] Sato S,Wada M.Relations between intramolecular energy transfer efficiencies and triplet state energies in rare earthβdiketone chelates[J].Bull.Chem.Soc.Jap.,1970,43(7):1955-1962.
[16] Chen Q H,Shi S Y,Zhang W G.Study on the structure and luminescent properties of the coordinated Eu2O3ethanol colloids[J].Materials Chemistry and Physics,2009,114(1):58-62.
[17] Du C X,Ma L,Xu Y.Synthesis and fluorescent properties of europium-polyer complexes containing naphthoate and 1,10-phenanthroline Ligands[J].J.Appl.Polym.Sci.,1997,66:1405-1410.
[18] Li Q,Li T,Wu J G.Luminescence of europium(III)and terbium(III)complexes incorporated in poly(Vinyl pyrrolidone)matrix[J].J.Phys.Chem.B,2001,105:12293-12296.
[19] Chen Q H,Zhang W G,Huang X X.Study on continuous preparation of nano europium oxide ethanol sols decorated in sity by pulsed laser ablation and their luminescence characteristics[J].Optical Materials,2008,30(6):822-826.
[20] 王明昭,李翔,宁亚兰,等.新型Eu3+三元复合发光材料研究[J].稀有金属与硬质合金,2002,30(1):13-15.
[21] Saiki A,Ishizawa N,Mizutani N,et al.Structural change of C-rare earth sesquioxides Yb2O3and Er2O3as a function of temperature[J].J.Ceram.Assoc.Jpn.,1985,93:649-654.

