海草植株移植方法的研究进展 Research progress in seagress shoot trans planting method
张沛东, 曾 星, 孙 燕, 张秀梅
(中国海洋大学 水产学院, 山东 青岛266003)
海草是世界上最重要的初级生产者之一[1], 也是海洋生态系统食物链中的重要一环[2], 海草床具有非常复杂的群落结构, 它为一些幼鱼和贝类提供重要栖息地及隐蔽保护场所[3], 也为一些植食性鱼类、某些水鸟和一些大型动物如海龟(Chelonia mydas)、儒艮(Dugong dugon)等提供觅食场所[4-5]。同时, 海草床还可以调节水体中的悬浮物、溶解氧、叶绿素、重金属和营养盐[6], 减缓水流速度[7], 对浅水水质的净化与底质的巩固发挥着关键作用。此外, 海草通过叶片及地下茎将吸收的氮、磷及可溶性有机物等释放到周围环境及水体中, 供附生生物及其他生物利用[8]。并有研究表明, 海草床在维持全球碳平衡和氮平衡中也起到重要作用[9], 碳的固定率几乎可以和热带雨林相比[10]。然而, 自20世纪以来, 受人类活动频繁加剧的影响, 海草床在世界范围内呈现严重衰退趋势, 有些地区的海草床甚至已完全消 失[8]。据统计, 全世界海草的分布面积大约有17.7×104km2, 约相当于海洋面积的0.15%[11]。然而仅1993年至2003年就有大约2.6×104km2的海草床消失, 大约减少了15%[12]。
随着人们对海草床生态功能的逐渐认识, 海草床的保护及其受损生物群落的恢复越来越受到学者们的重视, 并研发了大量的海草床修复方法和装置。2010年, 李森等[13]对这些海草床修复方法的研究进展进行了综述, 概括起来, 将它们分为生境恢复法、种子播种法以及植株移植法3种。生境恢复法, 是指通过保护、改善或者模拟生境, 借助海草的自然繁衍, 从而达到逐步恢复的目的[14-16], 该方法是海草床恢复的前提, 也是最早尝试的方法, 但所需时间周期很长, 是一个缓慢的过程; 种子播种法, 是指从自然生长良好的海草床采集成熟的海草种子, 然后将其直接散播到播种海域或埋藏于底质中, 又或者先将种子置于漂浮网箱或实验室中培养, 待其萌发并长成幼苗后再移栽的一种方法[17-19], 该方法是利用海草的有性生殖方式实现海草床的修复, 可以保持海草的遗传多样性[20], 对天然海草床影响不大, 但种子的采集、贮存、萌发以及播种等方面仍存在许多难点, 因此未得到广泛应用; 植株移植法, 是指从自然生长茂盛的海草床中采集长势良好的植株, 利用某种方法或是装置将其移栽于待修复海域的一种方法[21-23], 该方法利用海草无性生殖的特点, 可以在较短时间内形成新的海草床, 是迄今为止人们使用和研究最多的海草床修复方法。本文在该综述的前提下, 进一步系统划分了海草植株移植法的类别, 综述了各类别移植方法的具体操作过程及其优缺点, 比较了各植株移植方法的移植种类、移植地点、移植效果及使用年代, 探讨了植株移植法存在的一些问题及主要环境因子对移植效果的影响, 并对今后的研究方向进行了展望。以期为进一步开展海草恢复生态学研究及研发适合我国海域特点的海草植株移植方法和装置提供科学参考。
1 海草植株移植方法的分类
海草植株移植包括植株的采集和栽种两个过程。不同的植株移植方法, 实际上就是对移植单元(移植的基本单位, Planting Unit, PU)进行的不同的采集和栽种方法。依据PU的不同, 可以将海草植株移植法划分为草皮法、草块法和根状茎法3大类[24-26]。前两者的PU具有完整的底质和根状茎, 而根状茎法的PU不包括底质, 是由单株或多株只包含2个茎节以上根状茎的植株构成的集合体[27-28]。
1.1 草皮法(Sod method)
草皮法是最早报道的较为成功的移植方法, 是指采集一定单位面积的扁平状草皮作为PU, 然后将其平铺于移植区域海底的一种植株移植方法[22-23,29]。该方法操作简单, 易形成新草床, 但对PU采集草床的破坏较大, 且未将PU埋于底质中, 因此易受海流的影响, 尤其在遭遇暴风雨等恶劣天气时新移植PU的留存率非常低。
1.2 草块法(Plug method)
草块法, 也称为核心法(Coring method), 是继草皮法之后, 用于改良PU固定不足而提出的一种更为成功的移植方法, 是指通过PVC管(core tubes)等空心工具, 采集一定单位体积的圆柱体、长方体或其他不规则体的草块作为PU, 并在移植区域海底挖掘与PU同样规格的“坑”, 将PU放入后压实四周底泥, 从而实现海草植株移植的一种方法[30-32]。与草皮法相比, 草块法加强了对PU的固定, 因此移植植株的留存率和成活率均明显提高, 但该方法对PU采集草床的破坏仍很大, 劳动强度也大幅增加。
1.3 根状茎法(Rhizome method)
草皮法和草块法的PU具有完整的底质和根状茎, 运输不便, 且对PU采集草床的破坏较大。随后, 根状茎法被提出, 该方法更加注重对PU的固定, 趋于易操作、无污染、破坏性小等特点, 并衍生出许多分支方法, 概括起来主要有以下5种。
1.3.1 直插法(Hand-broadcast method)
直插法, 也称为手工移栽法, 是指利用铁铲等工具将PU的根状茎掩埋于移植海区底质中的一种植株移植方法[33-34]。该方法未添加任何锚定装置, 操作简单, 但对PU的固定不足, 尤其是海流较急或风浪较频繁的海域, 移植植株的存活率一般较低[35]。
1.3.2 沉子法(Sinker method)
沉子法, 是指将PU绑缚或系扎于木棒和竹竿等物体上, 然后将其掩埋或投掷于移植海区中的一种植株移植方法[29,32]。该方法加强了对PU的固定, 但在底质较硬的海区其固定力仍不足。
1.3.3 枚钉法(Staple method)
枚钉法, 是参照钉书针的原理, 使用U型、V型或I型金属或木制、竹制枚钉, 将PU固定于移植海域底质中的一种植株移植方法[36-38]。该方法对PU固定较好, 移植植株成活率高, 但劳动强度相对较大。
1.3.4 框架法(Transplanting Eelgrass Remotely with Frame Systems , TERFS)
框架法, 是美国新罕布什尔大学Short[39]教授于2002年研发的一种用于移植大叶藻(Zostera marinaL.)植株的方法和装置, 其框架由钢筋焊接而成, 且框架内部放置砖头等重物作为沉子, 将PU绑缚于框架之上, 然后直接抛掷于移植海域的一种大叶藻植株移植方法, PU与框架之间的绑缚材料采用可降解材料, 能够对框架进行回收再利用。该方法对PU固定较好, 且PU受框架的保护, 减少了其他生物的扰动, 因此移植植株成活率较高, 但框架的制作与回收增加了移植成本和劳动强度。
1.3.5 夹系法(Sandwiched method)
夹系法, 也称网格法(Grid method)或挂网法(Mesh method), 是指将PU的叶鞘部分夹系于网格或绳索等物体的间隙, 然后将网格或绳索固定于移植海域海底的一种植株移植方法[40-42]。该方法操作较简单, 成本低廉, 但网格或绳索等物质不易回收, 遗留在移植海域可能对海洋环境造成污染。
2 海草植株移植方法的比较
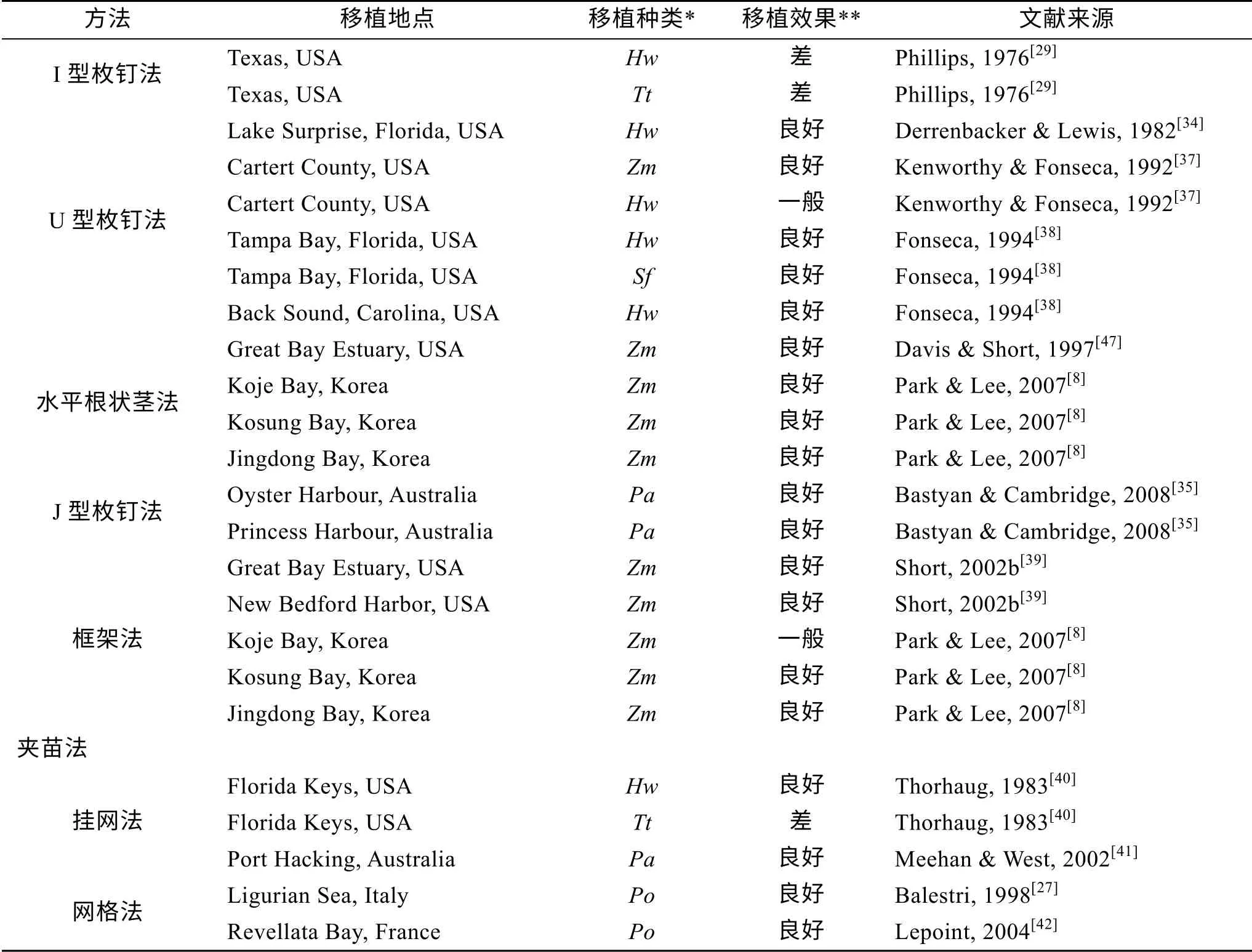
海草植株移植方法可概括为3大类9小类, 每种方法都有各自的优缺点。表1总结了已有报道的海草植株的移植地点、移植对象、移植方法、移植效果及使用年代。
2.1 移植地点和移植对象
从移植地点来看, 分布于美国的移植地点最多, 占到已有报道的60.6%, 其次是澳大利亚和韩国, 均占已有报道的15.2%。从移植对象来看, 以大叶藻为移植对象的研究最多, 占到已有报道的38.6%, 其次是聚伞藻属(Posidonia), 占已有报道的19.3%。这可能是因为大叶藻是北半球海域分布最广的优势种类, 生长于潮间带和潮下带软底质[43], 便于移植操作和后期监测。
2.2 移植方法
按照草皮法、草块法和根状茎法3大类来分, 关于根状茎法的研究最多, 占到已有报道的53.0%, 其次是草块法, 占已有报道的33.3%, 说明根状茎法加强对PU的固定且减少了对PU的使用, 是未来研究的主要方向。按照9个小类来分, 关于枚钉法的研究最多, 占到已有报道的24.2%, 这可能是因为枚钉法操作简单、成本低廉、PU固定效果好, 是众多研究者首选研究的海草植株移植方法。

表1 海草植株移植方法的比较 Tab. 1 The comparison of seagrass shoot transplanting methods
续表
2.3 移植效果和使用年代
从移植效果和使用年代来看, 草皮法是最早使用并获得成功的方法, 在已有关于草皮法的文献中, 移植效果达到良好的报道占到77.5%, 但由于其需要大量的PU, 易在PU采集海草床内形成空斑, 从而破坏原有草床, 因此关于草皮法的研究绝大多数集中于上世纪70年代, 自1976年之后未见报道。草块法也是报道较早的海草植株移植方法, 该方法加强了对PU的固定, 因此移植效果较好, 在已有关于草块法的文献中, 移植效果达到良好的报道占到77.3%。在草块法的基础上, Fonseca等[38]提出了一种改进的盆栽法(Peat Pot method), 该方法将提取的PU植入泥炭盆(peat pot), 然后将其埋入移植海区底质中, 埋入过程中撕裂盆壁, 以允许根状茎的匍匐生长, 并在二药藻属(Halodule)植株的移植修复研究中取得了良好的移植效果。此外, Paling等[44-45]根据草块法原理研发了一种海草机械化移植装置(ECOSUB1), 并在澳大利亚海域聚伞藻属的修复研究中取得了良好的移植效果。尽管草块法对PU采集草床的破坏性较大, 研发的海草机械化移植装置成本较高, 但因其移植效果较好, 能够规模化进行植株移植, 对于那些被征用为港口、填海造地等处的海草床, 草块法目前仍是将这些海草床移植于其他适宜海区的首选方法。
根状茎法始于20世纪70年代的棒条法(沉子法)和I型枚钉法(枚钉法), 尽管当时移植效果较差, 但因其具有所需PU少、对现有海草床影响较小、PU固定效果较好等优点, 是目前使用和研究最多的方法。2000年后关于根状茎法的文献中, 移植效果达到良好的占已有报道的82.4%, 其中移植效果全部为良好的方法是最近研究并使用的水平根状茎法(HRM)、J型枚钉法和网格法。从移植效果来看, 在已有移植方法的基础上进行改进是提高移植效果的重要途径。如Lee等[8,46]根据沉子法的原理研发了一种使用牡蛎壳作为锚钉装置的移植方法(Shell method), 并在大叶藻的修复研究中取得成功。Short 等[47]在枚钉法的基础上研发了一种水平根状茎法, 将两段根状茎平行、反方向捆绑成PU, 然后利用竹制枚钉将其固定于海底, 在大叶藻的修复研究中取得成功, 监测结果表明移植效果全部为良好, 且与传统枚钉法相比, 最大可减少80%的根状茎使用量, 并对环境无污染, 适宜于规模化的海草移植。框架法是在HRM法基础上的进一步改进, 一方面加强了对PU的固定, 另一方面加强了对PU的保护, 在大叶藻的修复研究中取得成功, 该方法无需潜水员进行水下作业, 并可回收再利用, 从而降低了移植成本, 是防生物干扰及较深水域海草移植修复的首选方法[39]。
3 影响海草移植植株存活和生长的主要因素
除移植方法本身对海草移植植株存活和生长的影响外, 光照、底质、水流和移植时间等因素也可能对其产生影响。
3.1 光照
光照是影响移植后海草存活、生长以及光合作用的首要因子。Paling等[44]使用机械船法移植聚伞藻时发现, 冬季昼短夜长、浑浊度高, 光照水平低, 致使移植海草的存活与密度下降。另外, Zimmerman等[49]在美国旧金山湾研究了有效光照对移植大叶藻新陈代谢、生长及存活的影响, 发现移植大叶藻冬季的生长速度仅为夏季的一半, 潮间带移植大叶藻的生长及光合作用率高, 深水层(>-1 m)移植大叶藻一年后的存活率(<10%)明显低于浅水层(<-1 m)的存活率(约60%), 说明有效光照是限制深水层及冬季移植大叶藻生长的主要因子。
3.2 底质
底质是海草根系固着的基础和海草吸收营养物质的载体, 对移植后海草的存活与生长有着重要影响。有研究显示, 底质粒径大时, 氧气含量较多, 而有毒物质含量较少, 因而有利于海草的生长[51]。然而, 柳杰[52]研究了不同底质粒径(砂泥质量比分别为0∶1、1∶3、1∶1、3∶1、1∶0)对移植大叶藻生长的影响, 发现砂泥质量比为1∶3时大叶藻的叶长、叶宽、叶鞘长和茎节长等生长最快。这可能是因为不同的海草种类适宜的底质类型不同的原因。底质对移植后海草的固着也有影响, Lee等[46]使用牡蛎法移植大叶藻时发现, 在泥质底中海草的存活率高达81.3%, 而在沙质底中的存活率仅为5.0%, 说明泥质底相比沙质底更有利于移植大叶藻植株的固着。此外, 海草除了可以通过叶片吸收水体中的营养盐之外, 还可以通过根系吸收底质中的营养盐。Udy等[53]研究发现, 在底质中增加氮营养盐可以促进二药藻的生长, 说明底质营养物质含量会对移植海草的生长产生影响。
3.3 水流
水流会对海草植株产生作用力, 降低PU的固定, 从而影响移植后海草的存活与生长。有研究表明, 大叶藻生存能忍受的最大流速为120~150 cm/s[54], 当水流流速大于50 cm/s时, 大叶藻的密度显著降 低[55]。柳杰[52]研究了不同水流流速(6.52 cm/s±0.247 cm/s、8.24 cm/s±0.405 cm/s、11.76 cm/s±0.293 cm/s、24.56 cm/s±0.413 cm/s)对移植大叶藻生长的影响, 发现8.24 cm/s水流条件下大叶藻生长最好。另外有研究报道, 海流侵蚀并降低了移植后锚钉装置对海草的固定[22,35], 从而严重影响海草移植后的存活。因此, 锚钉装置是海草植株移植技术研究中应当重点考虑的环节。
3.4 移植时间
海草的生长具有明显的季节性, 所以移植海草的存活与生长很大程度上受移植时间的影响。Martins等[56]研究了不同移植时间对移植后罗氏大叶藻存活的影响, 发现4月~10月移植罗氏大叶藻的存活率约为37%, 显著低于11月~翌年3月移植的罗氏大叶藻存活率(约 74%), 因此得出葡萄牙Mondego河口移植罗氏大叶藻的最佳时间为11月~翌年3月。另外, Lee等研究发现, 受夏季高温的影响, 夏季移植的大叶藻损失严重, 而在冬季和春季期间大叶藻的采集困难, 因此在韩国沿海移植大叶藻的最佳季节为秋季[8]。海草移植的最佳时间一般选择在其生长低峰之后, 这样在下一个生长低峰到来之前, 拥有最长的快速生长时间。如Orth等报道, 在美国切萨皮克湾移植大叶藻的最佳季节为秋季, 此时刚好经历了夏季的生长低峰[33]。
3.5 其他因子
影响海草移植成活与生长的因子还有营养物、移植密度、生物扰动、移植深度及移植单元的规格等。Fonseca等[37]报道, N肥的添加促进了大叶藻的无性生殖, 从而提高了移植后大叶藻的生长速度。移植密度及移植深度对移植后海草的成活与生长也有明显影响。如Sheridan等[50]研究发现, 移植间距为0.25 m或0.5 m时, 移植二药藻的成活率及盖度明显高于移植间距为1.0 m时, 且随移植深度的增加其盖度逐渐下降。生物扰动对PU的存活与生长亦有重要影响。据Fonseca[38]报道, 在美国Tampa湾使用盆栽法进行二药藻与大叶藻移植时, 由于生物的扰动, 移植后二药藻与大叶藻完全丢失。
4 存在问题及研究展望
4.1 海草植株移植方法存在的问题
尽管目前已报道的海草植株移植方法取得了很大的成功, 并在许多海域开展了受损海草生物群落的修复, 但依然存在一些问题。
4.1.1 PU的固定
PU的固定是海草植株移植最为关键的一个环节, 几乎所有的移植方法都离不开PU的固定。早在1974年, Phillips[22]在尝试使用草皮法移植泰来海黾草时就发现, 由于PU固定不足, 易受海水冲刷, 移植的海草最终完全丢失。其后, 根状茎法加强了对PU固定方法的研发, 但在固定材料、固定效果和操作过程等方面仍存在不足。
4.1.2 移植后植株的保护
移植后的海草植株由于移植胁迫以及尚未形成稳定的生物群落, 更易受到自然环境和人为活动的影响。Fonseca等[38]于美国Tampa湾研究了生物扰动对移植二药藻的影响, 通过建立2 m高的网墙将部分移植区域包围起来, 阻止敌害生物进入该移植区, 91 d后发现, 网墙内的PU生长良好, 成活率达到78%, 而网墙外PU的成活率仅为15%, 说明生物扰动对移植后二药藻植株的存活影响显著。然而, 目前有关海草植株移植后保护技术的研究还不多见, 特别是针对不同的威胁而采取的保护方法和保护时间等方面。
4.1.3 植株移植对PU采集草床的影响
Harrison[57]使用草块法移植大叶藻后, 进行了长达5 a的监测, 发现草块法挖掘强度大, 对PU采集草床的破坏性较强。其后, 根状茎法的PU减少对海草植株的使用, 然而要进行规模化的海草植株移植, 对PU采集草床的索取和破坏依旧较大。目前为止, 尚没有提出明确的PU采集原则及PU采集草床的恢复速度和程度, 特别是植株采集和环境变化的双重压力对海草床生态系统结构和功能的长期影响。
4.2 研究展望
针对目前海草植株移植方法存在的不足, 将来应重点开展以下几个方面的研究。一是PU固定技术, 加强PU固定装置及方法的研究, 探索固定效果好、操作简便、成本低廉的装置和方法; 二是行之有效的海草植株移植方案, 主要包括移植海区的选取、移植对象的选取、移植方法的选取、移植策略的建立(移植时间、移植密度、移植规模和区域布局等); 三是移植后草床保护技术, 尤其是防止其他生物和人类活动的干扰; 四是植株移植对PU采集草床的长期影响, 着重研究植株采集和环境变化的双重压力对海草床生态系统结构和功能的长期影响; 五是植株移植的遗传风险, 开展植株移植对PU采集草床和移植海区可能造成的遗传风险评估研究。
同世界其他国家一样, 我国的海草资源也处于不断衰退之中。十几年前在青岛近海多见于水下1~2 m处的大叶藻, 现在只能在水下4~5 m处发现[58]。位于广西合浦的8个重要海草床, 其平均面积已由1987年的104.5 hm2下降到了2001年的28.7 hm2, 减少了72.5%[59]。我国海草植株移植方法的研究仍处于起步阶段, 适合我国海域特点的海草植株移植技术体系尚未建立, 因此, 开展我国海草床生物资源与生态环境的基础调查, 加大海草植株移植技术的研发力度, 制订适合我国海域特点的海草植株移植方案, 是我国利用海草植株移植修复受损海草生物群落的关键。
[1] 李文涛, 张秀梅. 海草场的生态功能[J]. 中国海洋大学学报, 2009, 39 (5): 933-939.
[2] 范航清, 郑杏雯. 海草光合作用研究进展[J]. 广西科学, 2007, 14 (2): 180-185, 192.
[3] Orth R J, Heck K L, van M J. Faunal communities in seagrass beds: A review of the influence of plant structure and prey characteristics on predator-prey relationships[J]. Estuaries and Coasts, 1984, 7: 339-350.
[4] Newell S Y. Multiyear patterns of fungal biomass dynamics and productivity within naturally decaying smooth cordgrass shoots[J]. Limnology and Oceanography, 2001, 46: 573-583.
[5] 范航清, 彭胜, 石雅君, 等. 广西北部湾沿海海草资源与研究状况[J]. 广西科学, 2007, 14 (3): 289-295.
[6] Stevenson J C. Comparative ecology of submersed grass beds in freshwater, estuarine, and marine environments[J]. Limnology and Oceanography, 1988, 33: 867-893.
[7] Bos A R, Bouma T J, de Kort G L J, et al. Ecosystem engineering by annual intertidal seagrass beds: Sediment accretion and modification[J]. Estuarine, Coastal and Shelf Science, 2007, 74: 344-348.
[8] Park J I, Lee K S. Site-specific success of three transplanting methods and the effect of planting time on the establishment ofZostera marinatransplants[J]. Marine Pollution Bulletin, 2007, 54: 1238-1248.
[9] Duarte C M, Cebrian J. The fate of marine autotrophic production[J]. Limnology and Oceanography, 1996, 41: 1758-1766.
[10] 杨宗岱, 吴宝铃. 中国海草场的分布、生产力及其结构与功能的初步探讨[J]. 生态学报, 1981, 1 (1): 84-87.
[11] Charpy-Roubaud C, Sournia A. The comparative estimation of phytoplanktonic, microphytobenthic primary production in the oceans[J]. Marine Microbial Food Webs, 1990, 4: 31-57.
[12] 世界生态保护中心. 世界海草地图集[R]. 联合国环境署, 2003.
[13] 李森, 范航清, 邱广龙, 等. 海草床恢复研究进展[J]. 生态学报, 2010, 30 (9): 2443-2453.
[14] Orth R J. The demise and recovery of eelgrass,Zostera marina, in the Chesapeake Bay, Virginia[J]. Aquatic Botany, 1976, 2: 141-159.
[15] Campbell M L, Paling E I. Evaluating vegetative transplant success inPosidonia australis: a field trial with habitat enhancement[J]. Marine Pollution Bulletin, 2003, 46: 828-834.
[16] Short F T, Davis R C, Kopp B S, et al. Site-selection model for optimal transplantation of eelgrassZostera marinain the northeastern US[J]. Marine Ecology Progress Series, 2002, 227: 253-267.
[17] Thorhaug A. Transplantation of the seagrassThalassia testudinumKonig[J]. Aquaculture, 1974, 4: 177-183.
[18] Orth R J, Marion S R, Moore K A, et al. Eelgrass (Zostera marinaL.) in the Chesapeake Bay Region of Mid-Atlantic Coast of the USA: Challenges in Conservation and Restoration[J]. Estuaries and Coasts, 2010, 33: 139-150.
[19] Orth R J, Marion S R, Granger S, et al. Evaluation of a mechanical seed planter for transplantingZostera marina(eelgrass) seeds[J]. Aquatic Botany, 2009, 90: 204-208.
[20] Balestri E, Cinelli F. Sexual reproductive success inPosidonia oceanic[J]. Aquatic Botany, 2003, 75: 21-32.
[21] Thorhaug A. Large-scale seagrass restoration in a damaged estuary[J]. Marine Pollution Bulletin, 1985, 16: 55-62.
[22] Phillips R C. Transplantation of seagrasses, with special emphasis on eelgrass,Zostera marinaL.[J].Aquaculture, 1974, 4: 161-176.
[23] Ranwell D S, Wyer D W, Boorman L A, et al.Zosteratransplants in Norfolk and Suffolk, Great Britain[J]. Aquaculture, 1974, 4: 185-198.
[24] Goodman J L, Moore K A, Dennison W C. Photosynthetic responses of eelgrass (Zostera marinaL.) to light and sediment sulfide in a shallow barrier island lagoon[J]. Aquatic Botany, 1995, 50: 37-47.
[25] Li W T, Kim J H, Park J I, et al. Assessing establishment success ofZostera marinatransplants through measurements of shoot morphology and growth[J]. Estuarine, Coastal and Shelf Science, 2010, 88: 377-384.
[26] Fonseca M S, Kenworthy W J, Thayer G W. Guidelines for the Conservation and Restoration of Seagrasses in the United States and Adjacent Waters[R]. USA: NOAA Coastal Ocean Office, 1998: 111-127.
[27] Balestri E, Piazzi L, Cinelli F. Survival and growth of transplanted and natural seedlings ofPosidonia oceanica(L.)Delilein a damaged coastal area[J]. Journal of Experimental Marine Biology and Ecology, 1998, 228: 209-225.
[28] Ganassin C, Gibbs P J. A review of seagrass planting as a means of habitat compensation following loss of seagrass meadow[R]. Australia: NSW Department of Primary Industries, 2008: 7-19.
[29] Phillips R C. Preliminary observations on transplanting and a phenological index of seagrasses[J]. Aquatic Botany, 1976, 2: 93-101.
[30] Thorhaug A. Large-scale seagrass restoration in a damaged estuary[J]. Marine Pollution Bulletin, 1987, 18: 442-446.
[31] Horn L E, Paling E I, van Keulen M. Photosynthetic recovery of transplantedPosidonia sinuosa, Western Australia[J]. Aquatic Botany, 2009, 90: 149-156.
[32] 郭栋. 大叶藻增殖生态学的实验研究[D]. 青岛: 中国海洋大学, 2010.
[33] Orth R J, Harwell M C, Fishman J R. A rapid and simple method for transplanting eelgrass using single, unanchored shoots[J]. Aquatic Botany, 1999, 64: 77-85.
[34] Derrenbacker J A, Lewis R R. Seagrass habitat restoration in Lake Surprise, Florida Keys[R]. USA: Mangrove Systems, 1982: 132-154.
[35] Bastyan G R, Cambridge M L. Transplantation as a method for restoring the seagrassPosidonia australis[J]. Estuarine, Coastal and Shelf Science, 2008, 79: 289-299.
[36] West R J, Jacobs N E, Roberts D E. Experimental transplanting of seagrasses in Botany Bay, Australia[J]. Marine Pollution Bulletin, 1990, 21: 197-203.
[37] Kenworthy W J, Fonseca M S. The use of fertilizer to enhance growth of transplanted seagrassesZostera marinaL. andHalodule wrightiiAschers[J]. Journal of Experimental Marine Biology and Ecology, 1992, 163: 141-161.
[38] Fonseca M S, Kenworthy W J, Courtney F X, et al. Seagrass planting in the southeastern United states: methods for accelerating habitat development[J]. Restoration Ecology, 1994, 2: 198-212.
[39] Short F T, Kopp B S, Gaeckle J, et al. Seagrass ecology and estuarine mitigation: a low-cost method for eelgrass restoration[J]. Fisheries Science, 2002, 68: 1759-1762.
[40] Thorhaug A. Habitat restoration after pipeline construction in a tropical estuary: seagrasses[J]. Marine Pollution Bulletin, 1983, 14: 422-425.
[41] Meehan A J, West R J. Experimental transplanting ofPosidonia australisseagrass in Port Hacking, Australia, to assess the feasibility of restoration[J]. Marine Pollution Bulletin, 2002, 44: 25-31.
[42] Lepoint G, Vangeluwe D, Eisinger M, et al. Nitrogen dynamics inPosidonia oceanicacuttings: implications for transplantation experiments[J]. Marine Pollution Bulletin, 2004, 48: 465-470.
[43] den Hartog C. The sea-grasses of the world[M]. Amsterdam: North Holland Publishing Company, 1970: 234-240.
[44] Paling E I, van Keulen M, Wheeler K, et al. Mechanical seagrass transplantation in Western Australia[J]. Ecological Engineering, 2001, 16: 331-339.
[45] Paling E I, van Keulen M, Wheeler K D, et al. Improving mechanical seagrass transplantation[J]. Ecological Engineering, 2001, 18: 107-113.
[46] Lee K S, Park J I. An effective transplanting technique using shells for restoration ofZostera marinahabitats[J]. Marine Pollution Bulletin, 2008, 56: 1015-1021.
[47] Davis R C, Short F T. Restoring eelgrass,Zostera marinaL., habitat using a new transplanting technique: the horizontal rhizome method[J]. Aquatic Botany, 1997, 59: 1-15.
[48] Addy C E. Eelgrass planting guide[J]. Maryland Conservationist, 1947, 24: 16-17.
[49] Zimmerman R C, Reguzzoni J L, Alberte R S. Eelgrass (Zostera marinaL.) transplants in San Francisco Bay: Role of light availability on metabolism, growth and survival[J]. Aquatic Botany, 1995, 51: 67-86.
[50] Sheridan P, McMahan G, Hammerstrom K, et al. Factors affecting restoration ofHalodule wrightiito Galveston Bay, Texas[J]. Restoration Ecology, 1998, 6: 144-158.
[51] 王卫红, 季民. 沉水植物川蔓藻的生态学特征及其对环境变化的响应[J]. 植物学通报, 2006, 23 (1): 246-251.
[52] 柳杰. 不同环境条件对天鹅湖大叶藻生长及光合色素含量的影响[D]. 青岛: 中国海洋大学, 2011.
[53] Udy J W, Dennison W C. Growth and physiological responses of three seagrass species to elevated sediment nutrients in Moreton Bay, Australia[J]. Journal of Experimental Marine Biology and Ecology, 1997, 217: 253-277.
[54] Fonseca M S, Zieman J C, Thayer G W, et al. The role of current velocity in structuring eelgrass (Zostera marinaL.) meadows[J]. Estuarine and Coastal Shelf Sciences, 1983, 17: 367-380.
[55] Fonseca M S, Kenworthy W J. Effects of current on photosynthesis and distribution of seagrasses[J]. Aquatic Botany, 1987, 27: 59-78.
[56] Martins I, Neto J M, Fontes M G, et al. Seasonal variation in short-term survival ofZostera noltiitransplants in a declining meadow in Portugal[J]. Aquatic Botany, 2005, 82: 132-142.
[57] Harrison P G. Variations in success of eelgrass transplants over a five-years’ period[J]. Environmental Conservation, 1990, 17: 157-163.
[58] 叶春江, 赵可夫. 高等植物大叶藻研究进展及其对海洋沉水生活的适应[J]. 植物学通报, 2002, 19 (2): 184-193.
[59] 邓超冰. 北部湾儒艮及海洋多样性[M]. 南宁: 广西科学技术出版社, 2002: 45-52.

