一种海洋拟诺卡氏菌产生的胞内中性β-葡萄糖苷酶
吴少杰 , 马桂珍 王淑军 陈 丽 , 王淑芳
(1. 淮海工学院 海洋学院, 江苏 连云港 222005; 2. 江苏省海洋生物技术重点实验室 淮海工学院, 江苏 连云港 222005; 3. 江苏海洋资源开发研究院, 江苏 连云港 222001)
β-葡萄糖苷酶(EC 3.2.1.21)是一类能够水解结合于末端的非还原性β-D-葡萄糖苷键, 同时释放出β-D-葡萄糖和相应配基的酶。
β-葡萄糖苷酶广泛存在于自然界中, 它可以来源于植物、微生物, 也可来源于动物, 有着多种生理活性和应用前景。β-葡萄糖苷酶参与生物体的糖代谢, 对维持生物体正常生理功能起着重要作用。哺乳动物和人类溶酶体内β-葡糖苷酶的缺陷, 将使葡糖脑苷脂贮积在各器官的单核巨噬细胞中, 累及骨髓、肝脾、骨骼及神经系统, 形成“戈谢氏病”, 而应用基因重组β-葡糖苷酶治疗此病已获得成功[1]。在药物研究与开发上, 由于大多数中草药活性成分都含有β-葡萄糖苷基, 因此,β-葡萄糖苷酶广泛地用于天然药物的生物转化与合成[2-3]。β-葡萄糖苷酶也是纤维素降解酶系的重要组成部分, 但在微生物中分泌量少、活力低, 是纤维素酶解的限速酶、成为纤维素酶解的瓶颈环节; 通过人工添加外源β-葡萄糖苷酶有助于提高纤维素的水解效率[4]。此外,β-葡萄糖苷酶能将果、蔬、茶等主、副食品中的风味前体物质水解为具有浓郁天然风味的香气物质, 因而被称为“食品风味酶”[5]。目前, 我国尚未具备大规模生产β-葡萄糖苷酶的条件; 对各种来源的β-葡萄糖苷酶开展研究, 具有重要的经济和应用价值。
据报道, 几乎所有的β-葡萄糖苷酶都是酸性酶类, 其最适反应pH一般低于7.0(大多数在pH 3.5~5.5)[6], 这必然会限制这种酶在某些方面的应用。目前, 中性或碱性β-葡萄糖苷酶仅有个别报 道[7-8], 且大都是来自于芽孢杆菌类。本文报道一株海洋放线菌株HY-G及其所产生的中性胞内β-葡萄糖苷酶。
1 材料与方法
1.1 材料与试剂
海洋拟诺卡氏菌(Nocardiopsissp.)菌株HY-G, 由本实验室分离自海洋环境, 目前保存在中国典型培养物保藏中心(保藏号: CCTCC M 2010126)。p-NPG: SIGMA公司; 蛋白质标样: 江苏碧云天生物技术有限公司; 硅胶薄层层析板: 安徽皖西硅源材料厂; 各种凝胶色谱填料均来自Pharmacia公司; 其他药品均为分析纯。
1.2 仪器与设备
CR22G高速冷冻离心机: 日本日立; SPX-250B生化培养箱: 上海跃进医疗器械厂; HZQ-F160全温振荡培养箱: 舟山市定海区海源仪器厂; BANDELIN HD2200型超声波细胞破碎仪: 宁波新芝生物科技股份有限公司; 680型酶标仪: Bio-rad公司。BioLogic DuoFlow快速蛋白纯化系统: Bio-rad公司。
1.3 实验方法
1.3.1 产酶培养条件与胞内酶的提取
产酶培养条件与胞内酶的提取见文献 [3]。
1.3.2 酶活力测定
以p-NPG为底物, 酶液和5 mmol/L的p-NPG溶液各50 μL, 置40℃水浴保温10 min后, 加入1 mol/L NaOH 100 μL终止反应, 立即用酶标仪测定A400。酶活力定义为: 每分钟催化生成1 μmol对硝基苯酚所需的酶量。
1.3.3 酶的分离纯化
1.3.3.1 硫酸铵分部盐析
4℃条件下, 加入硫酸铵粉末, 分别至饱和度40%、60%、80%和100%, 静置1 h后12 000 r/min离心20 min, 分别收集沉淀, 用pH 6.8的磷酸缓冲液溶解沉淀, 4℃下透析24 h后, 按1.3. 2的方法测定不同饱和度下的A400以确定最佳盐析饱和度。
1.3.3.2 Phenyl-Sepharose疏水层析
用1.7 mol/L的硫酸铵溶液平衡Phenyl-Sepharose疏水层析柱; 将经过40%饱和度盐析并除去沉淀后的粗酶液直接上柱分离。用快速蛋白纯化系统进行梯度洗脱, 其中A泵为1.7 mol/L的硫酸铵溶液, B泵为0.01 mol/L磷酸缓冲液(pH 6.8), 流动相流速1 mL/s。洗脱方式为: 1.7 mol/L的硫酸铵溶液40 mL、梯度(A泵0%~100%)洗脱70 mL, 磷酸缓冲液(10 mmol/L, pH6.8)75mL, 最后用1.7 mol/L的硫酸铵溶液重新平衡层析柱。收集A280下的各峰并检测酶活性。
1.3.3.3 DEAE-Sepharose离子交换层析
用10 mmol/L Tris-HCl缓冲液(pH 6.8)平衡柱子后, 将Phenyl-Sepharose疏水层析柱上收集的活性组分上样。用快速蛋白纯化系统进行梯度洗脱, 其中A泵为10 mmol/L磷酸缓冲液(pH6.8), B泵为1 mol/L NaCl溶液, 流动相流速1 mL/s。洗脱方法为: 50 mL 10 mmol/L磷酸缓冲液(pH6.8)、梯度(A泵0%~100%)130 mL、1 mol/L NaCl溶液20 mL, 最后用10 mmol/L磷酸缓冲液(pH6.8)重新平衡层析柱。收集A280下的各峰并检测酶活性。
1.3.3.4 Superdex 200 HR 10/300 mm凝胶色谱
用10 mmol/L磷酸缓冲液(pH 6.8)平衡柱子。将DEAE-Sepharose阴离子交换层析的活性组分经透析后, 上样, 用10 mmol/L磷酸缓冲液(pH 6.8)洗脱, 收集A280下的各峰并检测酶活性。用标准蛋白质(含甲状腺球蛋白, MW 669.0 kD、铁蛋白, MW 440.0 kD、牛血清白蛋白, MW 67.0 kD、β-乳球蛋白, MW 35.0 kD、核糖核苷酸酶A, MW 13.7 kD、细胞色素C, MW 13.6 kD、抑肽酶, MW 6.5 kD)作为标准蛋白, 在同样条件下洗脱, 以估计β-葡萄糖苷酶的分子质量。
1.3.3.5 SDS-聚丙烯酰胺凝胶电泳
分离胶(水1.6 mL, 1.5mol/L pH8.8 Tris-HCl 1.3 mL, 10% SDS溶液0.05 mL, 30%丙烯酰胺2 mL, TEMED 0.002 mL, 10%APS 0.05 mL)、浓缩胶(水3.4 mL pH6.8 0.5 mol/L Tris-HCl 0.63 mL, 10%SDS 0.05 mol/L, 30%丙烯酰胺0.83 mL, TEMED 0.005mL, 10%APS 0.05mL)。在Tris-甘氨酸电泳缓冲液中, 80~100V电泳一定时间。电泳结束后, 用考马斯亮蓝染液染色。
1.3.4 菌株的分子鉴定
用上海赛百盛®细菌基因组DNA提取试剂盒提取细菌基因组DNA, -20℃保存备用。PCR引物为通用引物, 序列为: F27 (5’-AGAGTTTGATCCTGGCT- CAG-3’)、R1492 (5’- TACGGCTACCTTGTTACGA- CTT-3’)。PCR反应体系(50 µL): Tag酶(大连宝生物)0.25 µL; Buffer(不含Mg2+) 5 µL; Mg2+溶液3 µL; dNTP 4 µL; 模板DNA 1 µL; 引物F27和引物R1492各1 µL。PCR反应条件: 94℃预变性2 min, 然后94℃变性30 s、55℃退火45 s、72℃延伸45 s(循环33次), 最后72℃延伸7 min。PCR产物经琼脂糖凝胶电泳分离, 然后用江苏碧云天生物技术有限公司的DNA凝胶回收试剂盒纯化回收。将纯化后的PCR产物送到上海生工生物工程有限公司测序。使用DNAMAN 6.0软件并采用最大似然法构建菌株的系统进化树, 进化树经过1000次自举分析。
2 实验结果
2.1 硫酸铵分级盐析与盐析沉淀的β-葡萄糖苷酶活力测定
通过不同饱和度的硫酸铵分级盐析后离心得到沉淀; 沉淀经透析后用pH7.0的硫酸缓冲液稀释成相同体积, 然后测定酶活力(以A400计), 得到的结果如表1所示。
由表中可见, 在40%的硫酸铵饱和度下, 沉淀没有酶活力, 说明酶蛋白保留在溶液中, 没有被沉淀下来; 而到了60%的饱和度, 酶蛋白开始沉淀出来; 到了80%的饱和度, 大部分酶蛋白都已经沉淀。考虑到下一步将采用疏水柱进行纯化, 故将硫酸铵盐析的饱和度选为40%(相当于硫酸铵浓度1.7 mol/L)。在该饱和度下, 离心去除沉淀后, 上清液可直接用疏水柱分离。

表1 不同硫酸铵饱和度下沉淀的酶活力(A400) Tab. 1 Enzyme activity of deposits with different saturation of ammonium sulfate(A400)
2.2 酶的层析分离纯化与分子量估算
经过硫酸铵盐析和疏水、离子交换及分子筛层析分离, 将各个步骤下获得的酶蛋白分别电泳, 电泳图谱如图1(左)所示。可见, 经过硫酸铵盐析和各种柱层析分离, 最终获得了凝胶电泳单一条带的β-葡萄糖苷酶。通过与蛋白Marker比较计算, 得出其估计分子质量为43.3 kD。

图1 各纯化步骤对酶的纯化效果(左)及酶蛋白分子质量估测(右) Fig. 1 The purity of β-glucosidase at different steps (left) and its molecular weight (right)
在进行凝胶柱层析分离的同时, 也能进行蛋白质分子质量的估算。在进行Superdex 200 HR 10/300凝胶柱分离时, 得出β-葡萄糖苷酶活性峰的洗脱体积为15.1 mL。通过与标准蛋白质的洗脱体积相比较, 得出如表2中所示的洗脱体积与蛋白质分子质量(MW)的对应关系。上述数值采用Origin 7.0进行线性拟合分析, 得出了蛋白质分子质量的对数“lg(MW)”与洗脱体积“V”的线性拟合方程为: lg (MW) = 5.29067 - 0.23231V(R2= 0.98780)。根据此方程, 计算出海洋放线菌株HY-G产生的β-葡萄糖苷酶分子量为45.0 kD。上述估计值和通过SDS凝胶电泳估计的分子量(43.3 kD)相近。
通过上述两种方法得到的分子质量结果相似, 表明海洋放线菌株HY-G产生的β-葡萄糖苷酶为单聚体, 不含亚基, 其分子质量为43.3~45.0 kD。
2.3 酶性质研究
2.3.1 最适pH和最适温度
称取一定量冻干的酶, 分别用pH 4.0~11.0的各种缓冲液溶解, 分别测定酶活力, 结果如图2所示。海洋放线菌株HY-G产生的β-葡萄糖苷酶在以p-NPG为底物时, 最适pH都为pH 7.0~8.0。据报道, 几乎所有的β-葡萄糖苷酶都属于酸性酶类, 其最适反应pH值一般低于7.0(大多数在pH 3.5~5.5), 因而限制了其在某些方面的应用。中性或碱性β-葡萄糖苷酶迄今仅有个别报道, 且都是来自于芽孢杆菌类。而从海洋拟诺卡氏菌株HY-G中分离到的β-葡萄糖苷酶, 最适作用pH偏碱性, 因此可能是一种新型的β-葡萄糖苷酶。取pH 7.0的酶液, 分别在20~70℃下测定酶活力。可见, 其最适温度为40℃, 同时, 在30~50℃范围内, 酶活力变化不大(图2)。
2.3.2 pH稳定性和温度稳定性
为了测定酶的pH稳定性, 将不同pH值(pH 4.0~11.0)的酶液在4℃冰箱中保存24 h后, 调整到pH7.0, 然后分别测定残余酶活力。为了测定酶的温度稳定性, 取pH 7.0的酶液, 分别在30~80℃下保温30 min后, 测定残余酶活力。结果如下图所示。可见, 该酶在pH 6.0~7.0时最稳定, pH<5或pH >8时, 酶活力迅速下降; 在70℃下30 min仍能保存56%的酶活力, 说明该酶具有较好的耐热性。

表2 蛋白质分子量与Superdex 200凝胶柱洗脱体积的关系及β-葡萄糖苷酶的分子量估算值 Tab. 2 The relationship between MW and elution volume, and the estimated MW of the β-glucosidase

图2 酶催化的最适pH和最适温度(▲ 最适pH; ■ 最适温度) Fig. 2 The optimal pH and temperature of the β-glucosidase (▲ optimal pH; ■ optimal temperature)
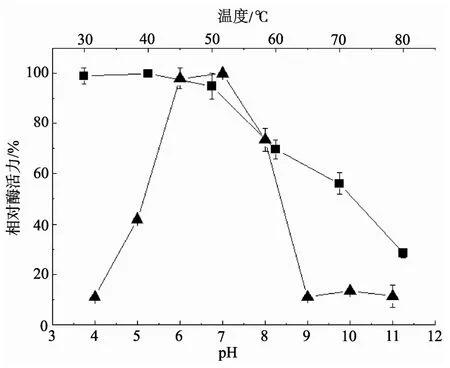
图3 酶的pH和温度稳定性(▲pH 稳定性; ■温度稳定性) Fig. 3 The pH and temperature stability of the β-glucosidase (▲ pH stability; ■ temperature stability)
2.3.3 金属离子对酶活力的影响
采用含有浓度为10 mmol/L不同金属离子的缓冲液(pH 7.0), 然后按照3.1.2的方法测定酶活力。以不添加金属离子的酶反应体系为空白对照(相对酶活力为100%), 确定各金属离子对酶活性的抑制或激活作用, 结果见表3。

表3 金属离子对酶活力的影响(n = 3) Tab. 3 The effects of ions on the activity of the β-glucosidase
由表中可见, Fe2+、Mg2+、Pb2+、Na+、Fe3+对该酶活性有促进作用, 其中Fe2+、Fe3+促进作用较大; Ca2+、Zn2+、Ag+、Cu2+、K+对该酶活性有抑制作用, 其中Zn2+、Ag+、Cu2+抑制作用较大。
2.4 菌株鉴定
经过PCR扩增, 得到了海洋拟诺卡氏菌株HY-G近全长16 S rRNA基因片段。通过测序, 得出了其核酸序列。上述核酸序列与GenBank上的序列进行比对分析, 发现该菌株HY-G与Norcardiopsis菌属的许多菌株序列相似度都在98%以上, 其中与塘沽拟诺卡氏菌(Norcardiopsis tangguensis)和埃及拟诺卡氏菌(Norcardiopsis aegyptia)的序列相似度都为99.9%(1393/1395)。通过构建系统进化树进行进一步分析(图4), 可以看出, 菌株HY-G也与菌株Norcardiopsis tangguensis、Norcardiopsis aegyptia也聚成了一簇, 支持度为100%, 表明与这两株菌的亲缘关系较近。
3 讨论
β-葡萄糖苷酶广泛存在于自然界中。目前已报道的β-葡萄糖苷酶中, 中性或碱性酶非常罕见, 下表列出了目前报道的几种不同来源的中性或碱性β-葡萄糖苷酶。可以看出, 这几种中性或碱性β-葡萄糖苷酶都是来自于细菌且多数都是来自芽孢杆菌, 如嗜热采油芽孢杆菌(Geobacillus thermodenitrificans)、环状芽胞杆菌嗜碱性亚种(Bacillus circulanssubsp.alkalophilus)、枯草芽孢杆菌(Bacillus subtilis)等, 目前, 放线菌未见产生中性或碱性β-葡萄糖苷酶的报道。在拟诺卡氏菌中, 有关于拟诺卡氏菌产生 耐热型α-淀粉酶[11]、碱性蛋白酶[12]和丝氨酸内肽酶[13]等报道, 但未见该属微生物产生β-葡萄糖苷酶的报道。该菌株产生的β-葡萄糖苷酶, 分子质量与其他中性或碱性β-葡萄糖苷酶相近, 最适温度也相差不大, 但与芽孢杆菌所不同的是, 海洋拟诺卡氏菌株HY-G中的β-葡萄糖苷酶是属于胞内酶。

图4 海洋放线菌菌株HY-G的系统进化分析 Fig. 4 Phylogenetic tree showing the relationships among strain HY-G and Nocardiopsis species.

表4 目前报道的几种中性或碱性β-葡萄糖苷酶 Tab. 4 Features of some reported neutral or alkaline β-glucosidase
拟诺卡氏菌是一种比较稀有的放线菌, 目前已经鉴定的有30余种(NCBI - taxonomy, 2012)。海洋拟诺卡氏菌株HY-G分离自河北乐亭海滩, 由于其地理位置与天津塘沽很近, 并且它们的16S rRNA基因也高度相似, 因此该菌株与塘沽拟诺卡氏菌的关系尚需进一步确认。
海洋高盐碱性这一特殊环境, 可能造成海洋微生物能产生不常见的中性或碱性糖苷酶, 例如碱性淀粉酶[14]、碱性纤维素酶[15]等; 海洋拟诺卡氏菌株HY-G能产生碱性β-葡萄糖苷酶, 可能也与其所生存的海洋环境有关。由于大多数普通β-葡萄糖苷酶在pH>7时活力较低, 而中性或碱性β-葡萄糖苷酶在这种情况下具有最佳的水解活力, 因此能够拓展β-葡萄糖苷酶的应用场合。海洋拟诺卡氏菌株HY-G具有营养需求简单、培养条件温和、容易形成菌丝体颗粒而便于收获胞内酶等特点; 其产生的β-葡萄糖苷酶是一种中性酶, 不仅酶活力较高, 而且酶分子质量较小, 便于采用基因工程手段进行克隆和高效表达。因此, 该菌株及其所产的酶具有良好的开发应用前景。
[1] 邵金辉, 韩金祥, 朱有名, 等.β-葡萄糖苷酶在工农医领域的应用 [J]. 生命的化学, 2005, 25(1): 22- 24.
[2] 刘欣, 崔昱, 杨凌. 糖苷酶与药物研发 [J]. 天然产物研究与开发, 2005, 17(2): 223- 228.
[3] 吴少杰, 焦豫良, 朱强, 等. 海洋拟诺卡氏菌株HY-G转化大豆异黄酮苷发酵条件的优化 [J]. 食品科学, 2011, 32(7): 273- 278.
[4] Markku S, Juha K P, Erkko Y, et al. Enzymatic properties and intracellular localization of the novelTrichoderma reeseiβ-glucosidase BGLII (Cel1A) [J]. Appl Environ Microbiol, 2002, 68(9): 4546-14553.
[5] 潘利华, 罗建平.β-葡萄糖苷酶的研究及应用进展 [J]. 食品科学, 2006, 27(12): 803- 807.
[6] 王志江, 魏红福.β-葡萄糖苷酶的研究 [J]. 饲料工业, 2006, 27(12): 20- 22.
[7] Paavilainen S, Hellman J, Korpela T. Purification, characterization, gene cloning, and sequencing of a newβ-glucosidase fromBacillus circulanssubsp.Alkalophilus[J]. Appl Environ Microbiol, 1993, 59(3): 927- 932.
[8] 陈红漫, 赵璐, 杨佳影. 一株产胞外中性β-葡萄糖苷酶菌株的鉴定及酶学特性研究 [J]. 食品科学, 2009, 30(15): 160- 163.
[9] Singh A, Hayashi K. Construction of Chimericβ-glucosidases with improved enzymatic properties [J]. J Biol Chem, 1995, 270(37): 21982- 21933.
[10] 冯露, 王磊, 袁刚, 等. 一种嗜热碱性β-葡萄糖苷酶及其编码基因. 中国专利, 200510116748.9, 2006.
[11] Stamford T L M, Stamford N P, Coelho L C B B, et al. Production and characterization of a thermostable α-amylase fromNocardiopsissp. endophyte of yam bean [J]. Bioresource Technol, 2001, 76:137- 141.
[12] Moreira K A, Porto T S, Teixeira M F S, et al. New alkaline protease fromNocardiopsissp.: partial purification and characterization [J]. Process Biochem, 2003, 39:67- 72.
[13] Dixit V S, Pant A. Comparative characterization of two serine endopeptidases fromNocardiopsissp. NCIM 5124 [J]. BBA-Gen Subjects, 2000, 1523:261- 268.
[14] 戴世鲲, 郑天凌, 王晓颖, 等. 深海产低温碱性淀粉酶菌Halomonas sp.W7的筛选及发酵条件研究. 海洋科学, 2007, 31(11): 27-32.
[15] 徐庆强, 张志明, 王延明, 等. 产碱性纤维素酶海洋细菌的筛选、鉴定及酶学性质研究. 海洋科学, 2009, 33(7): 1-5.

