葡萄糖调节蛋白78 在大鼠肝肺综合征肺微血管重构中的作用*
贾建桃, 张慧英△, 郭建红, 李 晨, 吕敏丽,张丽丽, 张翠英, 李宝红, 赵中夫, 韩德五, CHENG Ji
(1 长治医学院病理生理学教研室,山西 长治046000;2山西医科大学肝病研究所,山西 太原030001;3长治医学院生理学教研室,山西 长治046000;4山西医科大学第二医院ICU,山西 太原030001;5长治医学院肝病研究所,山西 长治046000;6美国南加州大学KECK 医学院肝病研究中心,加利福尼亚州 洛杉矶90089)
肝肺综合征(hepatopulmonary syndrome,HPS)是肝硬化早期出现的一种肺微血管紊乱性疾病[1],一旦发生,即可加重原发肝脏疾病并促进其它并发症的发生。葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)不仅是内质网应激的标记分子[2],而且其高表达也与多种疾病的发生密切相关[3]。我们前期工作已经证实,HPS 大鼠肺微血管数量随病程进展逐渐增多[4];肝硬化时形成的肠源性内毒素血症作为内质网应激的重要应激原,激活肺组织的内质网应激反应导致GRP78 表达增高,很可能是HPS发病的关键因素[5]。由于GRP78 过表达在多种疾病发生中具有促增殖和抑凋亡作用[6-7],由此,我们推测在HPS 发病中,高表达的GRP78 也可能是通过该种机制导致了肺微血管的重构。本项研究通过观察复合致病因素诱导的肝硬化合并HPS 大鼠发病过程中肺组织GRP78 以及肺微血管增生和凋亡相关因子的表达变化,探讨GRP78 对肺微血管重构的作用机制,为临床HPS 以及其它并发症的预防和治疗提供理论依据。
材 料 和 方 法
1 材料
1.1 动物 Wistar 清洁级大鼠,由山西医科大学动物实验中心供应。
1.2 主要试剂 兔抗大鼠GRP78 多克隆抗体购自Sigma;血管内皮生长因子(vascular endothelial growth factor,VEGF)、C/EBP 同源蛋白(C/EBP homologous protein,CHOP)/生长阻滞及DNA 损伤诱导蛋白153(growth arrest and DNA damage-inducible protein 153,GADD153)多克隆抗体购自Santa Cruz;caspase-12、核因子(nuclear fator,NF)-κB 、Bcl-2 和Ⅷ因子相关抗原(factor Ⅷ-related antigen,FⅧ-RAg)多克隆抗体均购自北京博奥森生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG 购自北京中杉金桥生物技术有限公司;鼠抗兔3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体和辣根过氧化物酶标记山羊抗小鼠IgG 均购自碧云天生物技术研究所;SuperECL Plus 超敏发光液和BCA 法蛋白定量试剂盒购自普利莱基因技术有限公司;Trizol 试剂盒和RT-PCR 试剂盒购自Gibco;TaqDNA 聚合酶购自Promega;VEGF 和GAPDH 引物由生物工程上海有限公司合成。
2 方法
2.1 动物分组与模型建立 雄性Wistar 大鼠,体重200 ~240 g,随机分为4 周、6 周、8 周3 个时点组,每个时点组随机分为正常对照组和模型组。对照组动物给予标准饲料和饮用矿物质水,模型组动物用复合致病因素法复制肝硬化合并HPS 模型[4-5]。分别于各时点,全麻、无菌、无内毒素条件下经腹主动脉采集血液,3 000 r/min 离心15 min,吸取血浆,-70℃保存备用;取部分肝组织和肺组织立即置于液氮中保存备用,其余组织用中性甲醛缓冲液固定,用于组织学研究。
2.2 免疫组化法检测肺组织GRP78、FⅧ-RAg、CHOP/GADD153、caspase-12、Bcl-2 和NF-κB 的表达
以石蜡包埋的肺组织标本制备4 μm 切片,经脱蜡、水化和抗原修复处理后,采用SP 法,遵照说明书进行(Ⅰ抗分别为兔抗大鼠GRP78、F Ⅷ-RAg、GADD153、caspase-12、Bcl-2 和NF-κB 多 克 隆 抗体),DAB 显色,苏木精复染,脱水、透明、封片、镜检。用PBS 代替Ⅰ抗作为阴性对照。棕黄色颗粒为染色阳性颗粒,采用BI-2000 医学图像分析系统(成都泰盟科技有限公司),在光学显微镜下每张切片随机取10 个视野,分别计算细胞平均吸光度值(NF-κB 分别计数每个视野中胞浆阳染细胞和胞核阳染细胞占总细胞的百分比),取平均值进行统计学分析。
2.3 RT-PCR 法检测肺组织中VEGF mRNA 的表达
取肺组织100 mg,提取总RNA,紫外分光光度计检测波长为260 nm 和280 nm 时的吸光度(A),两者的比值代表RNA 纯度及浓度。取50 μg 总RNA 按照说明书进行逆转录和扩增。VEGF 引物序列上游引物5'-CTG CTC TCT TGG GTG CAC TG-3',下游引物5'-CTG CGG ATC TTG GAC AAA CA-3',扩增片段长度465bp;GAPDH 为内参照,上游引物5'-GGT CAT CAA CGG GAA ACC C-3',下游引物5'-TCT GAG TGG CAG TGA TGG CA-3',扩增片段长度450 bp。扩增参数:95 ℃预变性2 min,95 ℃30 s,58 ℃30 s,72 ℃30 s,进行30 个循环,最后72 ℃5 min。DNA标准(D12000)确定PCR 产物大小,经2%琼脂糖凝胶电泳,于凝胶成像分析仪上进行光密度扫描并采用Quantity One 凝胶分析系统(Bio-Rad)测定目的条带与GAPDH 条带的吸光度,以两者的比值表示目的mRNA 的相对含量。
2.4 Western blotting 法检测肺组织中VEGF 的表达
取肺组织超声裂解后,BCA 法蛋白定量。取150 μg 蛋白,变性,上样,经10% SDS-PAGE 凝胶电泳后,电转移至硝酸纤维素膜,封闭后加入兔抗大鼠VEGF 多克隆抗体(1∶800 稀释)4 ℃过夜,洗涤后加入辣根酶标记山羊抗兔IgG(1∶800 稀释)室温1 h,洗涤后加ECL 超敏发光液,X 线胶片曝光、显影。以GAPDH 为内参照。采用分子生物学图像分析系统进行定量扫描测定条带灰度值,将每个样本的灰度值与相应GAPDH 的灰度值相比,计算蛋白的表达水平。
3 统计学处理
采用SPSS 13.0 软件分析,数据以均数±标准差(mean±SD)表示,单因素方差分析法比较多个样本均数,采用LSD-t 检验法进行均数之间的两两比较,线性相关法分析两两指标间的相关性,以P <0.05为差异有统计学意义。
结 果
1 肺组织中GRP78、FⅧ-RAg、CHOP/GADD153、caspase-12、Bcl-2 和NF-κB 的表达
免疫组织化学结果显示,GRP78 和FⅧ-RAg 在胞浆和胞膜上均有表达,胞核未见着色;模型组两者染色强度和数量均随病程进展逐渐升高并显著高于对照组,GRP78 在8 周组显著高于4 周组(P <0.05),FⅧ-RAg 8 周组与4 周和6 周组均有显著差异(P <0.05)。CHOP/GADD153 和caspase-12 在胞浆中表达;模型组两者染色强度和数量随病程进展逐渐降低,8 周组CHOP/GADD153 显著低于4 周和6 周组(P <0.05),caspase-12 在6 周和8 周组明显低于4 周组(P <0.05)。Bcl-2 在胞浆中表达;模型组染色强度和数量随病程进展呈增高趋势,且明显高于正常对照组(P <0.05)。NF-κB 在正常对照组仅有少量表达,模型组随病程进展逐渐增多,尤其以胞核的表达增加明显,见图1 ~6 和表1 ~3。
2 肺组织中VEGF mRNA 和蛋白的表达
模型组VEGF mRNA 表达在4 周组和6 周组显著高于正常对照组(P <0.05);蛋白的表达随病程进展而逐渐增加(P <0.05),见图7、8。
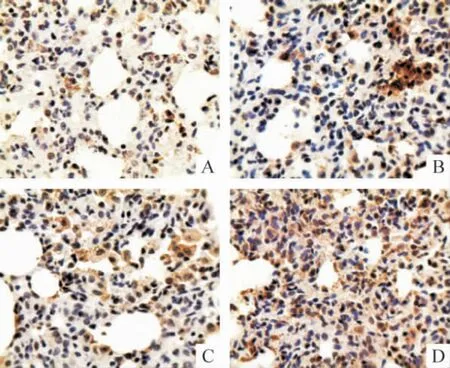
Figure 1. The expression of GRP78 protein in lung tissues detected by immunohistochemistry (×400). A:control;B:HPS at the 4th week;C:HPS at the 6th week;D:HPS at the 8th week.图1 HPS 大鼠肺组织GRP78 蛋白表达变化
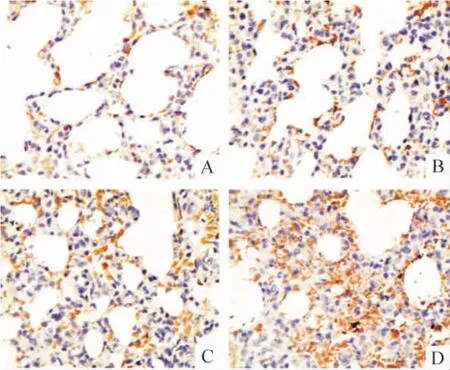
Figure 2. The expression of FⅧ-RAg protein in lung tissues detected by immunohistochemistry(×400). A:control;B:HPS at the 4th week;C:HPS at the 6th week;D:HPS at the 8th week.图2 HPS 大鼠肺组织FⅧ-RAg 蛋白表达变化
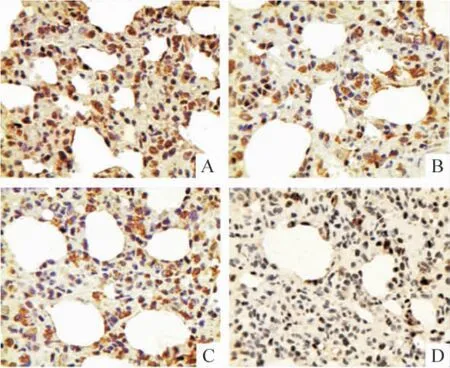
Figure 3. The expression of CHOP/GADD153 protein in lung tissues detected by immunohistochemistry (×400).A:control;B:HPS at the 4th week;C:HPS at the 6th week;D:HPS at the 8th week.图3 HPS 大鼠肺组织CHOP/GADD153 蛋白表达变化
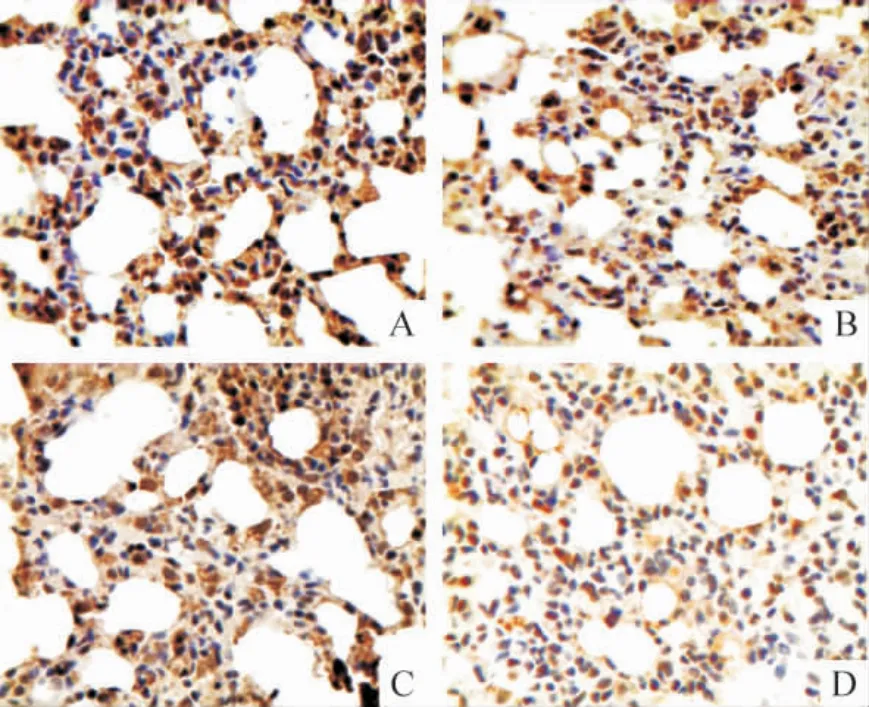
Figure 4. The expression of caspase-12 protein in lung tissues detected by immunohistochemistry (×400). A:control;B:HPS at the 4th week;C:HPS at the 6th week;D:HPS at the 8th week.图4 HPS 大鼠肺组织caspase-12 蛋白表达变化
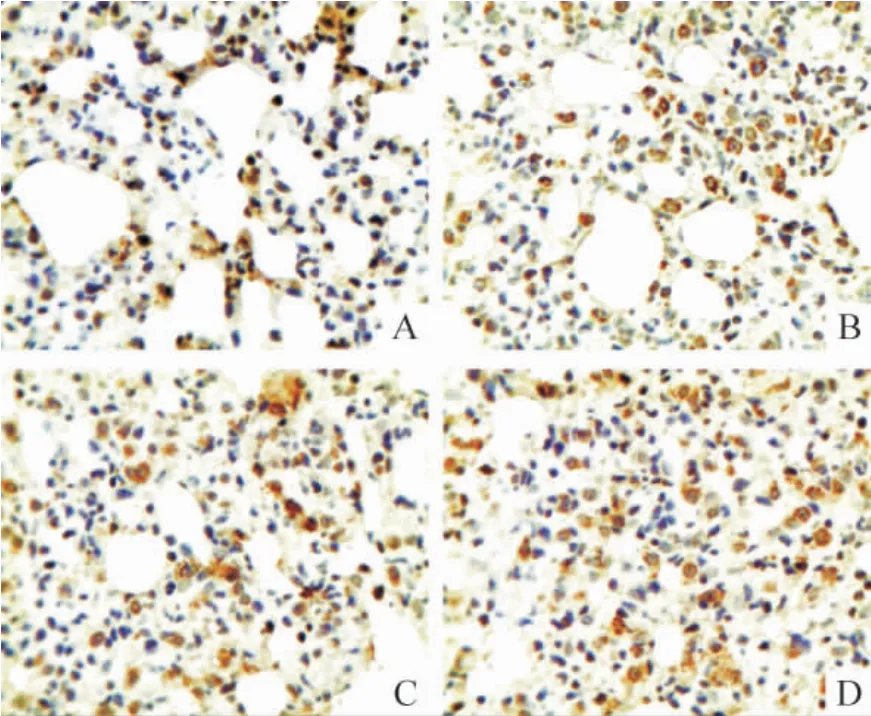
Figure 5. The expression of Bcl-2 protein in lung tissues detected by immunohistochemistry (×400). A:control;B:HPS at the 4th week;C:HPS at the 6th week;D:HPS at the 8th week.图5 HPS 大鼠肺组织Bcl-2 蛋白表达变化
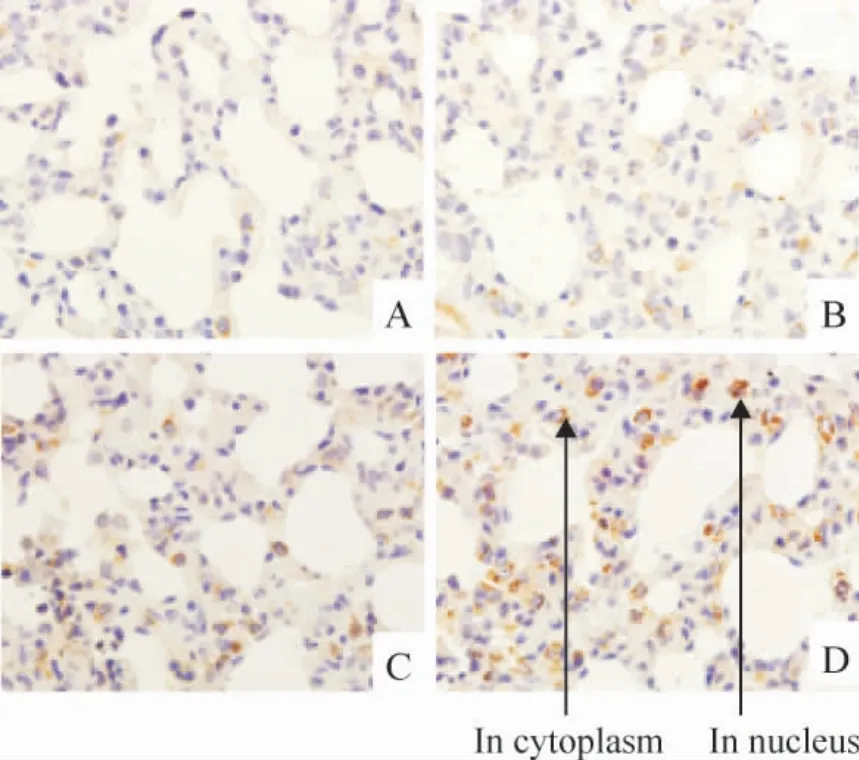
Figure 6. The expression of NF-κB protein in lung tissues detected by immunohistochemistry (×1 000). A:control;B:HPS at the 4th week;C:HPS at the 6th week;D:HPS at the 8th week.图6 HPS 大鼠肺组织NF-κB 蛋白表达变化
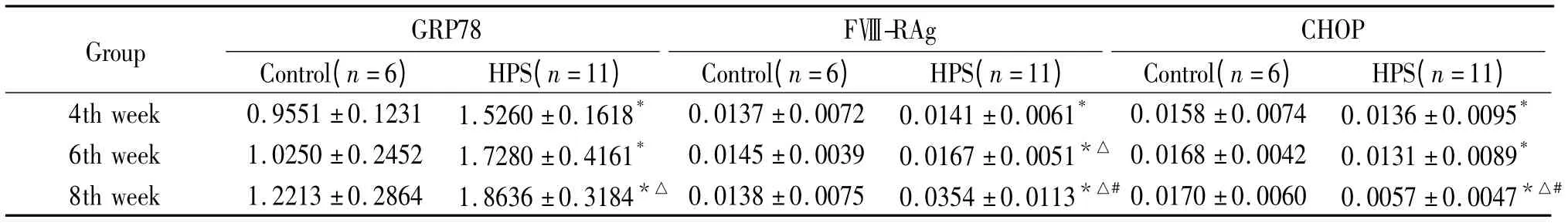
表1 各时点对照组和模型组HPS 大鼠肺组织GRP78、FⅧ-RAg 和CHOP/GADD153 水平变化Table 1. Content of GRP78,FⅧ-RAg and CHOP/GADD153 of lung tissue in control and HPS groups(mean±SD)
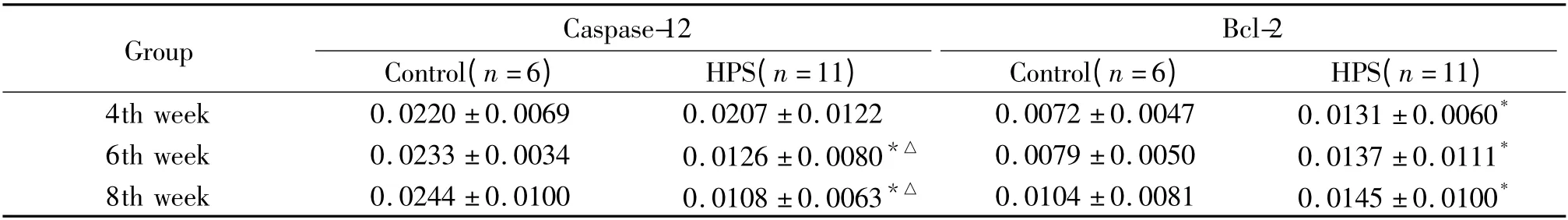
表2 各时点对照组和模型组HPS 大鼠肺组织caspase-12 和Bcl-2 水平变化Table 2. Content of caspase-12 and Bcl-2 of lung tissue in control and HPS groups(mean±SD)

表3 各时点对照组和模型组HPS 大鼠肺组织NF-κB 水平变化Table 3. Content of NF-κB of lung tissue in control and HPS groups(mean±SD)
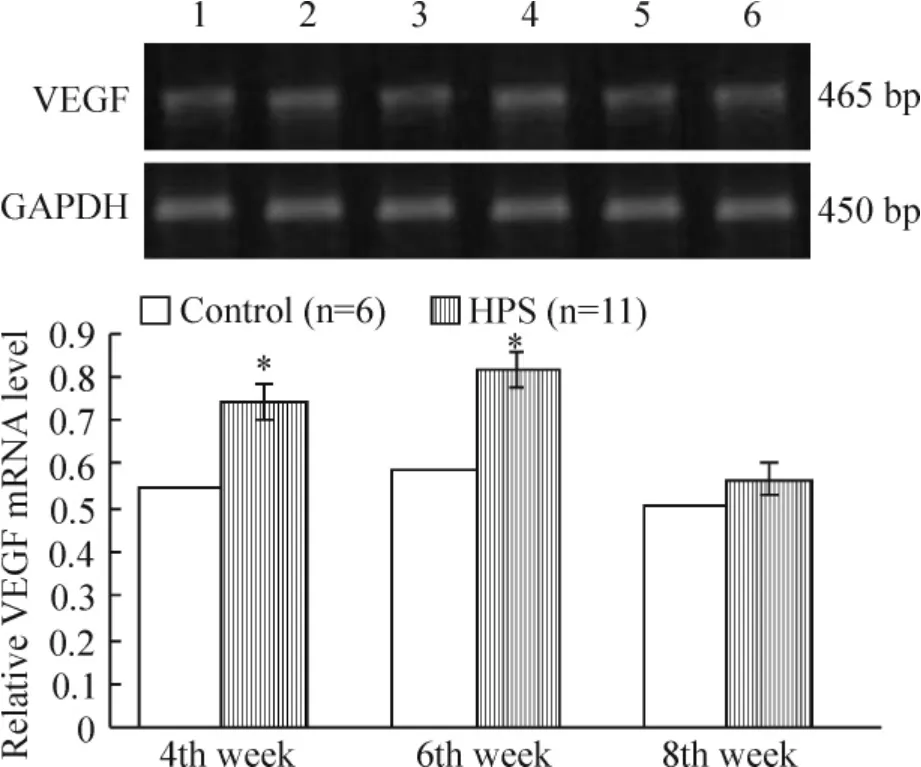
Figure 7. The mRNA level of VEGF in rat lung tissues from control and HPS groups. 1:control at the 4th week;2:HPS at the 4th week;3:control at the 6th week;4:HPS at the 6th week;5:control at the 8th week;6:HPS at the 8th week. Mean±SD. * P <0.05 vs control.图7 大鼠肺组织VEGF mRNA 的表达
3 相关性分析
肺组织GRP78 蛋白表达水平与肺组织VEGF(r=0.7750,P <0.01)和FⅧ-RAg 蛋白(r =0.7824,P <0.01)的表达呈正相关,与CHOP/GADD153(r =-0.6921,P <0.01)和caspase-12(r=-0.7012,P <0.01)的表达呈负相关。
讨 论
内质网(endoplasmic reticulum,ER)是细胞内重要的细胞器,内毒素[5]、缺氧和Ca2+紊乱等是引起ER 应激(ER stress,ERS)的重要应激原,并启动内质网应激反应信号通路:(1)通过减少蛋白质的翻译,阻止未折叠蛋白进一步积聚;(2)上调分子伴侣GRP78 和GRP94 蛋白以及有利于蛋白折叠和恢复内环境功能的各种蛋白的基因表达,增强蛋白折叠能力,在后期则通过泛素-蛋白酶体系统清除误折叠蛋白;(3)免疫和抗凋亡介质NF-κB 激活;(4)内质网功能严重受损时,启动凋亡途径清除损伤细胞,包括CHOP/GADD153 的转录激活、c-Jun 氨基端激酶通路的激活和内质网相关凋亡蛋白酶caspase-12的激活[8]。在不同病理情况下,依据ERS 的程度,促细胞生存和促细胞凋亡信号相互作用,最终决定细胞的存亡[9-11]。本项研究中,HPS 动物肺组织中内质网应激相关信号分子GRP78、caspase-12、GADD153和NF-κB 的变化,进一步证明了内质网应激在HPS发病中的重要作用。
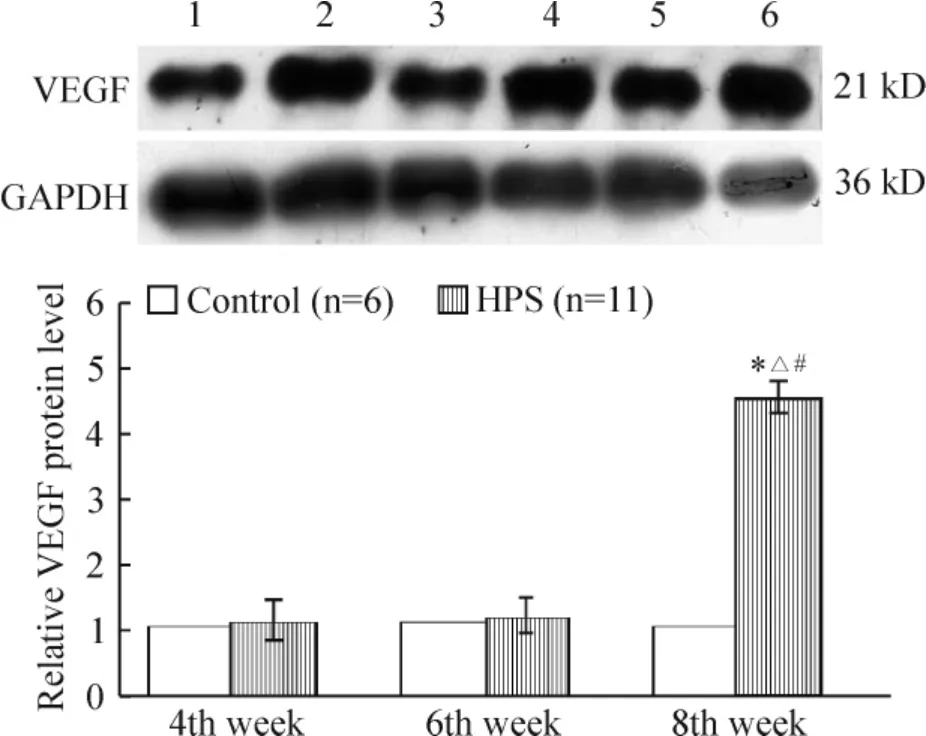
Figure 8. The protein level of VEGF in rat lung tissues from control and HPS groups. 1:control at the 4th week;2:HPS at the 4th week;3:control at the 6th week;4:HPS at the 6th week;5:control at the 8th week;6:HPS at the 8th week. Mean ±SD. * P <0.05 vs control;△P <0.05 vs 4th week;#P <0.05 vs 6th week.图8 大鼠肺组织VEGF 蛋白的表达
肺微血管重构是肝肺综合征发病的中心环节。FⅧ-RAg 是特异性血管标记物,其含量的变化可较为直观地反映血管密度。VEGF 不仅具有特异性促血管内皮细胞增生和血管生成的特征,而且还具有改变细胞外基质的作用,是生理和病理过程中多数因子促进血管重构的共同通路。研究证实,GRP78可以直接或者通过VEGF 促进血管增生[12-13]。本项研究中,肺组织中FⅧ-RAg 及VEGF 蛋白表达随病程进展逐渐升高,而且增高的GRP78 蛋白与升高的VEGF 和FⅧ-RAg 分别呈正相关。表明在HPS 发病过程中,GRP78 很可能是引起肺微血管重构的关键因子。
血管内皮细胞增殖和凋亡的力量对比是决定血管增生程度的重要机制。GRP78 具有正向和负向双重调节细胞生长的作用[3,14]。生理情况下,GRP78在胞浆中表达,发挥促进细胞凋亡、抑制血管增殖的作用[2];病理情况下,GRP78 在胞浆中表达异常增高,并转运至胞膜作为受体发挥刺激细胞增殖、抑制凋亡和促进新血管生成等作用[2,6-7]。GRP78 的促增殖作用是通过与多种胞外配体(如activated α2-macroglobulin 和Kringle 5 等)或内皮细胞表面锚定蛋白(如表皮生长因子家族的Cripto 蛋白)形成复合物而发挥的[7]。GRP78 也可以通过活化NF-κB 促进细胞增殖,这种作用是通过Bcl-2 抗凋亡途径、MAPK 信号通路和PI3-激酶通路所发挥的[15]。目前认为GRP78 可能的抑凋亡机制如下,通过其自身的ATP结构域与caspase-7 和caspase-12 形成复合物,阻止caspase-12 的释放[16-17];下调活化转录因子6 或蛋白激酶R 样内质网激酶通路,减少CHOP/GADD153 的产生;对抗Bcl-2 家族中促凋亡蛋白的作用[18]。此外,Bcl-2 家族中具有抗凋亡作用的Bcl-2 等分子还可以下调CHOP/GADD153 而发挥抗凋亡作用[19-20]。本研究观察到在HPS 发病过程中,GRP78 表达逐渐增高,与表达逐渐减少的caspase-12 和CHOP/GADD153 显著相关,抗凋亡蛋白Bcl-2 表达逐渐增高,NF-κB 活化,说明在HPS 发病过程中,GRP78 的高表达很可能是通过VEGF 途径促进细胞增殖和通过阻止caspase-12 释放以及减少CHOP 表达抑制凋亡,促进了肺微血管的重构。
[1] Ho V. Current concepts in the management of hepatopulmonary syndrome[J]. Vasc Health Risk Manag,2008,4(5):1035-1041.
[2] Ni M,Lee AS.ER chaperones in mammalian development and human diseases[J]. FEBS Lett,2007,581(19):3641-3651.
[3] Gonzalez-Gronow M,Selim MA,Papalas J,et al.GRP78:a multifunctional receptor on the cell surface[J]. Antioxid Redox Signal,2009,11(9):2299-2306.
[4] Zhang HY,Han DW,Su HR,et al. Intestinal endotoxemia plays a central role in development of hepatopulmonary syndrome in a cirrhotic rat model induced by multiple pathogenic factors [J]. World J Gastroenterol,2007,13(47):6385-6395.
[5] 贾建桃,张慧英,田小霞,等.糖调节蛋白78 在复合致病因素诱导的大鼠肝肺综合征中的作用[J].中国病理生理杂志,2011,27(8):1580-1585.
[6] Weng WC,Lee WT,Hsu WM,et al.Role of glucose-regulated protein 78 in embryonic development and neurological disorders[J]. J Formos Med Assoc,2011,110(7):428-437.
[7] Ni M,Zhang Y,Lee AS. Beyond the endoplasmic reticulum:atypical GRP78 in cell viability,signalling and therapeutic targeting[J].Biochem J,2011,434(2):181-188.
[8] Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J]. Cell Death Differ,2004,11(4):381-389.
[9] Puskás LG,Fehér LZ,Vizler C,et al.Polyunsaturated fatty acids synergize with lipid droplet binding thalidomide analogs to induce oxidative stress in cancer cells[J]. Lipids Health Dis,2010,9:56.
[10]刘 颖,纪 超,吴伟康.附子多糖保护缺氧/复氧乳鼠心肌细胞及其抗内质网应激的机制研究[J].中国病理生理杂志,2012,28(3):549-463.
[11]岳 雯,姚树桐,鲍 颖,等.槲皮素对毒胡萝卜素诱导的巨噬细胞内质网应激凋亡途径的抑制作用及机制[J].中国病理生理杂志,2012,28(3):518-523.
[12]Raiter A,Weiss C,Bechor Z,et al.Activation of GRP78 on endothelial cell membranes by an ADAM15-derived peptide induces angiogenesis[J]. J Vasc Res,2010,47(5):399-411.
[13]Yoo SA,You S,Yoon HJ,et al.A novel pathogenic role of the ER chaperone GRP78/BiP in rheumatoid arthritis[J].J Exp Med,2012,209(4):871-886.
[14]Kudo T.Therapeutic strategies for Alzheimer disease based on endoplasmic reticulum stress [J]. Nihon Shinkei Seishin Yakurigaku Zasshi,2010,30(4):163-168.
[15] Misra UK,Deedwania R,Pizzo SV. Activation and crosstalk between Akt,NF-κB,and unfolded protein response signaling in 1-LN prostate cancer cells consequent to ligation of cell surface-associated GRP78[J]. J Biol Chem,2006,281(19):13694-13707.
[16]Fu HY,Minamino T,Tsukamoto O,et al.Overexpression of endoplasmic reticulum-resident chaperone attenuates cardiomyocyte death induced by proteasome inhibition[J].Cardiovasc Res,2008,79(4):600-610.
[17]Rao RV,Peel A,Logvinova A,et al.Coupling endoplasmic reticulum stress to the cell death program:role of the ER chaperone GRP78[J]. FEBS Lett,2002,514(2-3):122-128.
[18] Gorbatyuk MS,Knox T,LaVail MM,et al. Restoration of visual function in P23H rhodopsin transgenic rats by gene delivery of BiP/Grp78[J]. Proc Natl Acad Sci U S A,2010,107(13):5961-5966.
[19] McCullough KD,Martindale JL,Klotz LO,et al. Gadd153 sensitizes cells to endoplasmic reticulum stress by downregulating Bcl-2 and perturbing the cellular redox state[J].Mol Cell Biol,2001,21(4):1249-1259.
[20]Su HL,Liao CL,Lin YL.Japanese encephalitis virus infection initiates endoplasmic reticulum stress and an unfolded protein response[J].J Virol,2002,76(9):4162-4171.
——疾病防治的新靶标

