Bmi-1 促人胶质瘤SNB19 细胞生长恶化的作用机制*
蒋丽丽, 杨昌山, 赵灿国
(广州医学院病理生理学教研室,广东 广州510182)
胶质瘤是中枢神经系统肿瘤中最常见的恶性肿瘤,约占全部颅内肿瘤的40%~50%。胶质瘤预后很差,其1 年累计生存率仅有30%,而多形性胶质母细胞瘤(glioblastoma multiforme,GBM)的平均生存时间不到一年[1];由于恶性胶质瘤具有侵袭性生长的特性,瘤灶往往与周围脑组织边界不清,尽管现代显微外科技术、放疗、化疗等综合治疗措施已获得巨大的进展,但是目前临床上也难以做到病理学上的全切除,胶质瘤术后复发率非常高,这也是导致胶质瘤高死亡率的主要因素[2]。此外,肿瘤细胞的迅速繁殖和肿瘤内部血管大量增生,也是导致肿瘤进展快、病人迅速致死,以及术后复发的重要因素[3]。所以,针对胶质瘤高速增殖、高度侵袭性、血管大量增生的研究成为目前胶质瘤研究的热点,找到抑制胶质瘤增殖、侵袭和血管增生的方法可能成为治疗胶质瘤、预防胶质瘤复发的有效途径。
Bmi-1(B lymphoma Mo-MLV insertion region 1 homolog)是多梳家族(polycomb group,PcG)成员之一,能与该家族其它成员形成蛋白复合体,作用于染色质上的多梳基因反应元件(polycomb response elements,PREs),通过调控组蛋白的乙酰化或去乙酰化修饰过程,影响细胞增殖、凋亡过程[4-6]。已有研究在人胶质瘤中证实,Bmi-1 的表达水平与胶质瘤的病理分级和预后密切相关。Bmi-1 能够通过激活核因子kappa B(nuclear factor kappa B,NF-κB)细胞信号通路,启动下游相关基因表达,从而增强细胞抗凋亡和侵袭的能力,进一步促进胶质瘤的发生发展[7-8]。而NF-κB 作为一种广泛存在于真核细胞内的转录因子,通过其转录调控活性,诱导一系列下游靶基因的表达,参与促进细胞增殖,促进细胞运动及血管生长等多种生物学过程[9]。大量研究证实NF-κB 信号途径在胶质瘤中被广泛激活并参与促进胶质瘤发生发展过程[10]。
本研究在胶质瘤SNB19 细胞中提高或降低Bmi-1 的表达,通过一系列生物学实验,探讨Bmi-1对SNB19 细胞的增殖、侵袭运动和血管生成能力的影响,以期寻找胶质瘤发生发展过程中的重要影响因素,从而为临床控制和治疗胶质瘤,提高患者生存率提供理论研究基础。
材 料 和 方 法
1 细胞系及其培养
人胶质瘤SNB19 细胞用含有10%胎牛血清,1%双抗的DMEM 培养基培养,孵育37 ℃,饱和湿度和5%CO2条件下培养,每2 ~3 d 传代1 次,取对数生长期细胞进行实验。NF-κB 抑制剂JSH-23 购自EMD。
2 免疫印迹法
蛋白裂解液裂解细胞,并用超声破碎仪破碎细胞DNA。96 孔板BCA 法进行蛋白浓度测定。SDS变性蛋白质电泳法检测蛋白表达水平。9%的聚丙烯酰胺凝胶电泳分离蛋白;三明治法正确放置凝胶和PVDF,70 V 电压转移3 ~4 h;取出PVDF 膜,将PVDF 膜浸入封闭液中,37℃平缓摇动1 h;将PVDF膜浸入含5 mL Ⅰ抗的杂交袋中,排尽气泡,封口,4℃平缓摇动过夜;TBS/T 漂洗干净后,将PVDF 膜浸入含5 mL Ⅱ抗的杂交袋中,排尽气泡,封口,37℃平缓摇动1 h;再经TBS/T 充分漂洗,ECL 化学发光及胶片曝光对比结果。
3 实时荧光定量PCR
Trizol 法提取细胞总RNA;RNA 反转录为cDNA;PCR 反应体系:上游引物1 μL;下游引物1 μL;工作液Master Mix 10 μL;灭菌水4 μL;cDNA3 μL;PCR 反应条件:50 ℃2 min;5 ℃10 min;95 ℃15 s;60 ℃1 min;60 个循环。
引物序列:cyclin D1 上游引物5'-AACTACCTGGACCGCTTCCT-3',下游引物5'-CCACTTGAGCTTGTTCACCA-3';Myc 上游引物5'-TCAAGAGGCGAACACACAAC-3',下游引物5'-GGCCTTTTCATTGTTTTCCA-3';Twist 上游引物 5'-GGAGTCCGCAGTCTTACGAG-3',下 游 引 物 5'-TCTGGAGGACCTGGTAGAGG-3';MMP-9 上游引物5'-ACGACGTCTTCCAGTACCGA-3',下游引物5'-TTGGTCCACCTGGTTCAACT-3',上 游 引 物 5'-GTGTCCAGTGTAGATGAACTC-3';VEGF-C 下游引物5'-ATCTGTAGACGGACACACATG-3',GAPDH 上游引物5'-GACTCATGACCACAGTCCATGC-3',下游引物5'-AGAGGCAGGGATGATGTTCTG-3'。
4 MTT 比色法
收集对数期细胞,调整细胞浓度至3 ×107/L,分种于96 孔板,每孔100 μL,即3 000 cells/well;每24 h 向待测孔中加入5 g/L MTT 溶液20 μL;再将96 孔板置37 ℃、5%CO2培养箱继续培养4 h;小心吸去培养基,加入100 μL DMSO 置摇床上低速振荡10 min,使结晶物充分溶解;在酶联免疫检测仪570 nm测量各孔的吸光度值。
5 Transwell 小室体外侵袭实验
24 孔板内放置Transwell 小室,Matrigel 混合液均匀铺于小室上层底部;准备好的细胞悬液(1 ×104细胞)(不含血清),加至小室上层;小室下层加入含10%FBS 的DMEM 培养基,37 ℃孵箱培养;22 ~24 h后,取出小室,用大枪头吸除小室底部Matrigel,以1×PBS 洗2 次;用甲醇/冰醋酸(V/V=3/1)混合液固定小室膜上的细胞,室温,10 ~15 min;1 ×PBS 洗1次,苏木素复染10 ~15 min,自来水漂洗,洗去多余蓝色;显微镜下观察,随机选取10 个视野进行统计计数。
6 血管内皮细胞成管实验
人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)细胞无血清培养24 h;取200 μL matrigel 铺于24 孔板;HUVECs 细胞以条件培养基重悬至2 ×104/300 μL,铺于24 孔板孔中Matrigel上;37 ℃细胞孵育箱中孵育20 h;倒置显微镜下观察拍照,比较各处理组细胞成管数的差异。
7 质粒、转染及双荧光报告基因系统
pMSCV/Bmi-1 及pSuper-retro-Bmi-1-RNAi 由中山大学附属肿瘤医院宋立兵教授赠予[11]。质粒pNF-κB-luc 购自Clontech,pRL-TK renilla 购自Promega。质粒转染试剂脂质体2000 购自Invitrogene。pNF-κB-luc 质粒(或对照质粒)100 ng 混合pRL-TK renilla 质粒10 ng,与含脂质体2000 2 μL(24 孔板每孔)的混合液充分混合后加至细胞培养液中,转染后6 h 更换新鲜培养基。继续培养至24 h 后检测各处理组细胞的NF-κB 转录活性。
用双萤光素酶报告基因检测试剂盒(Dual-luciferaseTMReport Assay Kit,购自Promega)检测萤光素酶活性,按说明书操作。吸去培养基,1 ×PBS 洗细胞1 次;每孔加入100 μL 1 ×passive lysis buffer,置摇床上剧烈振荡15 min;振荡后将每孔中的液体移入1.5 mL 离心管中,10 000 r/min 离心1 min;取20 μL上清液加入96 孔板中,置多功能酶标仪中按照Gen5软件步骤操作先加入LARⅡ100 μL 检测萤火虫萤光素酶活性,加入Stop & Glo 100 μL 停止反应后再检测海肾萤光素酶活性。所有萤火虫萤光素酶活性均以海肾萤光素酶活性正态化后得到相对值,实验数据取3 个重复孔平均值,分析比较各处理组结果。
8 细胞免疫荧光染色
玻片灭菌处理后铺于24 孔板内,将适量细胞接种于玻片上培养22 ~24 h;2%多聚甲醛(针对核蛋白)固定细胞10 min;加0.2%Triton(用PBST 稀释)室温放置5 min;加10%BSA 于水平摇床上,封闭10 min;孵Ⅰ抗(anti-NF-κB,1/100 稀释),室温孵育1 h;孵Ⅱ抗(1/500),室温避光孵育30 ~45 min;DAPI(1∶10 000,稀释),室温避光孵育10 min,;PBS 洗1~2 次后,过夜晾片,次日用anti-fade 封片。荧光显微镜下观察拍照。
9 统计学处理
实验重复3 次,数据用均数± 标准差(mean ±SD)表示。应用SPSS 13.0 软件进行统计分析,组间比较应用t 检验,以P <0.05 为差异有统计学意义。
结 果
1 在胶质瘤细胞中高表达Bmi-1 或抑制Bmi-1 的表达
构建 pMSCV-Bmi-1 以 及 pSuper-retro-Bmi-1-RNAi 质粒,磷酸钙法制备逆转录病毒,感染胶质瘤细胞SNB19;24 ~28 h 后,加入嘌呤霉素(0.5 mg/L)筛选阳性克隆,成功建立高表达和沉默Bmi-1 表达的稳定细胞株。收集细胞株的RNA 和蛋白,通过免疫印迹法检测Bmi-1 在这些细胞中的表达水平,鉴定稳定表达Bmi-1 的细胞株。结果显示,感染pMSCV-Bmi-1 病毒的细胞,Bmi-1 表达水平均比对照组有显著增加,而感染pSuper-retro-BMI-RNAi 病毒的细胞,Bmi-1 的表达被显著下调,见图1。
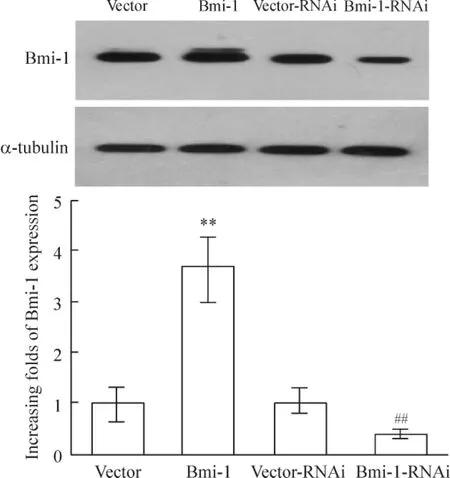
Figure 1. The protein expression of Bmi-1 in glioma cells measured by Western blotting. The glioma SNB19 cells were infected with Bmi-1 or Bmi-1-RNAi virus for 48 h and selected with puromysin (0.5 mg/L)for 4 days.Mean±SD. n=3. **P <0.01 vs vector;##P <0.01 vs vector-RNAi.图1 免疫印迹法检测Bmi-1 蛋白表达
2 Bmi-1 体外促进胶质瘤细胞增殖能力
MTT 实验结果显示,相比阴性对照组,高表达Bmi-1 的细胞具有更强的增殖生长能力,而抑制Bmi-1 表达的细胞生长增殖能力则明显变弱,见图2。结果说明,高表达Bmi-1 能够促进胶质瘤细胞的增殖,促进肿瘤的生长。
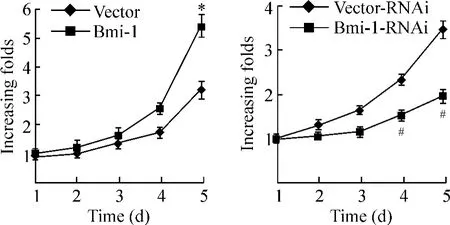
Figure 2. The proliferation of glioma cells measured by MTT assay. Mean ± SD. n =3. * P <0.05 vs vector;#P <0.05 vs vector-RNAi.图2 MTT 法检测Bmi-1 对细胞增殖能力的影响
3 Bmi-1 增强胶质瘤细胞体外侵袭运动能力
体外小室侵袭实验结果显示,与对照组细胞相比,高表达Bmi-1 的细胞更多更快地穿过小室底的Matrigel 层和底膜到达小室底的另一面,而抑制Bmi-1 表达的细胞则表现出在相同的时间内,能穿越小室Matrigel 和底膜的细胞数明显减少,见图3。说明Bmi-1 能够增强胶质瘤细胞在体外的侵袭运动能力。
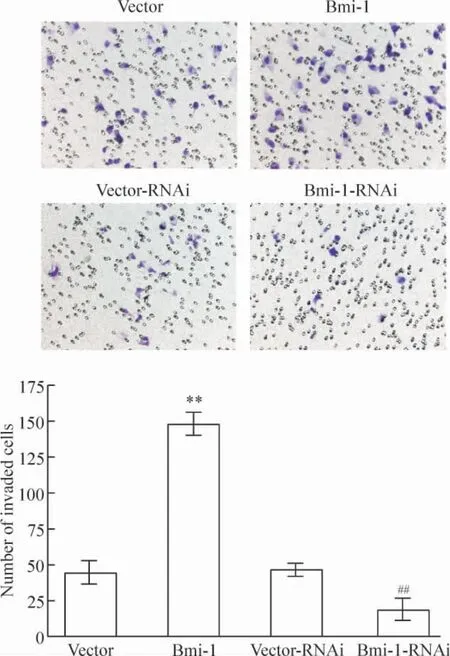
Figure 3. The invasion of glioma cells measured by Transwell matrix penetration assay (hematoxylin staining,×200).Mmean±SD. n =3. **P <0.01 vs vector;##P <0.01 vs vector-RNAi.图3 Bmi-1 对胶质瘤细胞侵袭能力的影响
4 Bmi-1 体外促进胶质瘤血管增长的能力
利用HUVECs 体外培养成管的特性,将其置于不同处理组细胞的培养上清液(无血清)中培养,结果发现,与对照组相比较,高表达Bmi-1 的细胞组,其上清液可使内皮细胞更快地形成封闭的小管;相反,抑制Bmi-1 表达的细胞组,其上清液的表现则相反,内皮细胞较少连接成管,见图4。这组结果提示Bmi-1 具有体外促进血管形成的作用。
5 Bmi-1 通过激活NF-κB 信号通路,促进胶质瘤细胞生长、运动及血管增生
应用双萤光素酶报告系统检测NF-κB 活性,结果发现,相对于对照组细胞,高表达Bmi-1 的细胞NF-κB 报告基因的萤光素酶活性明显增强,而沉默Bmi-1 表达的细胞组NF-κB 报告基因的萤光素酶活性则明显降低,见图5。这说明Bmi-1 能够激活NFκB 的转录活性。
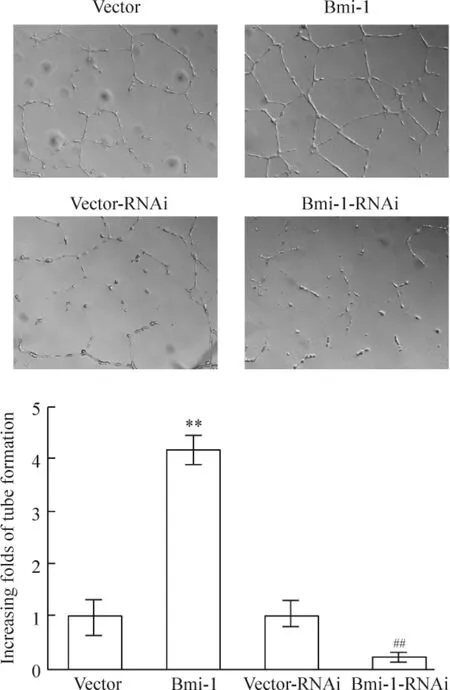
Figure 4. Tube formation of HUVECs cultured on Matrigel-coated plates with condition medium from indicated cells(×100).Mean ± SD. n =3. **P <0.01 vs vector;##P <0.01 vs vector-RNAi.图4 HUVECs 体外成管实验检测不同处理组细胞上清对血管生成的作用
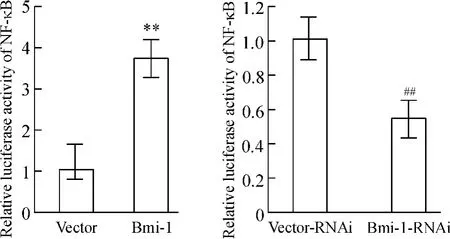
Figure 5. Transcriptional activity of NF-κB detected by dual-luciferase reporter assay. Mean±SD. n=3. **P <0.01 vs vector;##P <0.01 vs vector-RNAi.图5 双萤光素酶报告基因系统检测NF-κB 的转录活性
通过细胞免疫荧光染色检测NF-κB 在细胞内的定位发现,高表达Bmi-1 的细胞,细胞核内有明显的NF-κB 聚集,而抑制Bmi-1 表达的细胞,NF-κB 集中在细胞浆内表达,见图6。结果提示,Bmi-1 具有促进NF-κB 发生核转位的作用,进一步说明Bmi-1 能够激活NF-κB 的转录活性。
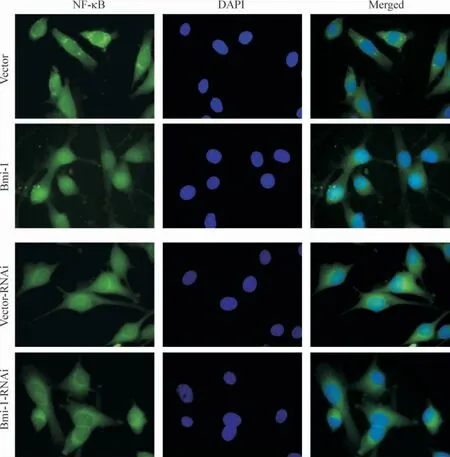
Figure 6. NF-κB location detected by cytoimmunofluorescence staining (×1 000).图6 细胞免疫荧光染色检测NF-κB 细胞内定位
通过实时荧光定量PCR 检测一系列NF-κB 下游靶基因的表达,结果发现,高表达Bmi-1 的细胞其NF-κB 下游靶基因的表达也普遍被上调,而抑制Bmi-1 表达细胞组这些基因的表达也被抑制。其中cyclin D1、Myc、Twist、MMP-9 和VEGF-C 已被证实与肿瘤细胞的增殖、运动、血管增殖密切相关,见图7。
使用NF-κB 的特异性抑制剂JSH-23 抑制NF-κB的转录活性后发现,尽管高表达Bmi-1,一旦NF-κB 活性被抑制,细胞的增殖、侵袭运动和血管增生能力也被抑制,见图8 ~10。这些结果都说明Bmi-1 是通过激活NF-κB 信号通路,进而转录激活NF-κB 下游的与细胞增殖、运动侵袭、血管增生相关的一系列基因表达,从而增强胶质瘤细胞的恶性能力。
讨 论
本文通过一系列细胞和分子生物学实验证实,Bmi-1 在胶质瘤的发生发展过程中起到重要的促进作用。高表达Bmi-1 的胶质瘤细胞呈现出更强增殖、侵袭运动和血管增生能力,而抑制Bmi-1 表达的细胞这些能力也被抑制。本文还证实Bmi-1 体外促进胶质瘤细胞这些能力的作用是通过激活NF-κB 信号通路,进而增强其下游基因的表达实现的。
已有研究证实,Bmi-1 的表达与胶质瘤临床病理分级和患者生存时间具有密切相关性。且Bmi-1 的表达能够明显抑制阿霉素处理或者紫外线照射所诱导的胶质瘤细胞的凋亡;且Bmi-1 的这种生物学功能可能是通过诱导IκB 的磷酸化激活NF-κB 的转录活性,并由此增强神经胶质瘤细胞抗凋亡能力[7]。
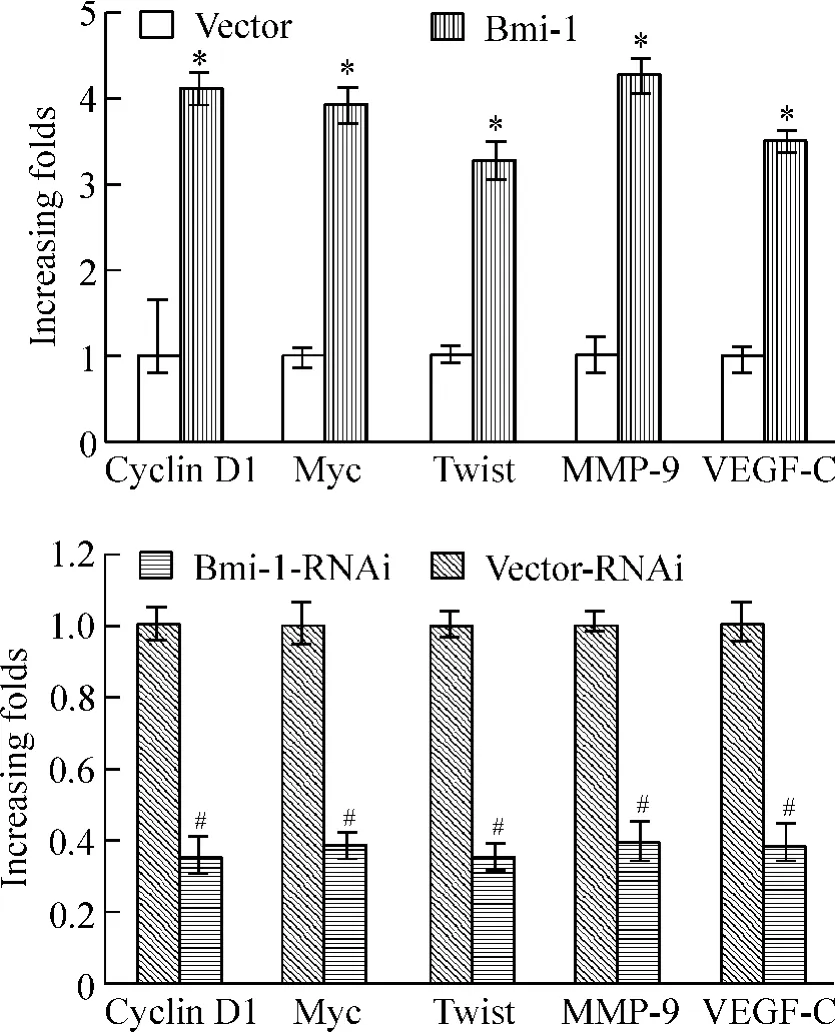
Figure 7. The mRNA expression of the downstream genes of NFκB detected by real-time fluorescence quantitative PCR. Mean ± SD. n = 3. * P <0. 05 vs vector;#P <0.05 vs vector-RNAi.图7 实时定量PCR 检测NF-κB 下游靶基因mRNA 表达水平
此外,Bmi-1 作为多梳家族蛋白的一员,已被证实在多种肿瘤中高表达,包括急性粒细胞性白血病、肺癌、卵巢癌、鼻咽癌、乳腺癌、胃癌和结肠癌。Bmi-1是一个癌蛋白,在这些肿瘤中起到重要的作用,促进肿瘤细胞的增殖、侵袭、抗凋亡和血管增生过程[5-6,8,12]。因此,鉴于Bmi-1 在肿瘤发生发展过程中所起到的促进作用,使得Bmi-1 在肿瘤的治疗上受到关注。Bmi-1 作为一个潜在抗肿瘤靶标,具有更高更有应用价值的研究意义。
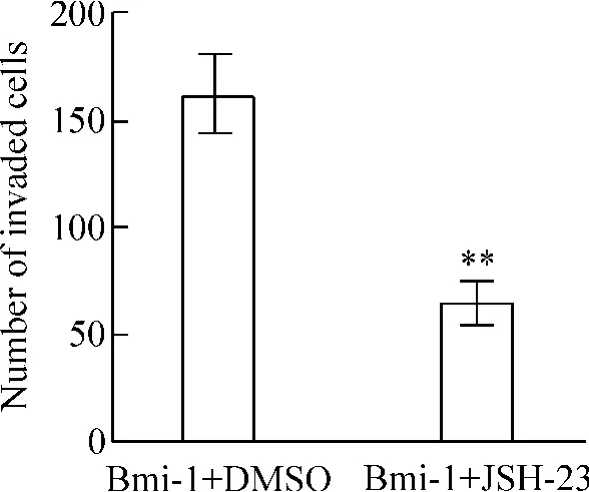
Figure 9. Invasion of Bmi-1-expressing cells treated with DMSO or JSH-23 measured by Transwell assay.Mean±SD. n=3. **P <0.01 vs Bmi-1 +DMSO.图9 抑制NF-κB 作用对高表达Bmi-1 的细胞侵袭能力的影响
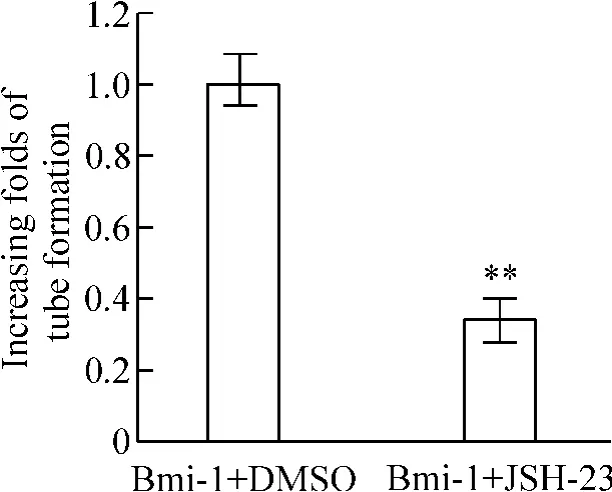
Figure 10. Quantification of tube formation of HUVECs cultured on Matrigel-coated plates with condition medium from Bmi-1-expressing cells treated with DMSO or JSH-23.Mean±SD. n =3. **P <0.01 vs Bmi-1 + DMSO.图10 抑制NF-κB 作用对高表达Bmi-1 的细胞血管增殖能力的影响
NF-κB 信号通路在机体免疫等生理过程,感染、炎症、肿瘤等病理过程中发挥重要作用,被广泛研究[9]。迄今已发现,NF-κB 信号通路的激活既是机体抵抗病原侵入基础,又是病原造成机体损害的机制;既支持细胞正常生存、增殖和分化过程,又在细胞恶性转化、肿瘤发生、发展中起着关键作用。研究表明,NF-κB 信号调控可能将感染、炎症与肿瘤发生相互联系。由此可见,NF-κB 作为信号转导通路调控枢纽发挥着重要作用,阐明其调控机制,对于深入了解感染、炎症和肿瘤发生的病理过程,以及这些重要病理事件之间的相互关系,并在此基础上发展更有效、更优化的抗感染、抗炎症,尤其是抗肿瘤新策略,具有重大意义。
研究已证实,NF-κB 可能在抑制肿瘤细胞凋亡的过程中具有重要作用,抑制NF-κB 的活化可以增强一系列凋亡诱导剂,如炎症因子、电离辐射和化疗药物等的致凋亡作用效应。NF-κB 的异常活化参与到肿瘤发生、侵袭和转移等不同生物学过程中,通过激活相关基因的转录,促进肿瘤恶性进展[13]。目前已证明在结肠癌、乳腺癌、非小细胞性肺癌、甲状腺癌、黑色素瘤、T 或B 淋巴细胞白血病、膀胱癌及几种病毒诱导的肿瘤中,均存在NF-κB 异常高表达和激活。肿瘤细胞NF-κB 信号转导通路的异常活化与多种作用机制有关。在细胞浆,Akt 通过调节IKK/IκB 使得NF-κB 发生核转位而被活化。在细胞核内,多种核蛋白诸如CDK5 激活物结合蛋白LZAP、p53 和ARF 能调节NF-κB 激活的特异性[14]。此外,NF-κB 的转录活性能够通过Akt 或肿瘤抑制基因ARF 的激活而发生改变,而Akt 和ARF 都是Bmi-1调控的下游基因[15]。以上发现提示我们Bmi-1 可能参与了调控NF-κB 信号转导通路从而增强了胶质瘤细胞生长增殖、侵袭运动及血管增生能力。
Cyclin D1、Myc、Twist、MMP-9 和VEGF-C 已被证实与肿瘤细胞的增殖、运动、血管增殖密切相关[3]。我们的研究证实Bmi-1 对NF-κB 信号通路的激活作用能增强cyclin D1、Myc、Twist、MMP-9 和VEGF-C 的表达,从而实现了其促胶质瘤细胞增殖、侵袭运动和血管增生的作用。综上所述,本文的研究不仅丰富了胶质瘤侵袭运动过程的理论机制研究,更为其治疗提供了新的方向和靶标,具有重要的生物学和医学研究意义。
通过本文的研究,我们认为Bmi-1 在胶质瘤的进展过程中,起着促癌作用,能够促进胶质瘤细胞的恶性进展,增强其细胞增殖、侵袭和血管增生能力。我们通过抑制Bmi-1 的表达在体外能够抑制胶质瘤细胞的各种恶性表型,证实Bmi-1 可能作为潜在的治疗靶标,在胶质瘤的诊断治疗过程中,具有重要的研究价值和前景。
[1] Taylor LP. Diagnosis,treatment,and prognosis of glioma:five new things[J]. Neurology,2010,75(18 Suppl 1):S28-S32.
[2] Reardon DA,Rich JN,Friedman HS,et al. Recent advances in the treatment of malignant astrocytoma [J]. J Clin Oncol,2006,24(8):1253-1265.
[3] Jiang L,Lin C,Song L,et al. MicroRNA-30e* promotes human glioma cell invasiveness in an orthotopic xenotransplantation model by disrupting the NF-κB/IκBα negative feedback loop[J]. J Clin Invest,2012,122(1):33-47.
[4] Meng S,Luo M,Sun H,et al. Identification and characterization of Bmi-1-responding element within the human p16 promoter[J]. J Biol Chem,2010,285(43):33219-33229.
[5] 练国达,邓 辉,陈茵婷,等. Bmi-1 基因过表达对人正常胃黏膜上皮细胞株GES-1 增殖的影响[J]. 中国病理生理杂志,2012,28(5):807-810.
[6] 崔学江,朱定军,韩金利,等. siRNA 干扰Bmi-1 基因对膀胱癌EJ 细胞增殖的调控作用及其机制[J]. 中国病理生理杂志,2011,27(8):1519-1524.
[7] Li J,Gong LY,Song LB,et al. Oncoprotein Bmi-1 renders apoptotic resistance to glioma cells through activation of the IKK-nuclear factor-κB pathway[J]. Am J Pathol,2011,176(2):699-709.
[8] Jiang L,Wu J,Yang Y,et al. Bmi-1 promotes the aggressiveness of glioma via activating the NF-kappaB/MMP-9 signaling pathway[J]. BMC Cancer,2012,12:406.
[9] 邢飞跃,赵克森,姜 勇. NF-κB 的信号通路与阻断策略[J]. 中国病理生理杂志,2003,19(6):849-855.
[10]Hayashi S,Yamamoto M,Ueno Y,et al. Expression of nuclear factor-κB,tumor necrosis factor receptor type 1,and c-Myc in human astrocytomas[J]. Neurol Med Chir(Tokyo),2001,41(4):187-195.
[11]Song LB,Zeng MS,Liao WT,et al. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells[J]. Cancer Res,2006,66(12):6225-6232.
[12]刘建化,黄开红,李学先,等.胃癌患者预后及病理因素与Bmi-1 表达的相关性研究[J]. 中国病理生理杂志,2007,23(10):2018-2022.
[13] Karin M,Cao Y. Greten FR,et al. NF-κB in cancer:from innocent bystander to major culprit [J]. Nat Rev Cancer,2002,2(4):301-310.
[14] Hayden MS,Ghosh S. Signaling to NF-κB [J]. Genes Dev,2004,18(18):2195-2224.
[15]Rocha S,Campbell KJ,Perkins ND. p53-and Mdm2-independent repression of NF-κB transactivation by the ARF tumor suppressor[J]. Mol Cell,2003,12(1):15-25.

