核桃壳对水中Pb2+和Ni2+吸附研究
鲁秀国,党晓芳,鄢培培
(华东交通大学土木建筑学院,江西南昌330013)
电镀车间排放的废水中含有大量的Pb2+,Ni2+,Zn2+,Cd2+等金属离子[1],未经处理的废水一旦排入水体,即便在较低浓度下也会对生物和环境造成严重影响。重金属离子由于其不可生物降解性以及可通过食物链进行富集这两个特点,已引起越来越多学者的关注[2-3]。处理重金属废水的方法主要有化学沉淀法、离子交换法、膜分离法、吸附法以及电渗析法等等,受成本、后续处理难度以及对重金属离子选择性等因素的影响,使得上述处理方法适用性受到极大限制[4-5]。近年来,学者主要研究采用水稻秸秆[6]、花生壳[7]、橘子皮[8]等农林废弃物作为吸附剂处理重金属废水,且已取得优良的处理效果。
大多情况下,污水中不只包含一种金属离子,往往是几种金属离子的混合。例如在电池生产车间排放的废水中常含有Pb2+和Cd2+[9],而电镀车间排放的废水中则常含Pb2+和Ni2+[1]。目前,关于单一组分重金属废水处理方法研究较多,但相对于单组份金属离子而言,实际废水中往往含有两种甚至更多的金属离子,故研究两种离子共存下吸附剂的吸附特征更接近于实际情况。本实验以天然农林废弃物核桃壳作为吸附剂,在不同的实验条件下,揭示Pb2+,Ni2+的吸附行为,并分析Ni2+存在的情况下对Pb2+吸附行为的影响。
1 实验部分
1.1 仪器与试剂
仪器:原子吸收分光光度计(AA280FS)、恒温振荡器(ZD-8808)、pH 计(PHS-3E)、电子分析天平(AB204-N)、恒温鼓风干燥机(DHG-9101-2S)等。
试剂:硝酸铅(AR)、硝酸镍(AR)、硝酸(AR)、氢氧化钠(AR)等
1.2 实验步骤
1.2.1 吸附剂的制备
将产自新疆的核桃壳碾碎并筛分,筛分后清洗其表面杂质,用蒸馏水浸泡并振荡,直至上清液清澈无浮色。后将洗净的核桃壳于60℃下置于恒温鼓风干燥机中干燥。吸附剂的粒径直接影响吸附效果,前期实验表明,1.6~2.5 mm的核桃壳对Pb2+和Ni2+的吸附效率最高,故选择1.6~2.5 mm的核桃壳作为实验所用吸附剂。
1.2.2 模拟水样的配制
使用分析纯的Ni(NO3)2·6H2O 和Pb(NO3)2分别配置浓度为1 000 mg·L-1储备水样,加入1 ∶1 硝酸10 mL低温保存。实验中所需其它浓度废水均由此溶液稀释。
1.2.3 单一组分吸附实验
称取一定量吸附剂置于100 ml 锥形瓶中,加入一定浓度的模拟废水,用1.0 mol·L-1的HCl 溶液或1.0 mol·L-1的NaOH溶液调节水样的pH值,25℃下在恒温振荡器(200 r·min-1)中振荡吸附6 h,过滤,利用火焰原子吸收分光光度计测定滤液中金属离子浓度,确定各影响因素对金属离子去除率的影响。
1.2.4 竞争吸附实验
取100 ml 模拟废水,加入吸附剂1.2 g,25 ℃下调节溶液pH 值为5.5,Pb2+浓度取0,10,20,30,50,100 mg·L-1,配置同浓度系列含Ni2+模拟废水进行吸附实验。吸附后过滤水样,利用火焰原子吸收分光光度计测定滤液中金属离子浓度。
1.2.5 偏好吸附实验
为确定吸附剂对哪种金属离子具有较高亲和力,进行偏好实验。取Pb2+浓度为100 mg·L-1的模拟废水100 mL,加入吸附剂1.2 g,调节水样pH值为5.5,恒温振荡3 h,取上清液50 mL过滤测定Pb2+浓度。然后补充Ni2+浓度为150 mg·L-1的模拟废水50 mL,恒温振荡6 h,取上清液测定Pb2+、Ni2+浓度。
1.2.6 吸附实验效果表征
本实验采用火焰原子吸收分光光度法测定金属离子浓度。实验效果采用去除率D和吸附容量qe来表征。
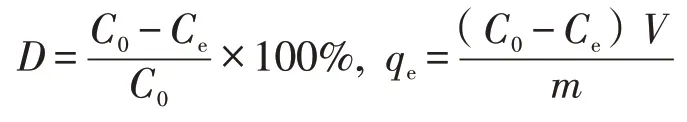
式中:C0为模拟废水吸附前离子浓度,mg·L-1;Ce为吸附平衡时金属离子浓度,mg·L-1;V为待处理水样体积,L;m为废水中加入的吸附剂的质量,g。
2 实验结果与讨论
2.1 Pb2+,Ni2+单组分吸附
2.1.1 吸附剂用量对吸附效果的影响
为确定吸附剂用量对金属离子去除率的影响,在水样初始pH值及金属离子浓度确定的情况下,向模拟废水中投加不同质量的吸附剂,金属离子去除率随吸附剂用量的变化如图1所示。随着吸附剂用量增大,金属离子去除率随之增大。含Pb2+废水中,吸附剂用量超过1.2 g、含Ni2+废水中用量超过2.0 g时,随着吸附剂用量增大,金属离子去除率基本恒定,主要是因为吸附剂投加量越大,吸附剂比表面积越大,随之提供的吸附点位也越多,当吸附剂提供的活性点位多于金属离子所需时,随着吸附剂用量增大,去除率不会增大[10]。单组份实验中Pb2+和Ni2+吸附剂最佳用量分别为1.2 g和2.0 g,为获得较高的吸附率并同时考虑节约吸附剂,在双组份竞争实验中吸附剂的最佳用量取1.2 g。
2.1.2 水样初始pH值对吸附效果的影响
水样初始pH值是影响吸附效率的最主要因素。pH值对Pb2+,Ni2+单组份模拟废水中金属离子去除效果的影响如图2 所示。从图中可知,当水样pH 值较低时,金属离子去除率普遍较低,当pH 值增大至4~5时,Pb2+,Ni2+单组份系统中金属离子的去除率均达到最高。主要原因有两方面:第一、pH值较小时H+和金属离子存在竞争吸附[11],由于水样中H+活性较高,占据了吸附剂表面部分活性点位,致使金属离子去除率下降;第二、pH值变化导致吸附剂Zeta电位变化[8]。研究表明,Pb2+,Ni2+两种金属离子在pH值为5左右时,吸附剂Zeta电位值为负的最低,Zeta电位越负,说明吸附剂表面所带负电荷越多,越有利于带正电金属离子的吸附。故单组份实验中吸附Pb2+和Ni2+最佳pH值分别为5.5和6.0,在双组份竞争实验中为了不影响吸附效果且方便操作,调整水样初始pH值为5.5。
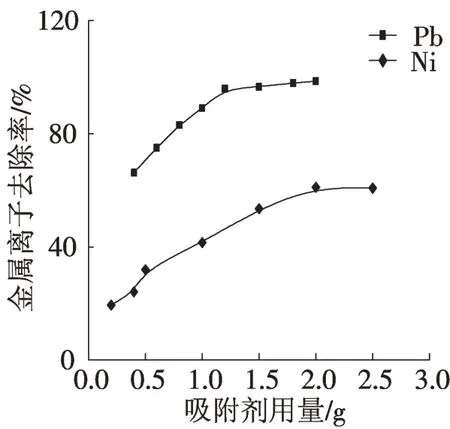
图1 吸附剂用量对吸附的影响Fig.1 Effect of biomass weight on absorption
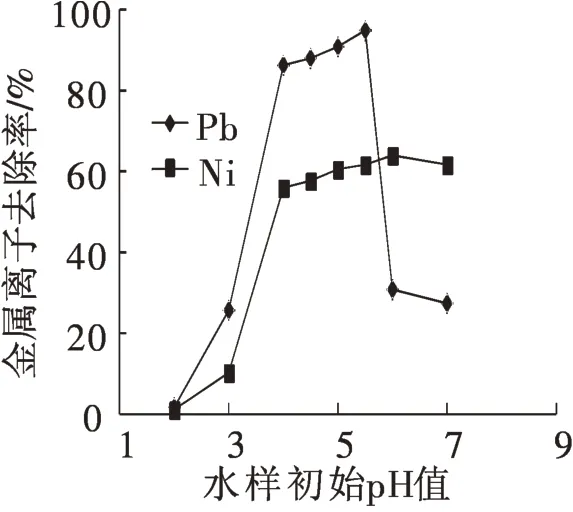
图2 水样初始pH值对吸附的影响Fig.2 Effect of initial pH values on absorption
2.1.3 吸附时间对吸附效果的影响
吸附剂对Pb2+,Ni2+的吸附量随时间的变化关系如图3 所示。由图可见,在其他实验条件相同的情况下,吸附剂对Pb2+的吸附容量明显高于Ni2+,主要是因为两种金属离子吸附过程中机理不同所致[12]。Pb2+在起初的90 min内去除率增长很快,达到总吸附量的91.7%,在180 min之后去除率基本不变。而Ni2+的吸附量则在360 min之后基本不变,吸附量增长趋势与Pb2+相似,都是先快后慢。研究表明[13],生物质材料的吸附一般分为两个阶段,快速吸附阶段和慢速吸附阶段。吸附剂刚刚加入时为快速吸附阶段,在此阶段内,70%~90%的金属离子被吸附,而整个反应时间却只需几十分钟。随后进入慢速反应阶段,这一阶段通常需要几个小时才能达到吸附平衡,此后吸附容量基本不变。
2.1.4 初始离子浓度对吸附效果的影响
金属离子初始浓度与吸附量之间的关系如图4所示。当金属离子浓度从10 mg·L-1增大至100 mg·L-1时,Pb2+和Ni2+吸附量随之增大。主要原因是溶液所提供的金属离子还未达到吸附剂的饱和吸附量,故随着金属离子浓度增大,金属离子的吸附量会持续增大,直至吸附剂吸附饱和。总体看来,Pb2+和Ni2+吸附量随浓度递增而增大,但是在相同的浓度梯度下,吸附剂对Pb2+的吸附量的增值远大于Ni2+,由此可说明吸附剂与Pb2+的亲和力要大于Ni2+。
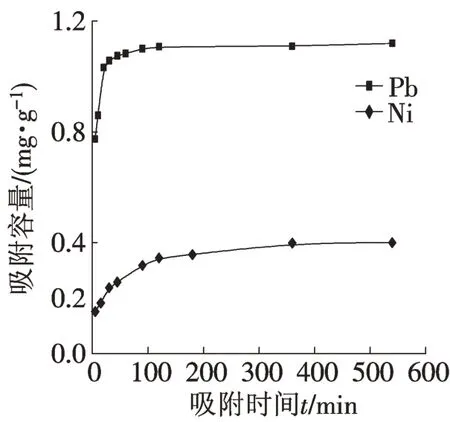
图3 吸附时间对吸附的影响Fig.3 Effect of time on absorption
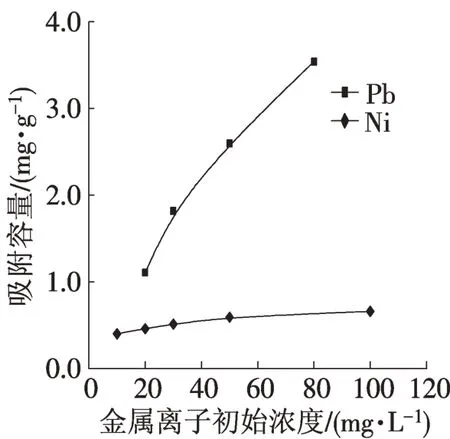
图4 金属离子初始浓度对吸附的影响Fig.4 Effect of initial concentration of metal ions on absorption
2.2 Pb2+,Ni2+双组分吸附
在溶液中仅存在Pb2+的情况下向其中投加Ni2+,两种离子共存时,对整个吸附过程可能相互促进,也可能相互抑制,Pb2+存在时加入Ni2+对吸附过程的影响如图5 所示,Ni2+浓度从0 增大至50 mg·L-1时,对应的Pb2+最大吸附容量从3.542 mg·g-1降至3.016 mg·g-1,减少值占最大吸附量的14.8%。可见,由于Ni2+的加入对Pb2+的吸附产生了影响,致使其吸附容量下降,但是下降的比重较小。当溶液中仅有Ni2+时Pb2+的加入同样会对吸附过程产生影响。如图6所示,Pb2+浓度为0时,Ni2+的吸附容量最高,Pb2+浓度逐渐增大至50 mg·L-1,Ni2+吸附量逐渐在减少,吸附量减少0.884 mg·g-1,占到初始吸附量的66.5%,可见Pb2+的加入对Ni2+的吸附行为产生极大影响。此外,Ni2+平衡浓度较小(<40 mg·L-1)时,随着平衡浓度的增大,Ni2+的吸附容量出现波动,主要因为平衡浓度较小时,吸附剂未达到饱和吸附容量,且由于Pb2+的竞争吸附作用,导致的吸附容量波动。
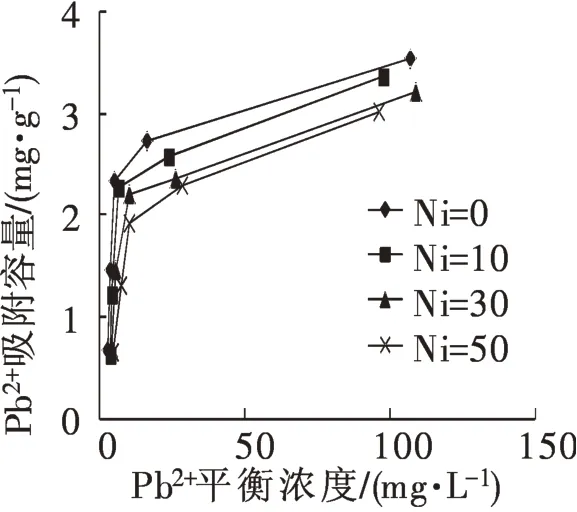
图5 不同浓度Ni2+存在时Pb2+的吸附量Fig.5 Absorption of Pb2+with different concentration of Ni2+
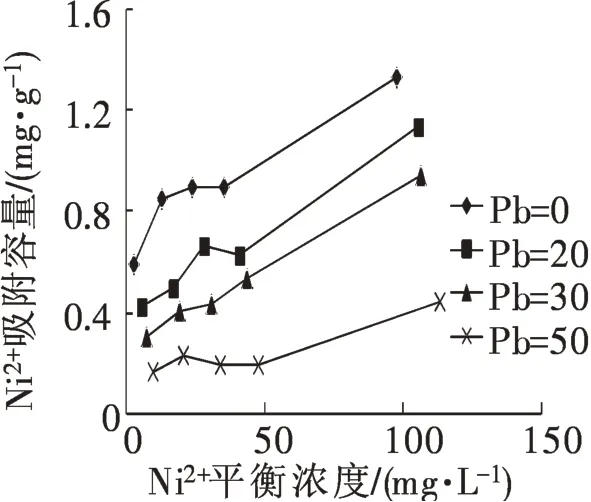
图6 不同浓度Pb2+存在时Ni2+的吸附量Fig.6 Absorption of Ni2+with different concentration of Pb2+
从图5,图6可以看出,Pb2+,Ni2+两种离子共存时存在竞争吸附现象,且Pb2+的存在对Ni2+吸附容量的影响更明显些。学者研究表明,吸附剂对金属离子吸附具有选择性,离子半径,离子所带电荷等等均会对其吸附产生影响[14]。除此之外,由于两种金属离在吸附剂上的吸附机理不同,也导致共存时影响程度有较大差异[12]。吸附剂对Pb2+的吸附主要是配位吸附,因此离子浓度变化时对吸附剂吸附点位的影响并不是很大;Ni2+的吸附可能是离子交换,当有其他金属离子存在时对其吸附会产生较大影响。
2.3 Pb2+,Ni2+偏好吸附
进行偏好吸附实验主要是为了确定在双组份系统中吸附剂对哪种金属离子具有较强的吸附能力。在水样中先添加第1种金属离子,在最优吸附条件下吸附一段时间使其达到平衡,然后在水样中加入第2种金属离子,由于第2种金属离子的加入,已经被吸附剂吸附的第1种金属离子可能会产生解吸,根据第1种金属离子的解吸量和第2种金属离子的吸附量可判断吸附剂对两种离子吸附的亲和程度[15]。由表1可知,在初始离子浓度相同(100 mg·L-1)的情况下,吸附剂对Pb2+的吸附量为4.875 mg·g-1,而Ni2+的吸附量为1.875 mg·g-1,吸附量差值达3 mg·g-1,吸附剂对Pb2+表现出较强的吸附能力。加入第2种金属离子后,Pb2+的解吸量为0.083 mg·g-1,Ni2+的解吸量为0.625 mg·g-1,为Pb2+解吸量的8倍。吸附剂对第2中金属离子的吸附量也存在较大差异,对Pb2+的吸附量为3.625 mg·g-1,对Ni2+的吸附量则仅为0.675 mg·g-1。由此可知,吸附剂对Pb2+的吸附量较大,性能稳定吸附后不易被解吸,而当水样中存在Ni2+时,吸附剂对Ni2+的吸附量相对则较小,当存在Pb2+干扰时,吸附剂上的Ni2+不稳定,易被解吸而重新进入水样中。

表1 双组份系统中离子吸附与解吸情况Tab.1 Parameters of absorption and desorption in two-component system
3 结论
1)核桃壳吸附Pb2+的最佳初始pH值为5.5,吸附剂用量为1.2 g,吸附时间为3 h;核桃壳吸附Ni2+的最佳初始pH值为6.0,吸附剂用量为2.0 g,吸附时间为6 h,核桃壳对Pb2+的吸附容量为Ni2+的3倍。
2)Pb2+,Ni2+在核桃壳上的吸附行为存在竞争关系,Ni2+的干扰使Pb2+的吸附容量下降24.3%,Pb2+的干扰使Ni2+的吸附容量下降66.5%,吸附剂对Pb2+的选择性更高。
[1]罗道成,易平贵,陈安国.改性沸石对电镀废水中Pb2+、Zn2+、Ni2+的吸附[J].材料保护,2002,35(7):41-43.
[2]CELIK A,DEMIRBAS A. Removal of heavy metal ions from aqueous solu-tions via adsorption onto modied lignin from pulping wastes[J].Energy Sources,2005,27(12):1167-1177.
[3] DEMIRBAS A.Heavy metal adsorption onto agro-based waste materials:areview[J]. Journal of Hazardous Materials,2008,157(2/3):220-229.
[4]焦芳,李明利,梁磊.典型天然吸附剂对重金属的吸附性能研究[J].四川环境,2011,30(2):88-92.
[5]薛红琴,荆肇乾.低成本生物材料去除废水中铅的研究探讨[J].工业水处理,2011,31(10):6-9.
[6]陈再明,方远,徐义亮,等.水稻秸秆生物碳对重金属Pb2+的吸附作用及影响因素[J].环境科学学报,2012,32(4):769-776.
[7]钟璐.核桃壳与花生壳对模拟废水中Cr(Ⅵ)的吸附特性研究[D].南昌:华东交通大学,2012.
[8]冯宁川.橘子皮化学改性及其对重金属离子吸附行为的研究[D].长沙:中南大学,2009.
[9]蒋克彬,彭松,张小海.铅酸蓄电池厂含铅废水处理工程实例[J].蓄电池,2008(2):84-86.
[10]陈尔余,林峰.改性沸石(Na-Y型)对Ni2+的吸附行为[J].环境化学,2006,25(4):420-424.
[11]杨凤,吴云海.重金属废水的生物吸附研究进展[J].环境科学与管理,2006,31(4):81-83.
[12]林芳芳,易筱筠,党志,等.改性花生壳对水中Cd2+和Pb2+的吸附研究[J].农业环境科学学报,2011,30(7):1404-1408.
[13]马静.天然植物材料作为吸附剂处理低浓度重金属废水的研究[D].长沙:湖南大学,2007.
[14]许秀云,蔡玉曼.改性沸石对重金属离子竞争吸附特性研究[J].地质学刊,2010,34(1):92-97.
[15]张启亮,张咏晶,徐艳,等.Cu2+和Cd2+对活性污泥吸附Pb2+的竞争吸附影响效果研究[J].安徽农业科学,2012,40(14):8258-8262.
