牛黄清感胶囊对甲型H3N2流感病毒抑制和预防作用的实验研究
常 洋 周有财 段书敏 宫君相
1.黑龙江澳利达奈德制药有限公司,黑龙江哈尔滨 150001;2.黑龙江澳利达医药集团,黑龙江哈尔滨 150001;3.中国疾病预防与控制中心病毒病预防控制所,北京 100052;4.黑龙江省澳利达药业股份有限公司,黑龙江哈尔滨 150001
甲流病毒是A型流感病毒,防治措施主要针对传播途径采取物理、行为预防及发病后对症治疗[1]。目前,抗病毒西药的种类较多,但对甲流病毒尚缺乏特效药物,在我国中医药已被纳入甲流的防治体系。该研究主要是检测牛黄清感胶囊对甲型H3N2流感病毒的预防作用。
1 实验材料
1.1 药物
1.1.1 验证药物 牛黄清感胶囊:国药准字Z20026054,每粒含0.3g生药,批号090962,生产日期:2009年12月2日,由黑龙江澳利达奈德制药有限公司提供。
1.1.2 阳性药物对照 利巴韦林注射液(病毒唑),0.1g/支,苏卫药准字(1988)第347003号:批号000223,苏州第六制药厂生产。
1.1.3 细胞 狗肾传代细胞(MDCK-P13),由全国流感中心提供。
1.1.4 病毒 甲型A/Brisban/10/2008(H3N2)流感病毒,批号:09712,由全国流感中心提供。
1.1.5 实验室及其他实验材料 生物安全三级实验室BSL-3:编号:CNAS/BLA/T003,由中国疾病预防控制中心病毒病预防控制所提供。其他实验材料还有来源华美公司的四甲基噻唑蓝(MTT)、D-MEM培养基(高糖含-谷氨酰胺,进口GIBCO)、胎牛血清(进口GIBCO)、牛血清白蛋白组分(进口GIBCO)、青酶素、链酶素、HEPES缓冲液(进口GIBCO)、TPCK-胰酶(牛胰腺来源VⅢ型,进口GIBCO)、Hank's溶液、二甲基亚枫(进口GIBCO)、倒置可视显微镜(OLYMPUS)、一次性实验耗材及试剂等(进口GIBCO公司);3M公司的个人防护装备;本室的CO2培养箱NUAIR USAUTOFLOW。
2 实验方法
2.1 牛黄清感胶囊对甲型A/Brisban/10/2008(H3N2)流感病毒抑制作用
2.1.1 病毒CPE法
2.1.1.1 细胞培养 MDCK细胞以40万/mL的浓度接种96孔培养板,培养基为L-谷氨酸完全型D-MEM、10%的进口特级胎牛血清。37℃ 5% CO2孵箱培养至细胞对数生长期最旺盛75%~90%成片细胞,弃掉细胞培养液,采用Hank’s溶液洗细胞2次。
2.1.1.2 病毒吸附 将100TCID50甲型A/Brisban/10/2008(H3N2)流感病毒(采用病毒生长液(D-MEM培养基中含牛血清白蛋白组分12.5mL、青酶素100U/mL、链酶素100μg/mL,HEPES 12.5mL,TPCK-胰酶0.5mL)稀释后,接种经处理的MDCK细胞96孔培养板,每孔100μL,同时设病毒对照(100TCID50病毒液)。36℃、5% CO2孵箱中吸附2h,弃掉病毒稀释液,采用Hank's溶液洗2次。
2.1.1.3 药物稀释 牛黄清感胶囊,选用对细胞的最大无毒浓度(TD0)2倍稀释8个浓度即750~5.9μg/mL。同时设利巴韦林注射液阳性药物对照,选用对细胞的最大无毒浓度(TD0)2倍稀释 9个浓度,即 1000~ 3.9μg/mL,每浓度接种感染细胞3孔,每孔100μL。实验分1次用药组(不同浓度的药液作用被病毒感染的MDCK细胞1次),3次用药组(不同浓度的药液作用被病毒感染的MDCK细胞,每24小时弃掉旧药液,换同浓度的药液,连续3次)。36℃、5% CO2孵箱培养,每24小时在倒置显微镜下观察细胞形态CPE变化,以25%以下细胞形态CPE变化为“+”,26%~50%细胞形态CPE变化为“++”,51%~75%细胞形态CPE变化为“+++”,76%~100%细胞形态CPE变化为“++++”,至病毒对照出现“++++”时结束实验,用Reed-Muench法,计算药物半数有效浓度(IC50)和最小有效浓度(MIC)及治疗指数(TI)判断药效。实验重复3次。
2.1.2 病毒MTT染色法
观察细胞病变CPE结果后,加入MTT 5mg/mL,每孔10μL,置37℃培养4h,然后加入100μL DMSO有机溶剂,室温20min,充分溶解细胞(过程中稍加震荡)。然后,采用酶标仪波长570nm测定,记录OD值,计算药物半数有效浓度IC50和最小有效浓度MIC及治疗指数TI,判断药效。实验重复3次。
2.2 牛黄清感胶囊对甲型A/Brisban/10/2008(H3N2)流感病毒的预防作用
2.2.1 病毒CPE法
2.2.1.1 细胞培养 按2.1.1.1的方法。
2.2.1.2 药物作用细胞 牛黄清感胶囊,选用对细胞的最大无毒浓度(TD0)2倍稀释8个浓度,即750~5.9μg/mL,同时设利巴韦林注射液阳性药物对照,2倍稀释9个浓度1000~3.9μg/mL,每浓度接种感染细胞3孔,每孔100μL。实验分1次用药组(不同浓度的药液作用被病毒感染的MDCK细胞1次),3次用药组(不同浓度的药液作用被病毒感染的MDCK细胞,每24小时弃掉旧药液,换同浓度的药液,连续3次)。
2.2.1.3 病毒攻击 将100TCID50甲型A/Brisban/10/2008(H3N2)流感病毒(采用病毒生长液(D-MEM培养基中含牛血清白蛋白组分12.5mL、青酶素100U/mL、链酶素100μg/mL,HEPES 12.5mL,TPCK-胰酶0.5mL)稀释后,接种经药物作用的MDCK细胞96孔培养板,每孔100μL,同时设病毒对照(100TCID50病毒液),设正常细胞对照。36℃、5% CO2孵箱中吸附2h,弃掉病毒稀释液,采用Hank's溶液洗2次。
2.2.1.4 细胞培养及观察 每孔加入100μL病毒生长液,36℃、5% CO2孵箱培养,每24小时在倒置显微镜下观察细胞形态CPE变化,按2.1.1.3的指标判断药效。实验重复3次。
2.2.2 病毒MTT染色法
按2.1.2的方法。
3 实验结果
3.1 牛黄清感胶囊体外抑制甲型A/Brisban/10/2008(H3N2)流感病毒药效实验结果
在MDCK细胞培养内,采用病毒CPE法和MTT染色法,检测牛黄清感胶囊对甲型A/Brisban/10/2008(H3N2)流感病毒的抑制作用,实验分不同浓度的受试药液作用被病毒感染的MDCK细胞1次组和3次组。用Probit回归法计算药物的半数有效浓度IC50,最小有效浓度MIC及治疗指数TI,3次实验结果见表1。

表1 不同浓度“牛黄清感胶囊”体外抑制甲型A/Brisban/10/2008(H3N2)流感病毒药效
3.2 牛黄清感胶囊体外预防甲型A/Brisban/10/2008(H3N2)流感病毒药效实验结果
在MDCK细胞培养内,采用病毒细胞形态变化CPE法、MTT染色法,检测不同浓度的牛黄清感胶囊对甲型A/Brisban/10/2008(H3N2)流感病毒的预防作用。实验分1次用药组和3次用药组,用Probit回归法计算计算药物的半数有效浓度IC50,最小有效浓度MIC及治疗指数TI。3次实验结果见表2。
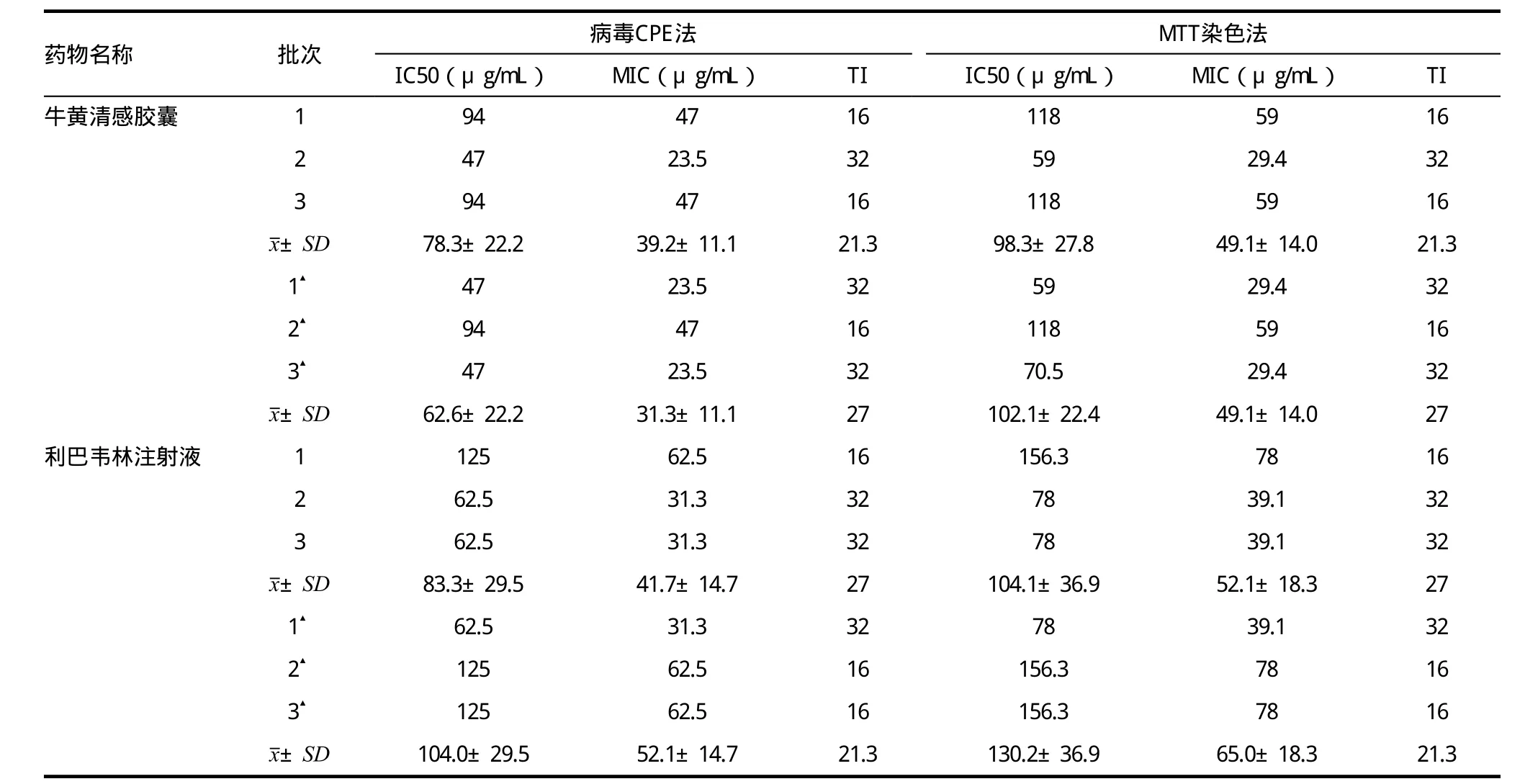
表2 不同浓度“牛黄清感胶囊”体外预防甲型A/Brisban/10/2008(H3N2)流感病毒药效
4 讨论
流行性感冒一直是世界高发的传染病之一,每年全球约有6亿人患流感,占总人口的10%。我国是世界上公认的流感多发地甚至是发源地,其机制尚不清楚。其中曾经引起世界性大流行的A(H3N2)亚型流感病毒自1968年以来一直在人群中存在[2]。流感病毒的抗原变异与流感的发生和流行密切相关,流感病毒正是通过不断改变其抗原性来逃避宿主特异性免疫的识别和清除,从而不断引起流行[3-4]。
国内外有关抗病毒中药的研究日益增多,从中筛选其有效成分已成为当前抗病毒新药研发的一个热点[5]。牛黄是一种常用的名贵中药,味苦、甘,性凉。归心、肝经。具有清心解毒、凉肝息风、豁痰开窍等功效。现代药理学方法研究结果显示,生物牛黄中间体在鸡胚成纤维细胞上使新城疫系疫苗毒的TCID50升高1个滴度[6]。金银花具有清热解毒,凉散风热之功效,有研究[7]发现金银花具有明显的抗病毒作用,其有效活性成分为绿原酸类化合物,金银花的抗病毒作用多是由其有效活性成分直接作用于病毒,对DNA和RNA病毒均有一定的抑制作用。金银花提取物20g/kg和40g/kg剂量组可明显延长甲型流感病毒感染小鼠的存活天数,显著降低甲型流感病毒感染小鼠死亡数,对甲型流感病毒(A/PR/8/34)感染小鼠具有明显的保护作用,同时可明显降低甲型流感病毒感染小鼠的肺指数值,具有减轻甲型流感病毒小鼠肺部病变的作用[8]。黄芩始载于《神农本草经》,为唇形科植物黄芩的干燥根,有清热燥湿、泻火解毒之效。黄芩具有多种药理作用,除抗氧化、清除自由基、抗炎、抗肿瘤作用外,对多种病毒,如乙肝病毒、HIV等均具有抑制作用[9]。目前研究认为,黄芩的有效成分是黄酮类化合物,研究表明黄芩苷对流感病毒所致的细胞病变作用有明显的抑制作用,可较强地抑制小鼠感染流感病毒及明显阻碍流感病毒对小鼠的致死活性,对流感病毒的唾液酸酶有特异的抑制活性,并抑制流感病毒的膜融合及脱壳[10]。连翘对多种病毒具有抑制作用,连翘抗病毒有效部位(LC-4)在体外对呼吸道合胞病毒(RSV)有明显的预防作用及治疗作用[11]。
牛黄清感胶囊是由牛黄、金银花、黄芩、连翘等组成的复方制剂[12],我们对甲型H3N2流感病毒的实验结果表明牛黄清感胶囊具有体外抑制和预防高致病甲型H3N2流感病毒的作用,同浓度的稀释药液连续3次作用正常的MDCK细胞和被病毒感染的细胞,能够有效的抑制和预防高致病甲型H1N1流感病毒的繁殖。
[1] 刘钊,杨占秋,肖红,等.MTT法在抗病毒药物筛选中的应用[J].武汉大学学报(医学版),2004,25(3):332-334.
[2] 杜宁,杨霄星,蓝雨,等.1968年香港流感(H3N2)病原学概述[J].病毒学报,2009,25(增刊):17-20.
[3] Nobusawa E,Nakajim K.Amino acid substitution of position 226 of the hemaglutinin molecule of influenza (H1N1) virus affects receptobinding activity but not fusion activity[J].Virology,1988,167(23):8-14.
[4] Isabelle H,Yan L,Michael B,et a1.Molecular evolution of influenza AH3N2 viruses in the provinces of Quebec(Canada) during the 1997-2000 period[J].Virus Res,2001,77(9):89-96.
[5] 廖玲,王红.中药治疗巨细胞病毒感染研究进展[J].北京中医药,2011,30(1):64-67.
[6] 付本懂,张继东,钟秀会,等.生物牛黄中间体的抗病毒作用及对家兔血液流变学指标的影响[J].中国兽医学报,2005,25(3):278-280.
[7] 季志平,朱萱萱,倪文澎,等.金银花提取物抗病毒的作用研究[J].中国医药导刊,2009,11(1):118.
[8] 管仲莹,赵金明,林巧智.金银花提取物抑菌作用的实验研究[J].中国现代医生,2009,47(15):150-151.
[9] 吴莹,金叶智,吴珺,等.黄芩主要成分体外抗甲型流感病毒作用的研究 [J].北京中医药大学学报,2010,33(8):541-545.
[10] 袁国秀.牛黄解毒片中黄芩苷的含量测定[J].中国社区医师(医学专业),2011,23(1):3.
[11] 陈杨,李鑫,周婧瑜,等.连翘抗病毒有效部位(LC-4)体外抗呼吸道合胞病毒作用的研究[J].卫生研究,2009,21(6):79-81.
[12] 常洋.牛黄清感胶囊毒理研究[J].黑龙江科技信息,2011,5(16):72.

