凉血通瘀方对出血性中风患者外周血TNF-α、HSP70、NO及NOS的影响
黄艳,周肸,赵凤鸣,吴勉华,周学平,王明艳
(南京中医药大学,江苏 南京 210029)
出血性中风是临床常见的急危重症,急性期若有效治疗能很好的控制病情,降低病死率和致残率。国医大师周仲瑛教授创制的凉血通瘀法临床治疗出血性中风急性期瘀热阻窍证患者,疗效明显[1]。凉血通瘀方主要由熟大黄、水牛角、赤芍、丹皮等中药组成。前期研究结果表明,凉血通瘀方能改善急性出血性中风患者凝血和炎症相关指标。为了探究凉血通瘀方治疗急性出血性中风的分子机制,本文在前期临床研究的基础上,进一步通过体外实验,观察了凉血通瘀方对TNF-α、HSP70、NO 及 NOS的影响。
1 实验材料及仪器
1.1 实验用药
凉血通瘀方:熟大黄,水牛角、赤芍、丹皮等药材均购自南京中医药大学门诊部,由南京中医药大学陈建伟教授鉴定,符合《中国药典》2005年版标准。
含药血清的制备:药液浸泡1h,水牛角先煎,所有药材煎煮30min后过滤1次,剩余药液加水煎煮30min,取滤液,合并2次滤液浓缩至55ml(浓度为2g/ml)。20只清洁级大鼠(体质量250g左右,雌雄各半),随机分成正常空白对照组,高、中、低剂量组,连续灌胃3天,最后1次灌胃后1h取血,分离血清,灭活,过滤,分装,-20℃保存备用。
药液制备:取水牛角泡30min,加10倍量蒸馏水煎煮沸腾后20min,加入熟大黄,赤芍,丹皮,生地黄,广地龙,三七等,加10倍量蒸馏水煎煮沸腾后20min,过滤,倒出药液,药渣加入10倍量蒸馏水煎煮沸腾后20min,过滤,合并2次滤液,浓缩至220ml作为原液,置4℃冰箱保存[2]。原液用单倍稀释,分为两个用药组,其浓度分别为3000ug/ml(临床等效量)、300ug/ml,空白对照组用生理盐水。
1.2 试剂
TNF-α ELISA试剂盒(美国RND公司);HSP-70 ELISA试剂盒(USCNLIFE);NO、NOS试剂盒(南京建成生物工程研究所,批号20120328),RPMI 1640 培养基(Gibco公司);小牛血清(杭州四季青生物工程材料有限公司产品);PHA(上海泽龙生物工程有限公司,批号20115102)。
1.3 仪器
3111 型CO2 培养箱(FORMA SCIENTIFIC公司);IX50 倒置显微镜(Olympus公司);Micropat Reader550型酶联免疫检测仪(日本,Bio-Rad公司);LD4-2A离心机(北京医用离心机厂);HHW21.CU 600 电热恒温水温箱(上海医用恒温设备厂);超净工作台(苏州净化设备厂)。
2 实验方法
2.1 临床病例选择
临床病例遵循知情同意原则纳入,诊断标准符合《中风病诊断疗效评定标准》[3]及《各类脑血管疾病的诊断要点》[4]。
2.2 样本采集
取患者全血置含有肝素的离心管。
2.3 全血培养
取新鲜抗凝血接种到6 孔板,每孔0.4ml,4ml 1640 全培,PHA 0.2 ml,5%CO237℃培养箱培养 48h,加药0.51ml,5%CO2,37℃培养箱培养24h,收集上清。
2.4 ELISA法检测相关细胞因子TNF-α、HSP70
准备试剂、样品盒标准品,加入准备好的样品、标准品以及酶联亲和物,37℃反应60min,洗板5次,加入显色液 A/B室温避光反应15min,加入终止液,30min内用酶联仪在450nm波长依序测量各孔的光密度(OD值),作标准曲线换算所测细胞因子含量。
2.5 试剂盒测NO及NOS
依照试剂盒说明书上要求分别配制各检测试剂,按操作表顺序分别加样。上清加样量100μL。完成程序后,用分光光度计进行比色,NO检测波长550nm,NOS检测波长530nm,将所得数据按说明书上所提供的公式分别计算上清中NO、NOS水平。
NO(umol/l)=(测定管吸光度-空白管吸光度)/(标准管吸光度-空白管吸光度)×标准品浓度(100umol/l)×样品测试前稀释倍数
总NOS(u/ml)=(总测定管OD值-空白管OD值)/呈色物纳摩尔消光系数×(反应液总体积/取样量)×1/(比色光径×反应时间)/1000
2.6 统计学处理 实验所得数据采用SPSS 11.5 软件进行组间t检验,统计处理后结果见表1、2。
3 结果
3.1 凉血通瘀方对外周血中 TNF-α、HSP-70的影响
凉血通瘀方药液组和空白对照组相比,TNF-α的含量下降,其中药液3000组(终浓度为300ug/ml)的TNF-α含量明显下降(P<0.05);含药血清高、中、低三个剂量组和空白血清对照组相比,TNF-α的含量皆下降,而HSP-70的含量升高,其中三个剂量组TNF-α的含量都明显下降(P<0.05),中剂量组和低剂量组HSP-70的含量明显升高(P<0.05)。见表1。
3.2 凉血通瘀方对外周血中NO及NOS的影响
凉血通瘀方药液3000组(终浓度为300ug/ml)和空白对照组相比,NOS活性和NO含量均明显升高(P<0.05);含药血清高、中、低三个剂量组和空白血清对照组相比,NOS活性和NO含量均明显升高(P<0.05)。见表2。
表1 凉血通瘀方作用后外周血中TNF-α、HSP70的含量(±s,n=4)
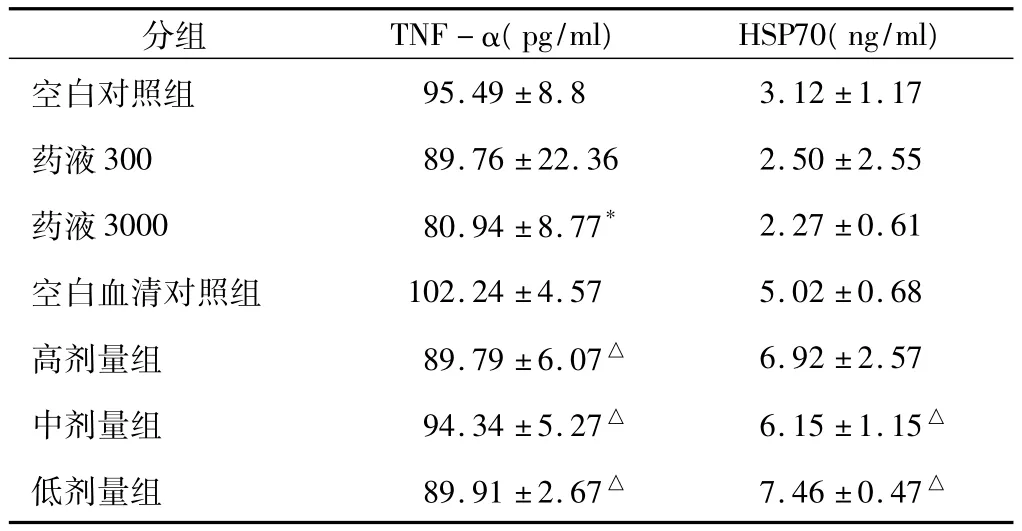
表1 凉血通瘀方作用后外周血中TNF-α、HSP70的含量(±s,n=4)
注:与空白对照组比较,*P<0.05;与空白血清对照组比较,△P<0.05。
95.49 ±8.8 3.12 ±1.17药液300 89.76 ±22.36 2.50 ±2.55药液3000 80.94 ±8.77* 2.27 ±0.61空白血清对照组 102.24 ±4.57 5.02 ±0.68高剂量组 89.79±6.07△ 6.92±2.57中剂量组 94.34±5.27△ 6.15±1.15△低剂量组 89.91±2.67△ 7.46±0.47空白对照组△
表2 凉血通瘀方作用后外周血中NO、NOS的含量(±s)

表2 凉血通瘀方作用后外周血中NO、NOS的含量(±s)
注:与空白对照组比较,*P<0.05;与空白血清对照组比较,△P<0.05。
93.55 ±8.11 0.31 ±0.11药液300 107.18 ±11.37药液3000 124.47 ±12.72* 1.46 ±0.83*空白血清对照组 105.6 ±16.29 0.49 ±0.17高剂量组 157.0 ±9.41△中剂量组 142.05±17.36△ 0.94±0.37△低剂量组 132.96 ±11.52空白对照组△
4 讨论
本实验结果显示,凉血通瘀方的药液和含药血清都可一定程度的降低出血性中风患者外周血中TNF-α的表达。TNF是一种重要的免疫调节和促炎症细胞因子,TNF-α为其主要亚型,主要由单核巨噬细胞产生[5]。很多研究显示,脑出血后TNF-α会升高。史福平[6]等研究结果显示,脑出血患者血浆TNF-α水平明显高于正常对照组。杨清[7]等研究结果显示,急性脑血管病患者血清TNF-α含量明显高于正常对照组。廖鑫[8]等研究结果表明,高血压性脑出血患者血清炎症因子TNF-α的水平显著升高。还有研究显示,机体内高水平的TNF-α可直接损伤血管的内皮细胞,造成血管内皮功能失调[9]。前期有临床实验提示,凉血通瘀方对出血性中风患者TNF-α的表达有影响,通过本实验的结果,进一步推测,凉血通瘀方可能通过作用于外周血中的单核细胞,降低了TNF-α的表达,减轻了机体炎性反应导致的“热”。
凉血通瘀方含药血清低剂量组和中剂量组都能使HSP70 表达显著增加。HSP70 是一种进化上高度保守的细胞应激蛋白,存在于细菌到人类的各种生物中。在脑出血等应急状态下,当其他蛋白合成受抑制时,HSP70 表达反而增加[10]。HSP70 具有保护脑细胞从而具有增加脑细胞对缺血、缺氧的耐受性,抵抗进一步致死性损伤的作用。有研究表明,HSPs在氧化应激的过程中调控蛋白质的合成起着重要作用[11]。本实验结果提示,凉血通瘀方可能通过增加HSP70的表达对神经细胞发挥一定的保护作用。
凉血通瘀方含药血清可使NO及NOS表达升高。有关NO与脑出血的研究已引起了人们的重视,但大多仍限于实验研究[12],临床研究较少,对于中医药与NO研究也较少,故加强对NO的研究工作有利于进一步深入了解脑出血的发病机理。前期课题组已进行了NO及NOS的相关研究,研究表明,凉血通瘀方可在一定程度上增强NOS活性,促进NO的分泌[13],本实验进一步验证凉血通瘀方对NO及NOS的影响。也进一步验证了前期的临床实验结果,提示凉血通瘀方降低TNF-α,升高HSP70,促进NO和NOS的表达可能是其治疗出血性中风的作用机理之一。
[1] 张兰坤,过伟峰,徐丹,等.凉血通瘀方治疗出血性中风急性期瘀热阻窍证患者73例临床观察[J].中医杂志,2012,53(1):28-30.
[2] 黄艳,赵凤鸣,吴勉华,等.凉血通瘀方对过氧化氢致血管内皮细胞损伤的保护作用[J].时珍国医国药,2010,21(12):3064-3066.
[3] 国家中医药管理局脑病急症协助组.中风病诊断与疗效评定标准[J].北京中医药大学学报,1996,19(1):55.
[4] 全国第四届脑血管病学术会议.各类脑血管病的诊断标准[J].中华神经科杂志,1996,29(26):279.
[5] 赵军,邢涛,董林,等.骨刺消巴布剂对兔膝骨性关节炎IL-1β和TNF-α 的影响[J].西部中医药,2012,25(11):25-27.
[6] 史福平,张国华,王珊,等.β-七叶皂甙钠对脑出血患者血清肿瘤坏死因子-α含量变化的影响[J].临床荟萃,2006,21(6):390-392.
[7] 杨清,刘杉珊,王世瑶,等.急性脑血管病患者血清ACTA、TNF-α检测的临床意义[J].中风与神经疾病杂志,2006,23(5):621.
[8] 廖鑫,王佳唐,罗东,等.幕上高血压脑出血小骨窗开颅术后C反应蛋白及TNF-α的变化及对转归影响的临床分析[J].现代生物医学进展,2012,19(12):3708-3721.
[9] Li You-jia,Huang Yan,Fu Yao-gao.The Serum Dynamic Change of TNF-α and IL-6 by Mini-invasive Aspiration in Patients with Cerebral Hemorrhage[J].Chinese Journal of Integrative Medicine on Cardio/Cerebrovascular Disease,2007,5(2):117-119.
[10] Fang HK,Ko WJ,Lin CY.Inducible heat shock protein70,interleukin-18,and tumor necrosis factor alpha correlate with outcomes in spontaneous intracerebral hemorrhage[J].J Clin Neurosci,2007,14(5):435-441.
[11] Furchgott RF,Zawadzki JV.The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine[J].Nature,1980,27,288(5789):373-376.
[12] 赵雪莹,李冀.二至丸对D-半乳糖致衰老模型大鼠NO、NOS影响的实验研究[J].中医药学报,2011,39(5):39-40.
[13] 黄艳,赵凤鸣,梁晓雯,等.凉血通瘀方对血管内皮细胞分泌NO及 NOS的影响[J].中药药理与临床,2010,26(3):55-57.

