长江中下游湖群大型底栖动物群落结构及影响因素
蔡永久,姜加虎,张 路,陈宇炜,龚志军
(中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
长江中下游湖群大型底栖动物群落结构及影响因素
蔡永久,姜加虎,张 路,陈宇炜,龚志军*
(中国科学院南京地理与湖泊研究所, 湖泊与环境国家重点实验室, 南京 210008)
长江中下游地区是我国淡水湖泊分布最为密集的区域,其中面积大于10 km2的湖泊总面积占相同级别中国淡水湖泊总面积的51.3%。目前对本地区湖泊大型底栖动物研究主要是关于单个湖泊或几个湖泊之间的比较,将区域内湖泊作为一个整体来分析的研究较少。为揭示现阶段长江中下游浅水湖泊底栖动物群落现状及其主要影响因素,于2008年和2009年夏季对本地区5个湖群69个湖泊大型底栖动物和水化学进行了调查,并分析区域过程和局域环境条件在决定该地区底栖群落结构中的相对重要性。结果表明水体矿化度、电导率及氮磷指标在不同湖群间具有显著差异,而高锰酸盐指数、叶绿素a及营养状态指数无显著差异。密度方面,以寡毛类和摇蚊幼虫为优势类群的湖泊共46个,占总数量的66.7%,以螺类为优势类群之一的湖泊16个,占总数量的23.2%;生物量方面,以螺类为优势的湖泊数量最多(33个),占总数量的46.4%,但以寡毛类和摇蚊幼虫占优势的湖泊亦有27个,占总数量的39.1%,双壳类仅在9个湖泊占据优势。典范对应分析结果表明该地区底栖动物群落结构是局域环境条件和区域过程共同作用的结果,两类因子共解释了33.9%的底栖动物群落变异,其中局域环境因子占被解释量的48.1%,空间变量占35.4%。空间变量较高的解释量表明对整个长江中下游地区湖泊而言,区域过程对底栖动物的分布也起着非常重要的作用。
长江中下游; 湖群; 浅水湖泊; 局域和区域过程; 大型底栖动物
湖沼学研究开展以来,对于单个湖泊长期深入的研究,加深了对湖泊生态系统结构和重要过程的认识,这也是湖沼学研究开展以来湖沼学家研究的重点。近年来,湖沼学研究不再局限于单个湖泊,而将视野扩大到湖泊所在的地理区域和流域范围,甚至全球尺度[1- 2]。湖泊比较是区域湖沼学的重要研究内容,多个湖泊的比较研究对湖沼学理论的发展具有重要意义[1],同时对湖泊生态系统的管理和保护也具有指导作用[3]。湖群的存在为比较湖沼学提供了得天独厚的条件。Riera等将湖群定义为一块湖泊富集的景观,这些湖泊具有相同的起源、气候和流域特征[4]。尽管如此,湖群内湖泊的物理、化学和生物特征也可能存在着显著差异。了解这些差异背后的驱动因素是区域湖沼学的主要内容之一。在区域层次上,通过对多个湖泊的比较研究,更有助于找出湖泊间和湖群间各种差异的内在机制。然而,对于湖群的研究不能只考虑湖泊自身的环境特征,同时需要将湖泊所在的地理位置考虑在内[5]。
种库假说认为:生物群落的结构不仅与所在地的环境条件和生态过程(如竞争和捕食)有关,也受其潜在的物种库即区域种库所左右。在区域和局域尺度上起主导作用的过程是不同的。捕食、寄生、竞争以及环境波动(即干扰)等生态过程的作用主要发生在局域水平上,而物种的长距离扩散、物种形成、大范围的绝灭以及物种分布区的变化等生物地理学过程主要发生在区域尺度[6]。局域和区域过程共同作用于群落的结构和物种组成,并且两者的相对作用大小随群落类型、环境条件及尺度而变化[7]。自然界中,生物群落受到多尺度过程的影响,群落结构多尺度调控的概念来源于环境筛选。要想成功建立一个局域群落,每个物种必须通过多尺度下一系列的环境筛选[7]。在大尺度上,历史事件和气候限制形成了各区域独特的物种库,且只有物种库的一部分物种最终能在局域群落中共存。对于湖泊生态系统来说,局域群落的物种必须通过区域、流域、湖群、生境等多个尺度环境因子的筛选。这些因子对物种的特性具有筛选作用,只有那些具有特定特性且能通过各级因子筛选的物种才能最终形成局域群落。
长江中下游平原是我国淡水湖泊分布最密集的核心区,且主要分布在长江两侧。根据其地理位置和流域特征,可分为洞庭湖群、江汉湖群、鄱阳湖群、华阳湖群、苏皖湖群和太湖湖群[8],为开展区域湖沼学研究提供了天然条件。关于长江中下游地区湖泊底栖动物群落结构及其影响因素已有一些研究,但主要是关于单个湖泊或几个湖泊之间的比较,将区域或流域内湖泊作为一个整体来分析的更少[9]。本文尝试将长江中下游湖泊作为一个整体,假设底栖动物受到局域和区域过程的共同作用,通过比较分析不同湖群水体理化参数和底栖动物群落结构,并利用partial CCA解析区域过程和局域环境条件在决定本地区湖泊底栖动物群落结构中的相对重要性。
1 材料与方法
1.1 研究区域及底栖动物样品采集
共调查大于10 km2的湖泊69个,分属洞庭湖群、江汉湖群、鄱阳湖群、华阳湖群和太湖湖群(图1)。采样时根据湖泊面积大小,在敞水区布设若干采样点(附录1)。底栖动物定量采集用1/16 m2改良Peterson采泥器,每个样点采集1—2次,泥样经60目尼龙筛洗净后,剩余物至于白磁盘中将底栖动物活体逐一挑出,样本用10%福尔马林溶液保存。样品带回实验室鉴定至尽可能低的分类单元[10- 12],统计各个分类单元的数量,然后用滤纸吸去表面固定液,置于电子天平上称重,最终结果折算成单位面积的密度和生物量。样品采集时间为2008年6月至8月及2009年7月至8月。
1.2 环境因子的测定
采集底栖动物样品时,同时现场测定环境指标并采集水样分析水化学参数。透明度(SD)用赛氏盘测定,pH、电导率(Cond)和矿化度(TDS)于现场用YSI 6600 V2 多参数水质监测仪测定。采集水样冷冻保存带回实验室,氨氮(NH4-N)、硝态氮(NO3-N)、正磷酸盐磷 (PO4-P)用微量流动注射分析仪(Skalar-SA1000)测定,总悬浮颗粒物(TSS)、总氮(TN)、总磷(TP)、叶绿素a (Chl a)及高锰酸盐指数(CODMn)的测定参考标准方法[13]。水生植被盖度指数(Macrophytes):现场采样时估计采样点附近区域水生植物覆盖情况,分为5个等级0,1—25%,26—50%,51—75%,76—100%,分别赋值为0—4。为评价各湖泊营养状态,参照蔡庆华等改进的湖泊富营养化评价综合模型计算各点的营养状态指数(TSI)[14],计算公式为:
TSI = 0.540 TSI (Chl a) + 0.297 TSI (SD) + 0.163 TSI (TP)
式中,TSI (Chl a)、TSI (SD)、TSI (TP)按照 Carlson 提出的营养状态指数计算方法获得,计算公式分别为:
TSI (Chl a)=10×(6-(2.04-0.68 (ln (Chl a)))/ln2)
TSI (SD)=10×(6-ln(SD)/ln2)
TSI (TP)=10×(6-ln(48/TP)/ln2)
式中,Chl a、SD、TP 单位分别为μg/L、m、μg/L。
1.3 数据分析
数据分析前,各湖泊多个采样点的环境因子数据和底栖动物数据进行平均,理化数据进行Z标准化(平均值0,标准差1),物种数据进行对数转换。
1.3.1 湖群比较分析:
由于不同湖群湖泊数量相差较大,且数据转换后仍不能满足方差分析的要求,故采用Kruskal-Wallis非参数检验比较各湖群水体理化参数的差异性,多重比较采用Games-Howell方法。由于部分环境因子之间存在高度相关性,利用主成分分析对环境因子进行降维分析。
运用Bray-Cutis相似性指数分析不同湖群湖泊底栖动物群落相似性,并利用相似性分析 (ANOSIM) 检验各湖群湖泊底栖动物群落差异显著性,多元分析采用对数转换后的密度数据,分析软件用PRIMER 5.0[15]和PAST 2.01[16]。
1.3.2 影响因素解析
用partial CCA解析局域环境条件和区域过程对本地区底栖动物群落的影响,分析时需构建两个解释变量矩阵,分别是局域环境因子和空间变量[17]。局域环境因子矩阵 [E],包括水体理化因子、TSI指数、水生植被盖度指数以及主成分分析中各湖泊在前二个主成分的得分,将主成分作为环境因子的原因是许多环境因子之间存在共线性,而主成分作为多个因子的线性组合,在实际分析中可能会更好地反映出环境梯度的影响。空间变量利用湖泊的经纬度为基础构建,鉴于空间过程的影响并不是简单的线性格局,也包括其它复杂的过程(如隔离、斑块),在这里采用9个空间变量组合,分别为X、Y、XY、X2、Y2、X2Y、XY2、X3、Y3,X和Y分别为各湖泊采样点经度和纬度的平均值(附录1)。同时考虑到不同湖群底栖动物可能具有显著差异,将5个湖群作为哑变量进入分析,经纬度变量和哑变量共同构成空间变量矩阵 [S]。CCA分析时,分别用局域环境因子和空间变量作为解释变量,物种数据为对数转换后的密度数据,并剔除出现率小于10%的物种,因子筛选采用向前引入法(α=0.05),基于Monte Carlo permutation检验(n=9999)。
根据Borcard的方法[17],将物种数据矩阵的总变异分解成不同组分:1)将筛选后环境因子和空间变量一起进入CCA分析,计算出总解释量[E+S];2)环境因子独立解释量[E|S],分析时环境因子为解释变量,空间变量为协变量;3)空间变量独立解释量[S|E],分析时空间变量为解释变量,环境变量为协变量,排序结果的显著性用Monte Carlo permutation 检验(n=9999)。空间变量和环境变量共同解释部分[E∩S]计算公式为[E+S]-[E|S]-[S|E],未解释部分为1-[E+S],分析软件采用CANOCO 4.5[18]。
2 结果
2.1 水体理化特征
表1为不同湖群水体理化参数和营养状态指数,非参数分析结果表明电导率、矿化度、TSS及水体中氮磷浓度在各湖群间具有显著差异。电导率和矿化度呈现出一致的变化趋势,其中鄱阳湖群最低(平均值分别为150.4 μs/cm、99.04 mg/L),洞庭湖群、江汉湖群和华阳湖群处于中间水平,太湖湖群最高,其电导率和矿化度的平均值分别为532.03 μs/cm和345.86 mg/L。水体中TN和TP的共同变化特征是太湖湖群显著高于其他湖群(除和鄱阳湖群TP无显著差异),洞庭湖群和华阳湖群水体TN和TP含量均较低(表1),水体中CODMn、Chl a及TSI指数在各湖群间无显著差异。
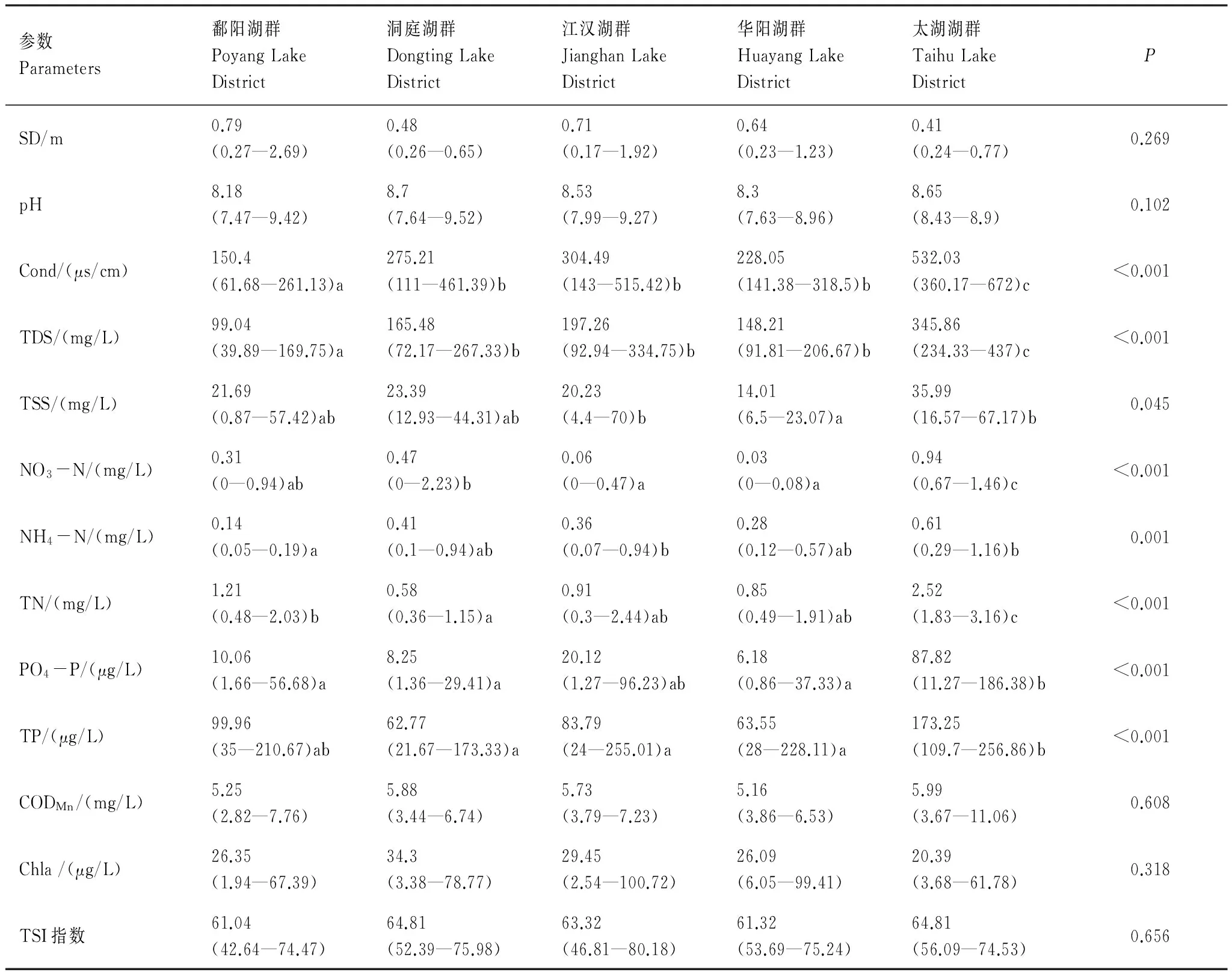
表1 各湖群水体理化特征及非参数Kruskal-Wallis检验结果
不同字母间表示差异显著
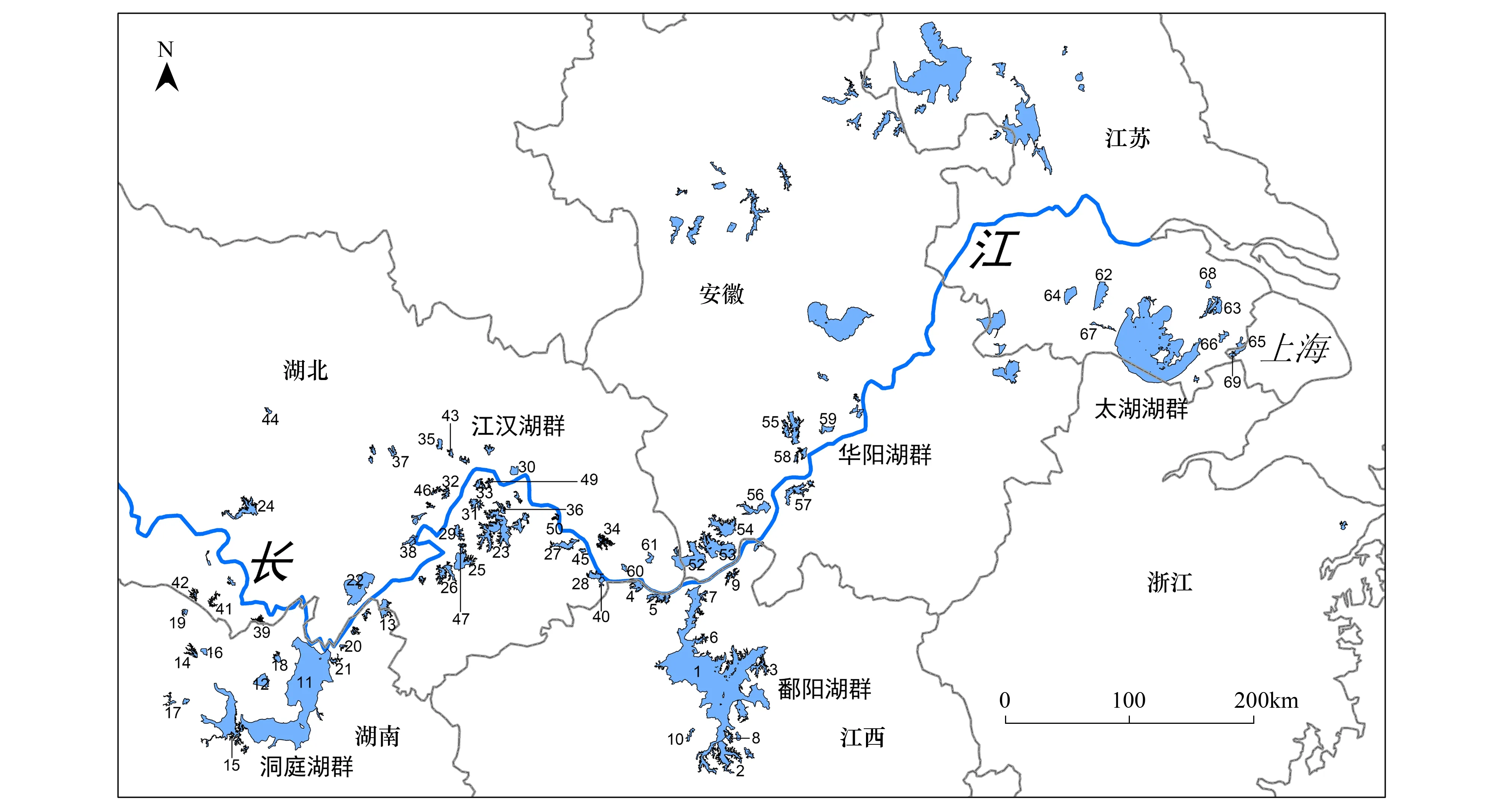
图1 长江中下游湖泊空间分布图 Fig.1 Spatial distribution of the studies lakes in the middle of lower reaches of the Yangtze River
Table2StatisticalcharacteristicsofPCA,includingtheeigenvalues,percentageofvarianceexplained,andcorrelationsforeachenvironmentalvariablewiththefirst3principlecomponents

参数ParametersPC1PC2PC3SD/m0.7250.2130.059pH-0.651-0.222-0.364Cond/(μs/cm)-0.4700.745-0.332TDS/(mg/L)-0.4790.763-0.297TSS/(mg/L)-0.718-0.1080.387NO3-N/(mg/L)-0.2200.5960.424NH4-N/(mg/L)-0.4080.1260.464TN/(mg/L)-0.7200.2700.465PO4-P/(μg/L)-0.3900.264-0.504TP/(mg/L)-0.7800.1370.057CODMn/(mg/L)-0.659-0.2450.030Chla/(μg/L)-0.697-0.568-0.126TSI-0.866-0.425-0.112特征值Eigenvalue5.0812.3391.38方差解释率Percentageofvarianceexplained/%39.0817.9910.63
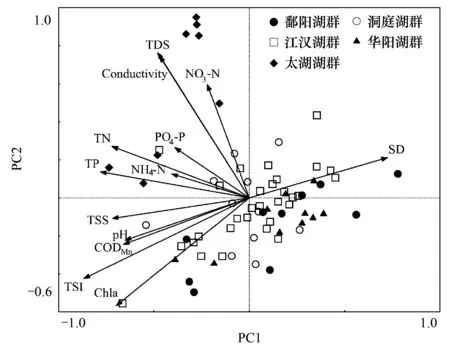
图2 69个湖泊水体理化参数主成分分析 Fig.2 Principal components analysis (PCA) of physicochemical parameters in the 69 studied lakes
2.2 不同湖群底栖动物类群组成
图3为不同类群底栖动物在各湖泊总密度和总生物量中所占比重。密度方面,鄱阳湖群中,赤湖以摇蚊幼虫和螺类为优势类群,双壳类(主要是河蚬)和寡鳃齿吻沙蚕在珠湖和军山湖比重较高,鄱阳湖的优势种为河蚬,其他中小型湖泊为寡毛类和摇蚊幼虫共同主导。洞庭湖群中,摇蚊幼虫在芭蕉湖和珊珀湖占据绝对优势,城市湖泊岳阳南湖完全被寡毛类主导(97.39%),平均密度为2192个/m2,黄盖湖为寡毛类和摇蚊幼虫共同主导,螺类在湖南东湖等6个湖泊中占据一定比重。根据优势类群,江汉湖群的30个湖泊可分为两组,其中以寡毛类和摇蚊幼虫占据优势的湖泊有22个,而以螺类和寡毛类及摇蚊幼虫占主导的湖泊有8个,其中大冶湖、斧头湖和洪湖螺类所占比重较高,分别为95.71%、71.88%和63.34%。华阳湖群类群组成较为多样,6个中小型湖泊(武山湖、太白湖、武昌湖、升金湖和破岗湖)以寡毛类和摇蚊幼虫为优势类群,菜子湖和白荡湖的优势类群为螺类,大型湖泊龙感湖和泊湖的优势种为寡鳃齿吻沙蚕。太湖湖群中除澄湖和淀山湖的优势种分别为钩虾和寡鳃齿吻沙蚕外,其它湖泊优势类群均为寡毛类和摇蚊幼虫。对所有湖泊进行分析发现,以寡毛类和摇蚊幼虫为优势类群的湖泊共46个,占所调查湖泊的66.7%,以螺类为优势类群之一的湖泊16个,占总数量的23.2%,双壳类和其它种类占优势的湖泊共7个(表3)。

表3 不同类群底栖动物占优势湖泊数量在各湖群的分布
生物量方面,虽然螺类和双壳类个体较大,在多数湖泊对总生物量贡献较大,但寡毛类和摇蚊幼虫的贡献率在部分湖泊亦较高。鄱阳湖群中,以寡毛类和摇蚊幼虫占优势的湖泊有4个,螺类和双壳类占优势的湖泊分别为2个和4个。洞庭湖群大部分湖泊为螺类(6个)和双壳类(2)所主导,其余3个湖泊为摇蚊幼虫所主导。江汉湖群螺类为优势的湖泊有17个,寡毛类和摇蚊幼虫为主的湖泊13个,数量大致相当。华阳湖群中5个湖泊为螺类所主导,2个为寡毛类和摇蚊幼虫共同主导,其余3个湖泊以这3个类群共同主导。太湖湖群中各类群占优的湖泊数量相当,其中钩虾对澄湖生物量贡献较大。整体分析发现,虽然以螺类为优势的湖泊数量最多(32个),占总数量的46.4%,但以寡毛类和摇蚊幼虫占优势的湖泊亦较多(27个),占总数量的39.1%,双壳类仅在9个湖泊占据优势(表3)。
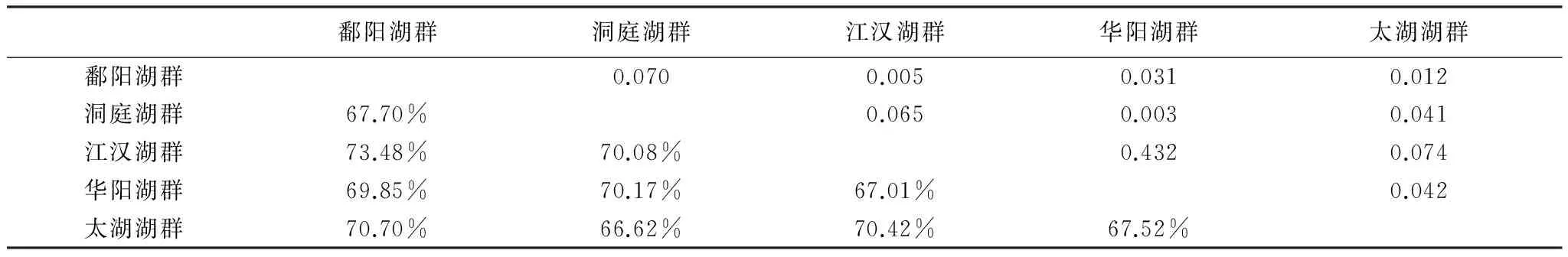
表4 不同湖群湖泊大型底栖动物群落Bray-Curtis相似性分析
*下方为不相似性百分比,上方为显著性水平
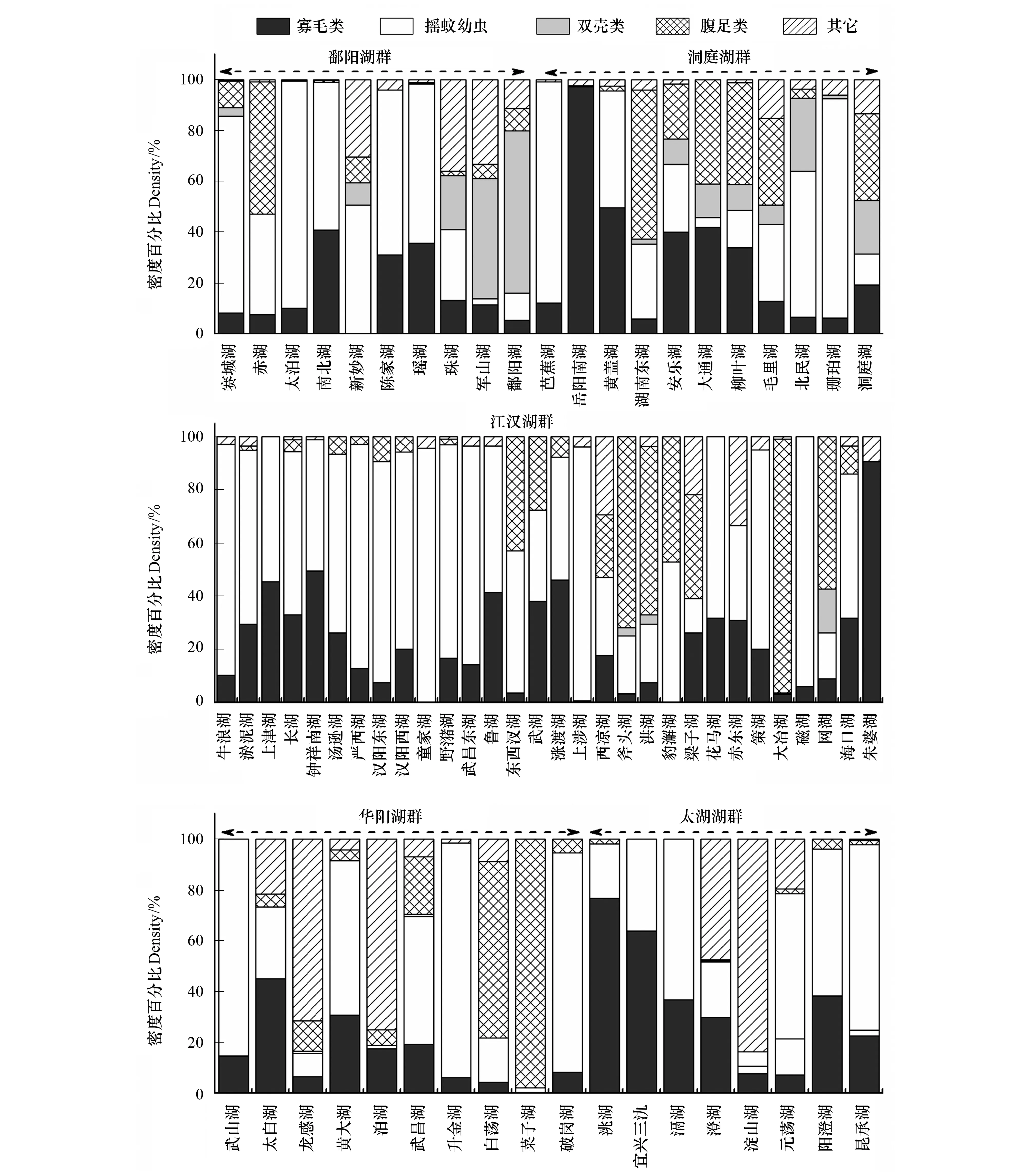
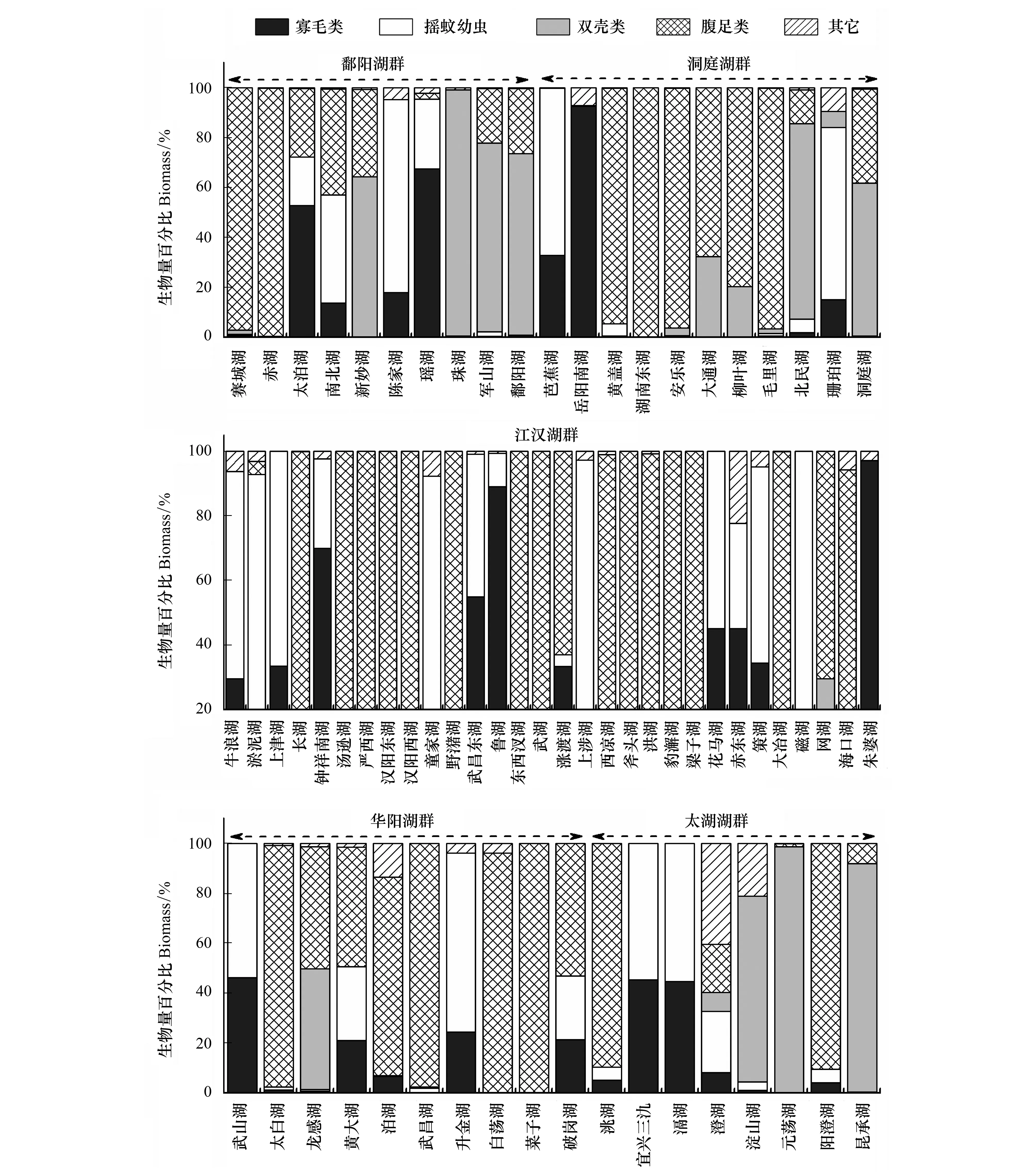
图3 各湖群4种常见类群大型底栖动物在总密度和生物量中所占比重Fig.3 Relative abundance and biomass of the four common taxonomic groups in the five lake districts

图4 基于69个湖泊大型底栖动物密度的Bray-Curtis相似性系数的非度量多维标度排序图Fig.4 Ordination plot of macrozoobenthic communities based on Bray-Curtis similarity coefficients in the 69 lakes
Bray-Curtis相似性系数结果表明不同湖群底栖动物群落不相似性百分比较高,介于67.52%至73.48%(表4)。ANOSIM分析结果表明鄱阳湖群和洞庭湖群与华阳湖群和太湖湖群底栖动物群落组成具有显著差异,鄱阳湖群和洞庭湖群之间无显著差异;江汉湖群除与鄱阳湖群具有显著差异外,与其它湖群均无显著差异,这可能是因为江汉湖群湖泊数量较多,按底栖优势类群可分为两组,将江汉湖群湖泊分为两组进入分析时发现,所有湖群间均具有显著差异(鄱阳湖群和洞庭湖群间除外)。NMDS排序分析显示除江汉湖群部分湖泊分布较为集中外,其它湖群湖泊空间聚集现象并不明显,这表明湖群内部底栖动物群落变化也较大,湖群因子不能很好地反映本区域湖泊底栖动物群落的变化。
2.3 影响因素解析
2.3.1 局域环境条件
典范对应分析表明局域环境因子中TSI指数、Macrophytes、Chl a、TDS 及PC2与69个湖泊底栖动物群落关系最显著。第一轴和第二轴的特征值较大,分别为0.198和0.146,分别解释了10.2%和7.4%的物种数据变异及43.9%和32.3%的物种-环境关系变异,第三轴解释了3.0%的物种数据变异和12.9%的物种-环境关系变异,第四轴特征值和解释率都相对较低,前3轴基本反映了底栖群落与局域环境因子的关系。蒙特卡罗检验结果表明CCA前3个排序轴均显著(P1,2lt;0.001,P3=0.008),第四轴不具有显著性(P4= 0.53)。第一轴与TSI、Macophytes、Chl a相关性较高,其主要反映了水体营养状态及生境的异质性;第二轴与Chl a相关性最高,第三轴与TDS和PC2呈显著正相关(表5和图5)。从各因子进入CCA分析的顺序及其解释量可以看出,TSI指数、Macrophytes和Chl a 解释量相对较高,而TDS和PC2相对较低。物种与环境因子的排序图显示水生盖度指数与螺类相关性较高,TSI和Chl a与摇蚊科幼虫及颤蚓科的种类相关性较高,PC2则与钩虾、双壳类及寡鳃齿吻沙蚕呈正相关关系(图5)。
2.3.2 空间过程
面积适宜性主要考虑对关键生境及敏感生态系统的保护需要,特别是目标种群产卵生物量的积累,其大小和范围取决于保护目的、关键生境质量和数量、资源利用程度、其它管理工具的有效性以及目标生物种群特征等因素。边界和面积可依照海域地形特征、生态地理属性,以及目标种群的扩散类型及开发程度等因素来确定。
利用空间变量和湖群哑变量作为解释因子,CCA分析最终筛选出5个空间变量组合最大程度地解释了底栖动物群落变异,而5个哑变量并没有在组合之内。蒙特卡罗检验结果表明CCA分析前两个排序轴均显著(P1,2lt; 0.01),第三轴和第四轴不具有显著性(P3= 0.08,P4= 0.11)。相比于局域环境因子的CCA分析,空间变量的CCA分析前两轴特征值较小,分别为0.159和0.081,共解释了12.3%的物种数据变异和66.7%的物种-环境关系变异(表6)。空间变量与第一轴相关性较低,第二轴与变量Y、X3及X相关性较强。从排序图中可以看出,各湖群湖泊在排序图中能较好的区分开来,其中洞庭湖群湖泊位于排序图的下方,江汉湖群湖泊主要位于排序图左方,鄱阳湖群湖泊位于排序图右侧,太湖湖群湖泊较为分散地分布区排序图上方,华阳湖群湖泊位于排序图中心区域(图6)。
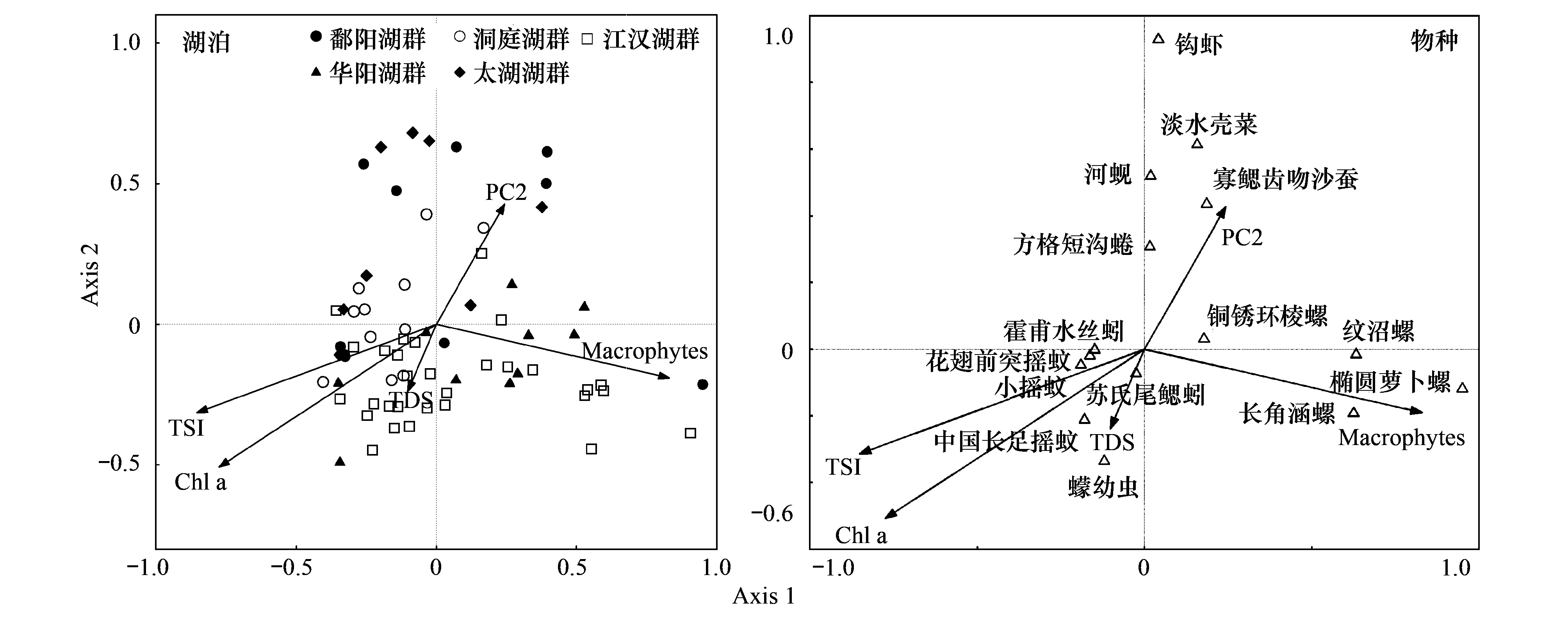
图5 69个湖泊大型底栖动物群落与局域环境因子的典范对应分析排序:湖泊,物种,仅显示与环境因子相关性较高的种类Fig.5 CCA biplots of macrozoobenthic communities in 69 lakes, showing the first three axes and the most strongly correlated local environmental variables: lakes, species, only show species with high correlations with environmental variables
2.3.3 方差分解
局域环境因子和空间变量对底栖动物群落变异的总解释量为33.9%,其中局域环境因子独立解释的部分为16.3%,稍大于空间变量的解释率12.0%,由空间过程控制的局域环境因子解释量最小,仅为5.6%。partial CCA分析发现当以空间变量为协变量时,PC2和TDS并不具有显著性,表明电导率和矿化度主要受湖泊所处地理区域控制。方差分解结果表明长江中下游地区湖泊底栖动物并不简单受到局域环境因子的影响,区域过程在调节底栖群落结构中同样起着重要的作用。
表5底栖动物群落与局域环境因子的典范对应分析结果,各因子括号中的数值分别代表因子筛选时进入CCA分析的顺序和对底栖群落变异的解释量
Table5Summarystatisticsforthefirstfouraxesofthecanonicalcorrespondenceanalysis(CCA)ofspecies-environment,Valuesaftertheenvironmentalvariablesrefertotheentryranksofvariablesinforwardselectionandthepercentageofvarianceexplainedinspeciesdata

轴Axes1234特征值Eigenvalues0.1980.1460.0580.029种类-环境相关性Species-environmentcorrelations0.8320.760.7460.519物种数据累积变化百分比Cumulativepercentagevarianceofspeciesdata10.217.620.622.1物种-环境关系累积变化百分比Cumulativepercentagevarianceofspecies-environmentrelationship43.976.289.195.5TSI(1,8.37%)-0.853-0.3140.0420.380Macrophytes(2,7.70%)0.830-0.1910.1220.505Chla(3,8.26%)-0.775-0.508-0.1290.349TDS(4,3.34%)-0.102-0.2380.965-0.028PC2(5,4.67%)0.2440.4280.851-0.102
表6底栖动物群落与空间变量的典范对应分析结果,各因子括号中的数值分别代表因子筛选时进入CCA分析的顺序和对底栖群落变异的解释量
Table6Summarystatisticsforthefirstfouraxesofthecanonicalcorrespondenceanalysis(CCA)ofspecies-environment,Valuesaftertheenvironmentalvariablesrefertotheentryranksofvariablesinforwardselectionandthepercentageofvarianceexplainedinspeciesdata

轴Axes1234特征值Eigenvalues0.1590.0810.0560.046种类-环境相关性Species-environmentcorrelations0.7980.7350.7310.563物种数据累积变化百分比Cumulativepercentagevarianceofspeciesdata8.212.315.217.6物种-环境关系累积变化百分比Cumulativepercentagevarianceofspecies-environmentrelationship44.266.782.295Y(1,4.47%)-0.4260.7220.5100.166X2(2,4.21%)0.4770.3720.783-0.002X3(3,3.95%)0.2860.7920.417-0.220XY(4,2.98%)0.3220.1560.783-0.157X(5,3.59%)0.2270.8390.015-0.046
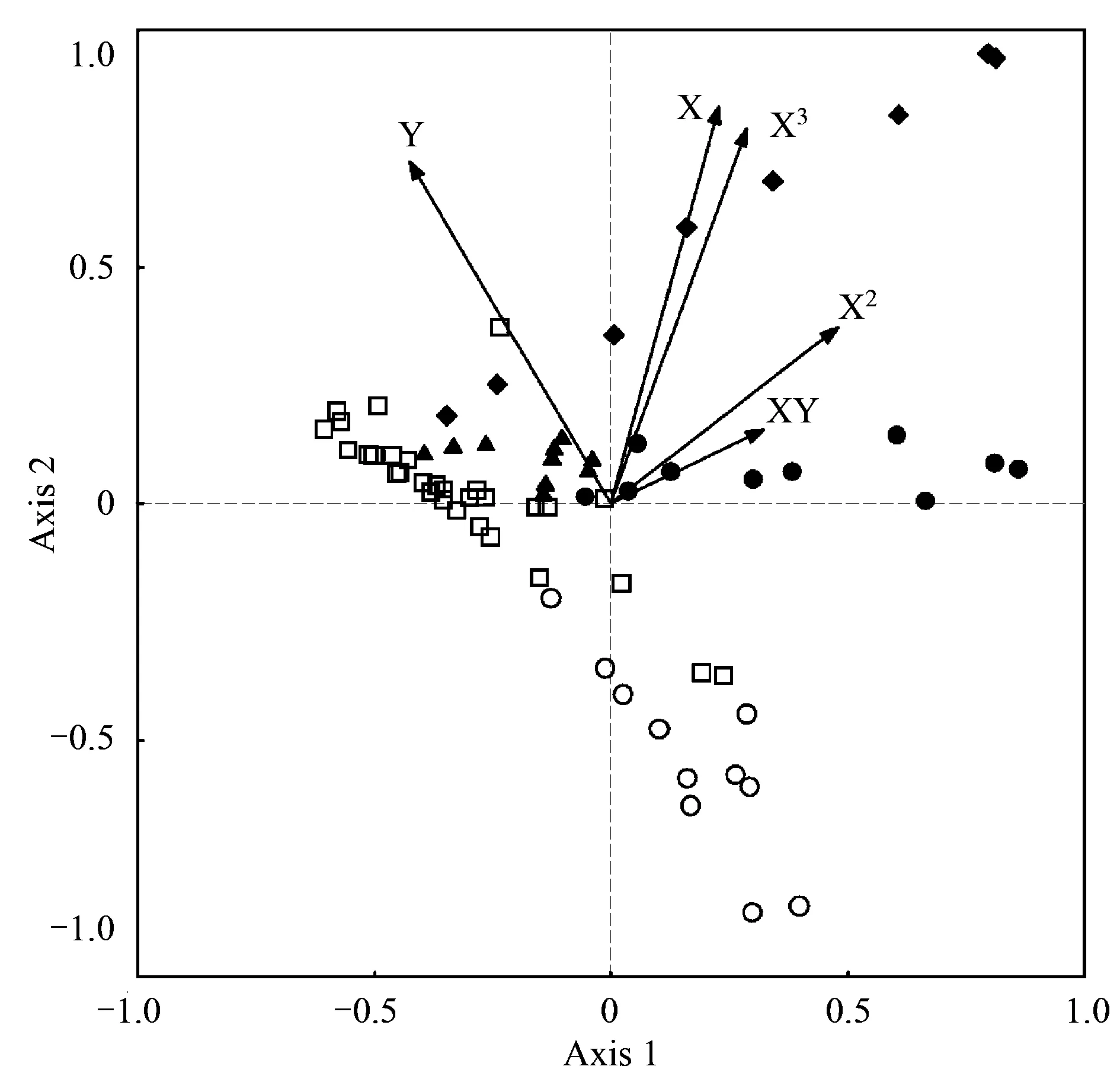
图6 69个底栖动物群落与空间变量的典范对应分析排序图Fig.6 CCA biplots of macrozoobenthos communities in 69 lakes, showing the first two axes and the most strongly correlated spatial variables
3 讨论
3.1 水体理化特征
电导率和矿化度在不同湖群间差异显著。电导率和矿化度是湖泊水化学的重要基础参数,它们直接反映了水体的离子总量,又可间接反映湖泊盐类物质积累的环境条件。矿化度受不同湖群所处流域的自然限制,因而呈现出明显的区域差异。在五个湖群中,鄱阳湖群矿化度最低,所有湖泊的最低值也出现在该湖群的军山湖(39.9 mg/L),相比之下,太湖湖群湖泊的电导率都较高,如淀山湖、元荡湖和澄湖都超过了400 mg/L。湖群之间矿化度的显著差异可能与地质背景、流域降水及湖泊换水周期有一定的关系。
长江中下游地区的年降水量一般都在1000 mm以上,但其在各大湖群也呈现出地区性的分异,如鄱阳湖地区的鄱阳县年降水量比洞庭湖地区的岳阳、常德、沅江多250—300mm,而后者又比太湖地区的吴县东山及上海多200—300mm,表明鄱阳湖区年降水量最丰、洞庭湖区次之,太湖地区降水量相对最少[8]。另一方面,鄱阳湖群降水丰沛,水系发达,它上承赣、抚、信、饶、修5条河流,来水量丰富,水体交换快,可溶性盐类不易因水蒸发而积累。此外,鄱阳湖流域土壤类型多为红壤,而红壤呈酸性,含盐量较低[19],故入湖河流的矿化度也较低,这些因素共同造就了鄱阳湖群成为本区矿化度最低的湖群。
湖泊换水周期也直接决定了离子在湖泊水体中的积累。鄱阳湖、洞庭湖和石臼湖是目前长江中下游仅有的天然通江湖泊,虽分属不同的湖群,地质背景差异较大,但矿化度均较低,分别为73、155及122 mg/L。这主要是因为它们与长江的水体交换频繁,换水周期较短,稀释作用较为明显,因而矿化度也较低。华阳湖群湖泊多为大中型湖泊,部分湖泊季节性与长江相通,其矿化度也较低。
研究发现反映水体营养盐含量的指标在湖群间存在显著差异,水体中营养盐含量除与地质背景有关,其受人类活动影响更多。华阳湖群总氮和总磷水平均最低,这是因为该地区湖泊多为大中型湖泊,且季节性与长江相通,不适宜进行施肥养殖,养殖方式多为人放天养,因此其氮磷含量较低。鄱阳湖群、洞庭湖群和江汉湖群除有几个大型(鄱阳湖、洞庭湖)和大中型湖泊(洪湖、军山湖、梁子湖)外,其他湖泊均面积较小,湖泊多被集体、个人或公司承包经营,养殖过程中为追求产量,多采用投饵投肥的养殖方式,因此营养盐含量较高,且3个湖群之间无显著差异。太湖湖群不仅担任着养殖的功能,其周边工农业发达、人口众多,污水不可避免地进入湖泊水体,过去几十年中一直接纳生产生活污水,因此营养盐含量最高。研究发现Chl a在湖群间不具有显著差异,表明其并不简单受水体营养盐含量影响,Chl a主要反映了浮游植物的生物量,其它因素(如鱼类和浮游动物捕食、气候条件等)对其控制作用也不可忽视,可惜未能获得这方面数据。
3.2 影响因素解析
3.2.1 局域环境因子
CCA分析中筛选出5个局域环境因子与底栖动物群落关系最密切。其中TSI指数和Chl a反映了水体的营养水平,Macrophytes主要反映了生境的异质性程度,PC2主要代表了电导率和矿化度,先前分析表明电导率和矿化度不仅仅受地质背景影响,更反映了湖泊的换水周期和稀释条件。从排序图中可以看出,PC2和Macrophytes均位于TSI指数和Chl a的反方向,CCA分析中相关系数介于-0.370至-0.542间,换水周期直接影响了水体的营养状态和Chl a浓度,而水草覆盖度较高的湖泊水体营养状态一般较低,说明5个环境因子之间是相互关联的。因此,筛选出的环境因子主要反映了水体的营养状态和生境的异质性。关于水体营养状态和水生植被对底栖动物群落结构影响的研究较多,长江中下游地区湖泊水体营养状态较高,一方面与其较高的本底值有关,另一方面是人类活动的结果,本文研究的湖泊营养水平均已到达或超过中营养水平。富营养化对底栖动物的影响往往是间接的,主要是改变了生境条件和食物质量,如氧含量、底质粒径和异质性、有机质含量、食物中元素比例和必需脂肪酸含量[20]。水生植被的存在为底栖动物提供了栖息和躲避捕食的场所,同时其复杂的构件结构也增加了可供多个物种共存的空间[21]。
3.2.2 区域过程
研究淡水底栖动物分布的一个重要方面就是分析地理因素和环境因素对其分布的限制作用。某物种在特定生境的缺失可能是该物种并没有扩散到该生境,也可能是它已经扩散到了该地区,但是由于环境条件不利于其存活或竞争,从而导致它没有繁衍下去。相反,一个物种在特定地点的出现可能是它竞争优势更强,也有可能是它到了这里,而它潜在的竞争对手并没有扩散到这里。扩散受多种因素的影响,如高山、距离、扩散方式、种群大小[7]。一个种群在新生境的竞争和繁衍能力取决于它对新环境的适应能力。许多底栖动物是世界性分布种类,而另一些种类则仅出现在特定的气候区或地理区域。
生态学研究中,关于底栖动物群落大尺度空间格局的研究较少。推测起来,区域过程的影响在小范围地理区域可以忽略。然而,对整个长江中下游地区的研究不能忽视区域过程的影响。本文研究结果表明超过40%的被解释的底栖动物群落变化可归结于空间因素,尽管部分空间因素解释量可能是未测量环境因子共同的解释量,但是如此高的比重表明至少部分物种受空间过程影响更明显。事实上,在调查中也发现部分物种值出现在某些特定湖泊,如耳河螺(Rivulariaauriculata)和双龙骨河螺(R.bicarinata)只在洞庭湖群和鄱阳湖群湖泊中采集到,寡鳃齿吻沙蚕在调查湖泊中的分布上限为鄱阳湖群,其主要分布在长江下游两侧的湖泊中,而在中游的洞庭湖群和江汉湖群均未采集到,寡鳃齿吻沙蚕为海洋河口性种类,可见其在本区湖泊中的分布受到空间扩散的限制。在CCA分析中,筛选的空间变量包括X、Y、XY、X2及X3,表明底栖动物群落并不简单受空间经度和纬度梯度的影响,而更复杂的景观格局(表现为高次方的空间变量),如斑块、隔离等在决定底栖群落结构中也起着重要作用。CCA分析中,5个湖群哑变量并没有进入最终的CCA模型,可能是因为哑变量与某些空间变量存在相关,单独分析每个哑变量对底栖群落的解释能力发现,4个湖群哑变量(除华阳湖群)均与底栖群落显著相关,解释率介于3.08%—4.36%,与空间变量的解释率相当,这种结果说明湖群并不是解释本区底栖群落变化的最佳空间变量,这可能是因为部分湖泊在历史上同属于一个湖群,如洞庭湖群和江汉湖群由云梦泽演化形成,而鄱阳湖群和华阳湖群在历史上均是彭蠡泽的一部分,因此它们的物种库可能存在重叠。
3.2.3 区域过程和局域环境条件的相对重要性
底栖动物受到从局域到区域多重因素的影响,本研究中,大尺度的空间变量和局域环境因子对解释底栖动物群落变化都非常重要。淡水生物群落的地理格局常对应于大尺度的历史、气候和地理因素。一些学者认为大型无脊椎动物群落结构变化与大尺度的区域过程关系更密切,其次才是局域环境条件[22]。在极地溪流和湖泊中,底栖群落变化经常与纬度梯度联系密切[23- 24]。区域过程和局域环境条件对生物群落的影响与尺度相关,一般而言,随着研究范围的减小,局域环境因子的解释量逐渐增加,而空间变量和受空间限制的环境因子的解释量却逐渐降低。本地区湖泊虽覆盖了很大的地理范围,但是在决定底栖群落结构时局域环境条件比大尺度的空间趋势更重要。这可能与本地区湖泊的特征有关,所调查的湖泊虽属于不同湖群或流域,但均为整个长江流域的一部分,多数湖泊的形成都与长江有密切的关系,且许多物种在该区域是广泛分布的,可能并没有受到扩散的限制,更多的是受到局域环境条件的限制。Johnson和Goedkoop对瑞典湖泊[25]及Sandin和Johnson对瑞典溪流[26]底栖动物的研究也发现局域环境因子较空间变量更重要,这可能与其较小的研究区域范围有关。本文中与纬度相关的区域过程对本区湖泊底栖动物群落的影响较小,这可从CCA分析筛选出的空间变量组合看出,其原因是本区湖泊纬度跨度小,湖泊主要是沿经度上分布,而纬度对生物种群的影响一般较经度更明显。另外,Donohue 等研究发现富营养化导致底栖动物群落在局域和区域尺度上均趋于同质化[27],而本区湖泊营养状态普遍较高,可能导致该区湖泊底栖群落趋于同质化,从而降低了空间变量的解释率。
本研究中,CCA解释的底栖动物群落变异量较低,共为33.9%,Økland指出低的解释率所提供的信息也是非常有价值的[28]。低解释率在生态学数据中是很常见的,主要是因为生态学数据繁杂且庞大,另外野外调查取得数据也不可避免地与实际情况存在差异,特别是物种数据,由于野外工作条件及人力财力的限制,不可能获得所有物种的数据。本文中局域环境因子的解释也较低,独立解释率为16.3%,这主要是因为测定的因子数量较少,本文使用的因子主要是水体的理化参数,而有关沉积物和生境的数据未能获得,如沉积物有机质含量、粒径组成、底质类型、鱼类潜在捕食压力、与河流和其它湖泊的连通性。这些因子都对底栖动物的组成、密度和生物量有显著影响,因此导致局域环境因子的解释率较低。
致谢:周方正、邓建明、吴召仕帮助采集野外样品, 特此致谢。
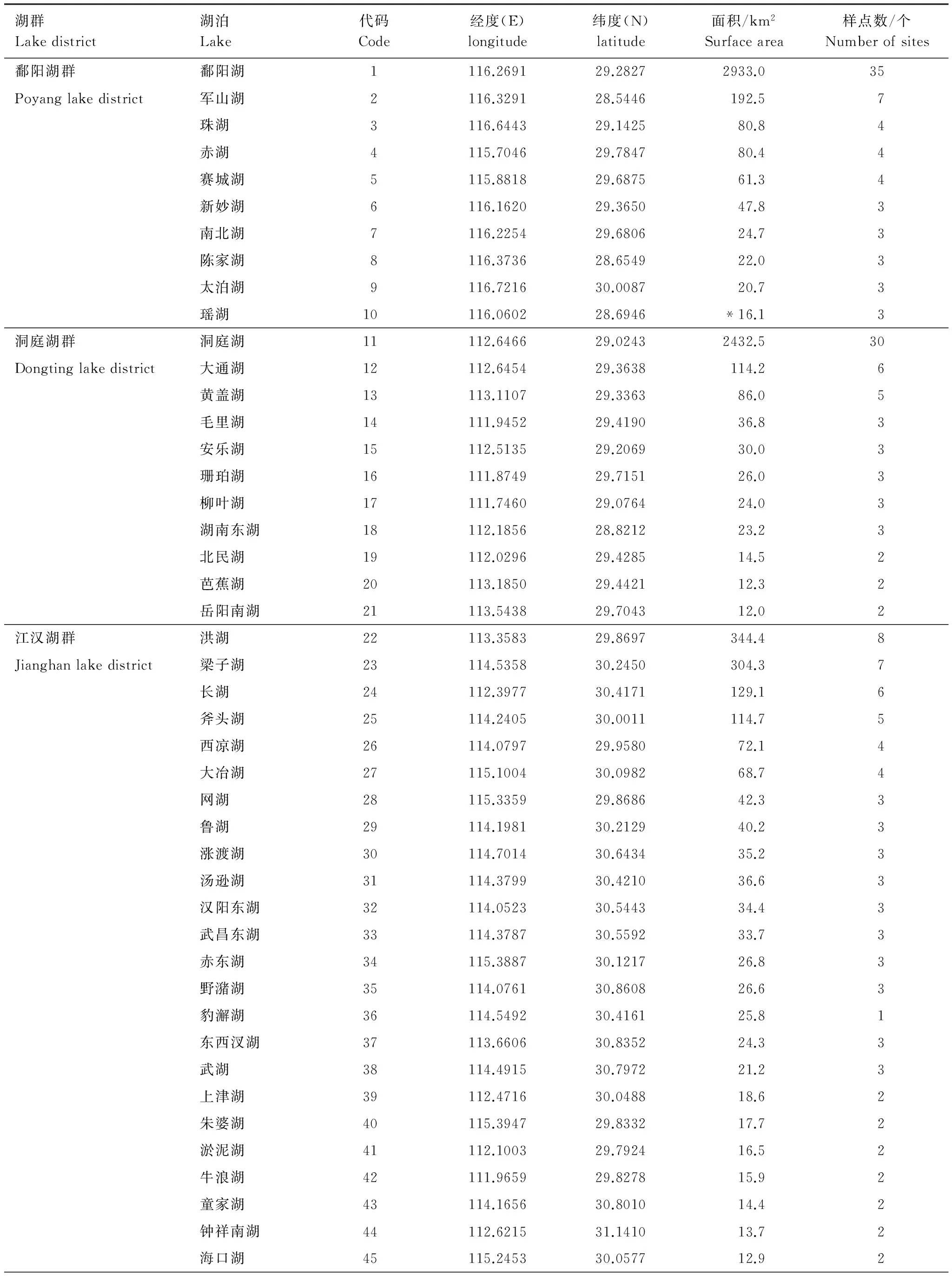
附录1 研究湖泊经纬度、面积及采样点个数
续表

湖群Lakedistrict湖泊Lake代码Code经度(E)longitude纬度(N)latitude面积/km2Surfacearea样点数/个Numberofsites汉阳西湖46113.900430.506812.72上涉湖47114.210930.133511.92策湖48115.159930.252811.82严西湖49114.471930.572611.82花马湖50115.042930.299910.32磁湖51115.052530.2089*9.62华阳湖群龙感湖52116.155729.9410316.28Huayanglakedistrict黄大湖53116.391130.0183299.28泊湖54116.422430.1659180.47菜子湖55117.104730.8105172.17武昌湖56116.711230.2695100.55升金湖57117.023430.368378.54破岗湖58117.168930.650160.04白荡湖59117.369030.816139.73武山湖60115.588129.909525.13太白湖61115.807829.972216.13太湖湖群滆湖62119.815731.6105146.56Taihulakedistrict阳澄湖63120.783631.4357119.05洮湖64119.565231.626889.05淀山湖65120.952231.108263.74澄湖66120.820731.217545.03宜兴三氿67119.809731.366823.23昆承湖68120.747331.583118.02元荡湖69120.889531.067712.92
湖泊面积数据源自《中国湖泊志》[29],*瑶湖和磁湖在书中无记录,面积数据源于Google earth面积测量工具,经纬度数据为用于CCA分析中构建空间变量的基础数据
[1] Kratz T K, Frost T M. The ecological organisation of lake districts: general introduction. Freshwater Biology, 2000, 43: 297- 299.
[2] Downing J A, Prairie Y T, Cole J J, Duarte C M, Tranvik L J, Striegl R G, McDowell W H, Kortelainen P, Caraco N F, Melack J M. The global abundance and size distribution of lakes, ponds, and impoundments. Limnology and Oceanography, 2006, 51: 2388- 2397.
[3] Heiskary S A, Wilson C B, Larsen D P. Analysis of regional patterns in lake water quality: Using ecoregions for lake management in Minnesota. Lake and Reservoir Management, 1987, 3: 337- 344.
[4] Riera J N. A geomorphic template for the analysis of lake districts applied to the Northern Highland Lake District, Wisconsin, USA. Freshwater Biology, 2000, 43: 301- 318.
[5] Kratz T K, Webster K E, Bowser C J, Maguson J J, Benson B J. The influence of landscape position on lakes in northern Wisconsin. Freshwater Biology, 1997, 37: 209- 217.
[6] Fang J Y, Wang X P, Tang Z Y. Local and regional processes control species richness of plant communities: the species pool hypothesis. Biodiversity Science, 2009, 17: 605- 612.
[7] Huston M A. Local processes and regional patterns: appropriate scales for understanding variation in the diversity of plants and animals. Oikos, 1999. 86: 393- 401.
[8] Jiang J H, Dou H S, Su S D. Freshwater lake groups in the middle and lower reaches of the Yangtze and Huaihe Rivers. Wuhan: Changjiang Press, 2009: 428.
[9] Xie Z C. Studies on ecological characteristics of macrozoobenthos and lake ecosystem health in lake districts along the mid-lower reaches of Changjiang River [D]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2003.
[10] Liu Y Y, Zhang W Z, Wang Y X, Wang E Y. Economic fauna of China: Freshwater Mollusca. Beijing: Science Press, 1979: 134.
[11] Morse J C, Yang L F, Tian L X. Aquatic Insects of China Useful for Monitoring Water Quality, Nanjing: Hohai University Press, 1994: 570.
[12] Wang H Z. Studies on Taxonomy, Distribution and Ecology of Microdrile Oligochaetes of China, with descriptions of Two New Species from the Vicinity of the Great Wall Station of China, Antarctica. Beijing: Higher Education Press, 2002: 228.
[13] Jin X C, Tu Q Y. The standard methods for observation and analysis of lake eutrophication, 2nd ed. Beijing: China Environmental Science Press, 1990: 137.
[14] Cai Q H, Liu J K, King L. A comprehensive model for assessing lake eutrophication. Chinese Journal of Applied Ecology, 2002, 13: 1674- 1678.
[15] Clarke K R and Warwick R M. Changes in marine communities: an approach to statistical analysis and interpretation, 2nd edition. PRIMER-E, Plymouth, 2001.
[16] Hammer Ø, Harper D A T, Ryan P D. PAST: paleontological statistics software package for education and data analysis. Palaeontologia electronica, 2001, 4: 1- 9.
[17] Borcard D, Legendre P, Drapeau P. Partialling out the spatial component of ecological variation. Ecology, 1992, 73: 1045- 1055.
[18] ter Braak C J F,milauer P. CANOCO reference manual and CanoDraw for Windows user′s guide: software for canonical community ordination (version 4.5): Microcomputer Power Ithaca, NewYork, 2002.
[19] Kumar S. Effect of Different Vegetation Systems on Soil Erosion and Soil Nutrients in Red Soil Region of Southeastern China. Pedosphere, 2003, 13: 121- 128.
[20] Anderson D M, Glibert P M, Burkholder J M. Harmful algal blooms and eutrophication: Nutrient sources, composition, and consequences. Estuaries and Coasts, 2002, 25: 704- 726.
[21] Brönmark C. Interactions between epiphytes, macrophytes and freshwater snails: a review. Journal of Molluscan Studies, 1989, 55: 299- 311.
[22] Richards C, Johnson L B, Host G E. Landscape-scale influences on stream habitats and biota. Canadian Journal of Fisheries and Aquatic Sciences, 1996, 53: 295- 311.
[23] Heino J, Muotka T, Paavola R, Paasivirta L. Among-taxon congruence in biodiversity patterns: can stream insect diversity be predicted using single taxonomic groups? Canadian Journal of Fisheries and Aquatic Sciences, 2003, 60: 1039- 1049.
[24] Johnson R K, Goedkoop W, Sandin L. Spatial scale and ecological relationships between the macroinvertebrate communities of stony habitats of streams and lakes. Freshwater Biology, 2004, 49: 1179- 1194.
[25] Johnson R K and Goedkoop W. Littoral macroinvertebrate communities: spatial scale and ecological relationships. Freshwater Biology, 2002, 47: 1840- 1854.
[26] Sandin L and Johnson R K. Local, landscape and regional factors structuring benthic macroinvertebrate assemblages in Swedish streams. Landscape Ecology, 2004, 19: 501- 514.
[27] Donohue I, Jackson A L, Pusch M T, Irvine K. Nutrient enrichment homogenizes lake benthic assemblages at local and regional scales. Ecology, 2009, 90: 3470- 3477.
[28] Økland R H. On the variation explained by ordination and constrained ordination axes. Journal of Vegetation Science, 1999, 10: 131- 136.
[29] Wang S M and Dou H S. Chinese Lakes. Beijing, Science Press, 1998: 480.
参考文献:
[6] 方精云, 王襄平, 唐志尧. 局域和区域过程共同控制着群落的物种多样性:种库假说. 生物多样性, 2009, 17: 605- 612.
[8] 姜加虎, 窦鸿身, 苏守德主编. 江淮中下游淡水湖群. 武汉: 长江出版社, 2009, 428.
[9] 谢志才, 湖群大型底栖动物的生态学特征及生态系统健康评价. 武汉: 中国科学院水生生物研究所, 2003.
[10] 刘月英, 张文珍, 王跃先, 王恩义. 中国经济动物志·淡水软体动物. 北京: 科学出版社, 1979: 134.
[12] 王洪铸. 中国小蚓类研究——附中国南极长城站附近地区两新种.北京: 高等教育出版社, 2002: 228.
[13] 金相灿, 屠清瑛. 湖泊富营养化调查规范. 北京: 中国环境科学出版社, 1990: 317.
[29] 王苏民和窦鸿身主编. 中国湖泊志. 北京: 科学出版社, 1998: 480.
StructureofmacrozoobenthosinlakesalongtheYangtzeRiverandrelationshipswithenvironmentalcharacteristics
CAI Yongjiu, JIANG Jiahu, ZHANG Lu, CHEN Yuwei, GONG Zhijun*
StateKeyLaboratoryofLakeScienceandEnvironment,NanjingInstituteofGeographyandLimnology,ChineseAcademyofSciences,Nanjing210008,China
In the middle and lower reaches of the Yangtze River, there are 108 freshwater lakes with surface area larger than 10 km2, accounting for 51.3% of the total freshwater lake area in China. However, few studies of macrozoobenthos were conducted at the regional scale, contrasting with many studies focused on individual or several lakes. To elucidate macrozoobenthic community structure and their relationships with spatial and environmental factors in shallow lakes along the Yangtze River, physicochemical parameters and macrozoobenthos were measured in 69 lakes of this region during summer in 2008 and 2009.We also evaluated the relative influences of local environmental conditions versus regional processes on macrozoobenthic community structure. The results showed that total dissolved solids (TDS), conductivity, nitrogen and phosphorus differed significantly among the five lake districts, but not for chemical oxygen demand (CODMn), chlorophyll a and Trophic State Index (TSI) index. In terms of density, 46 lakes (66.7% of the total 69 lakes) were dominated by Oligochaeta and Chironomidae, and Gastropoda was one of the dominant taxa in 16 lakes. With respect to biomass, 27 lakes were also dominated by Oligochaeta and Chironomidae, and 33 and 9 lakes were dominated by Gastropod and Bivlavia due to their relatively large body size, respectively. Canonical correspondence analyses (CCA) showed that macrozoobenthic community structure reflected the influence of local conditions (TSI, Macrophytes, Chl a, TDS) as well as regional processes. Only 33.9% of variation in a density matrix was explained by local environmental conditions and regional processes. Of the total explained variation, 48.1% and 35.4% were purely related to local environmental parameters and spatial variables, respectively. The high proportion of variation related to spatial variables indicated the importance of regional processes on spatial patterns of macrozoobenthic assemblages in this region.
the middle and lower reaches of the Yangtze River; lake district; shallow lakes; local and regional processes; macrozoobenthos
国家重点基础研究发展计划资助项目(2012CB417000);中国科学院南京地理与湖泊研究所一三五重点项目(NIGLAS2012135002);国家自然科学基金资助项目(41230744,31070418); 科技部基础性工作专项资助项目(2006FY110600)
2012- 05- 15;
2012- 10- 26
*通讯作者Corresponding author.E-mail: zjgong @niglas.ac.cn
10.5846/stxb201205150721
蔡永久,姜加虎,张路,陈宇炜,龚志军.长江中下游湖群大型底栖动物群落结构及影响因素.生态学报,2013,33(16):4985- 4999.
Cai Y J, Jiang J H, Zhang L, Chen Y W, Gong Z J.Structure of macrozoobenthos in lakes along the Yangtze River and relationships with environmental characteristics.Acta Ecologica Sinica,2013,33(16):4985- 4999.

