低温乳酸菌混菌培养条件的优化
田菊梅,梁 琪,张 炎,杨 敏,文鹏程,张卫兵,*
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.甘肃农业大学理学院,甘肃兰州730070)
乳酸菌(lactic acid bacteria,LAB)是一类能利用可发酵糖产生大量乳酸的细菌的统称,具有诸多生物学功效,如抗肿瘤、降血脂、提高免疫力等[1]。乳酸菌作为一种益生资源,越来越为人们所重视,但是对低温环境中生长的乳酸菌的研究相对还较薄弱。所谓低温发酵剂主要是由最适生长温度介于20~30℃之间的微生物组成的,最常用的包括乳球菌和明串珠菌[2]。目前国内外的报道多集中于低温冷藏肉、发酵香肠、鱼制品及泡菜中。工业生产上通常使用2种或多种菌株共同发酵,即混菌培养或混菌发酵,以改进单菌株发酵的不足,目前混菌培养在食品发酵、环境保护和能源方面已有一些研究和应用[3]。混菌培养可以充分利用菌株的共生作用,并能克服中间产物过大对菌株生长造成不利影响,从而提高目的产物得率。高密度培养过程中使用混菌培养,可以利用菌株间的共生关系,显著提高菌体细胞的浓度。混菌培养过程会受到诸多因素的影响,如培养液的初始pH、培养温度、培养时间、接种量、菌种活力、培养周期等。目前已有研究表明,对这些工艺参数进行优化,可以在很大程度上提高培养液的细胞浓度[4-5]。前期研究表明,分离自甘南牧区的在低温条件下性能优良的干酪乳杆菌和乳酸乳球菌在复配发酵酸奶时具有良好的共生关系。本研究主要以这两株低温乳酸菌为研究对象,在改良MRS培养基的基础上对其混菌培养条件进行了优化,为实现低温乳酸菌的高密度培养,制备质量稳定的直投式低温乳酸菌发酵剂提供重要依据。
1 材料与方法
1.1 材料与仪器
干酪乳杆菌(Lactobacillus casei,保藏号CGMCC 4775)、乳酸乳球菌(Lactococcus lactis,保藏号CGMCC4776) 甘肃省功能乳品工程实验室分离并保藏于中国普通微生物菌种保藏管理中心;牛肉膏、酵母膏、蛋白胨、葡萄糖、乙酸钠、柠檬酸二胺、K2HPO4、吐温-80、MgSO4、MnSO4等 北京奥博星生物技术责任有限公司,分析纯;脱脂乳培养基 将脱脂乳粉用蒸馏水复原成12%(W/V)的脱脂乳,115℃灭菌10min;改良 MRS液体培养基[6]蛋白胨10g,牛肉膏 10g,胰蛋白胨 5g,K2HPO4·3H2O 2g,乙酸钠5g,葡萄糖 23g,吐温 80 1mL,柠檬酸二铵 2g,MgSO4·7H2O 0.58g,MnSO4·4H2O 0.25g,4% 土豆汁,6%胡萝卜汁,8%番茄汁,加蒸馏水至1000mL,调节p H6.2~6.4,121℃灭菌 15min备用;计数培养基 MRS琼脂培养基。
SW-CJ-2FD超净工作台 苏州净化设备有限公司;YX-280A不锈钢手提式压力蒸汽灭菌锅 上海三申医疗器械有限公司;HG303-4电热恒温培养箱 南京实验仪器厂;PB-203电子天平 Mettler-Toledo公司;PHS-3C型数显酸度计 雷磁分析仪器厂;754PC型紫外可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 菌株活化 将冷冻保藏的两菌株在室温下解冻后,无菌条件下接种到MRS液体培养基中富集,再按3%(V/V)比例转接到脱脂乳培养基中,25℃恒温条件下培养至凝乳,重复5~6次以恢复菌株活力[7]。
1.2.2 种子液制备 两菌株充分活化后,以接种量3%(V/V)分别接入MRS液体培养基,于25℃恒温培养14h得到种子液。
1.2.3 培养条件对低温乳酸菌生长的影响
1.2.3.1 培养温度对低温乳酸菌生长的影响 将种子液以球杆菌比例2∶1(V/V)、接种量3%(V/V)接入液体 MRS 培养基中,分别在 19、22、25、28、31℃培养,每隔2h进行活菌计数,考察温度对乳酸菌生长的影响。
1.2.3.2 初始p H对低温乳酸菌生长的影响 将MRS液体培养基初始 p H 分别调为5.4、5.8、6.2、6.6、7.0,按球杆菌比例 2∶1(V/V)、接种量 3%(V/V)进行接种后于25℃培养,每隔2h进行活菌计数,考察初始pH对乳酸菌生长的影响。
1.2.3.3 接种量对低温乳酸菌生长的影响 分别以1%、2%、3%、4%、5%(V/V)的接种量将乳酸菌按球杆菌比例2∶1(V/V)接种于初始pH6.6的发酵培养基中,25℃条件下进行培养,每隔2h进行活菌计数,考察接种量对乳酸菌生长的影响。
1.2.4 低温乳酸菌培养条件的优化 根据Box-Benhnken实验设计原理,选取接种量、起始pH和培养温度三个因素为Box-Benhnken实验设计的自变量,以活菌数对数值为响应值,通过响应面分析(Response Surface Analysis,RSA)进行培养条件的优化[8-10]。响应面设计因素水平表如表1所示。
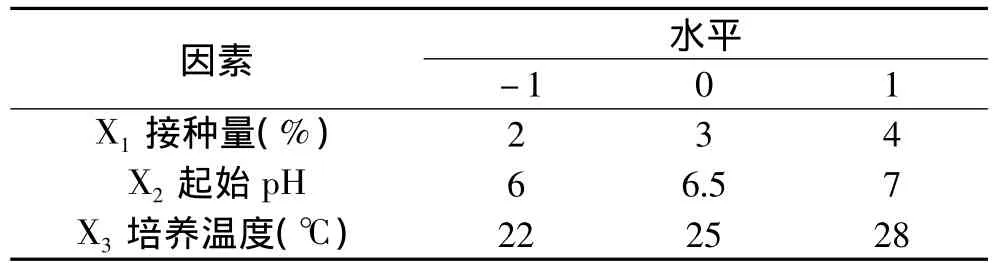
表1 响应面设计因素水平表Table 1 Levels and codes of variables of response surface analysis(RSM)
1.2.5 菌体生长的测定 采用稀释平板法计数[11]。无菌操作条件下用无菌生理盐水(0.85%NaCl)将培养液稀释至一定稀释度,取0.1mL涂布于计数培养基上,置于25℃培养48h,选取菌落数在30~300之间的平板进行菌落计数,每个样品重复3次,活菌数用lgCFU/mL表示。
1.2.6 数据统计 用Microsoft Excel 2003整理实验数据,并采用SPSS17.0中t检验进行组间及组内显著性差异分析。
2 结果与分析
2.1 单因素实验
2.1.1 培养温度对低温乳酸菌生长的影响 温度是影响微生物生长繁殖最重要的因素之一[12]。温度对低温乳酸菌活菌数的影响见图1。由图1可知,混合菌株在培养温度分别为 19、22、25、28、31℃时,达到稳定期时活菌数对数值分别为9.68、10.01、10.25、9.97、9.87lgCFU/mL。随着温度的增大,菌体浓度呈先增大后减小的趋势。19℃时菌体生长缓慢,菌体浓度最低,随着温度的升高,菌体浓度也显著地提高(p<0.01);25℃时菌体浓度达到最大值,高于此温度,菌体浓度又显著地降低(p<0.01);22℃时菌体浓度较28、31℃时高,但统计学差异不显著(p>0.05)。菌株的最适生长温度范围不同,这与它们长期进化过程中所处环境温度有关。本实验所用的菌株分离自甘南牧区牦牛酸乳中,该地区长年温度较低,因而分离得到菌株的最适生长温度也较低。Gassem等[13]认为过低的接种温度使活菌数量增加缓慢,温度过高,菌体又大量死亡,活菌数下降,与本实验结果一致。
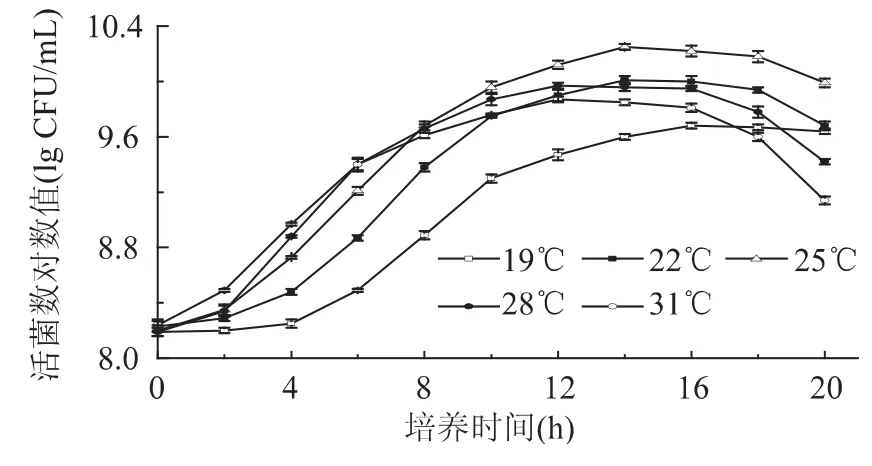
图1 温度对乳酸菌活菌数的影响Fig.1 The effect of temperature on LAB counts
2.1.2 初始pH对低温乳酸菌生长的影响 p H对微生物生长繁殖的影响也很大[14]。初始p H对低温乳酸菌影响见图2。由图可知,混合菌株在初始pH分别为5.0、5.5、6.0、6.5、7.0 时,达到稳定期时的活菌数对数值分别为 9.48、9.58、9.90、10.28、10.04lgCFU/mL。p H为6.5时菌体生长最快,高于或低于此p H,菌体浓度均显著地降低(p<0.01);培养时间约大于15h时,p H7.0时菌体浓度稍高于pH6.0,但差异不显著(p>0.05)。pH过低时,由于大量氢离子的存在,导致膜脂饱和度下降,从而影响乳酸菌的繁殖,随着p H的增大这种抑制作用逐渐减小,当p H超过6.5以后,抑制作用又开始增加。李妍等研究了起始pH对Lactobacillus casei Zhang生长的影响,结果发现p H在5.9时活菌数最多,高于或低于此值活菌数都会降低[15]。另外还有研究表明不同菌种的最适p H也不同,乳杆菌通常在pH5.5~6.0时生长良好。
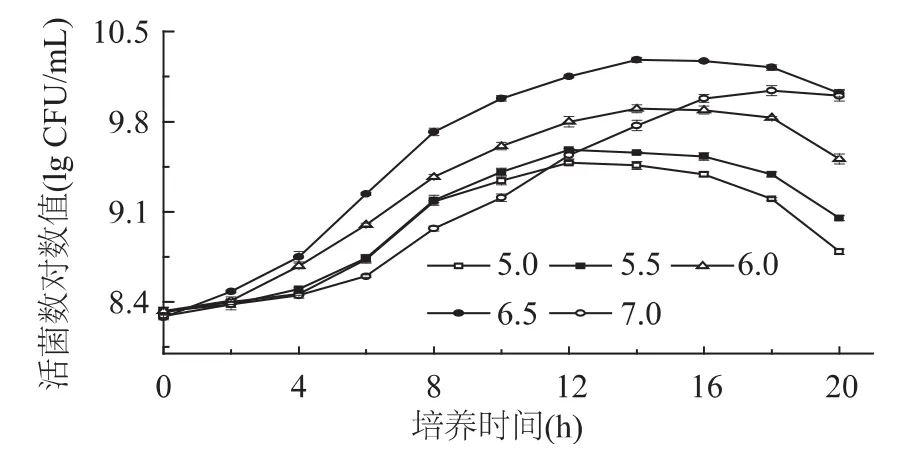
图2 初始pH对乳酸菌活菌数的影响Fig.2 The effect of initial pH value on LAB counts
2.1.3 接种量对低温乳酸菌生长的影响 接种量的大小会明显影响延滞期的长短,从而影响整个生长周期。一般来说,接种量大,则延滞期短,反之则长。接种量对低温乳酸菌活菌数的影响见图3。由图可知,混合菌株在接种量分别为1%、2%、3%、4%、5%时,达到稳定期时的活菌数分别为9.43、9.78、10.29、10.07、9.69 lgCFU/m L。在接种量1%~3%时,菌体浓度呈逐渐增大的趋势,随后菌体浓度开始降低。接种量3%时菌体浓度达到最大值,显著高于1%、2%、4%、5%(p<0.05),而2%接种量与5%接种量之间菌体浓度不存在显著性差异(p>0.05)。由于接种量过多时,微生物对营养物质的竞争增强,导致部分菌体死亡。谢丽源研究了混菌培养过程中接种量对乳酸菌生长的影响,结果表明:接种量为3%时,生长速率最快,接种量低于或高于3%,乳酸菌的生长都会受到不同程度的削弱,产酸速度减慢[16]。
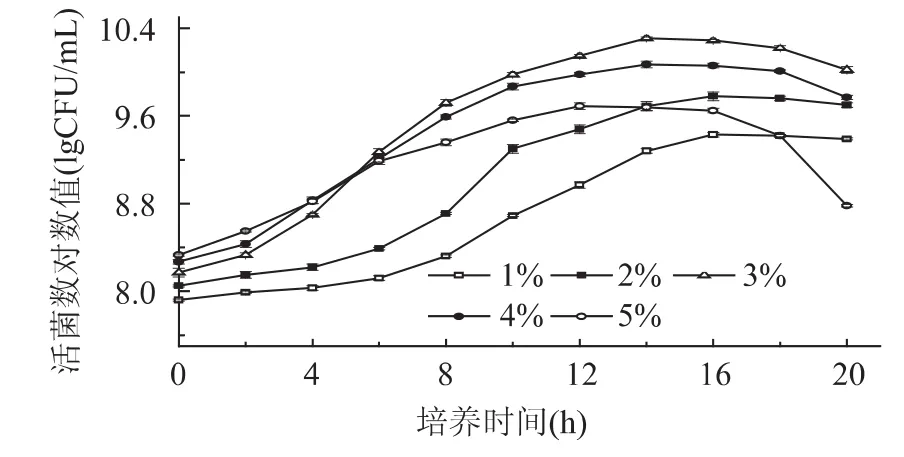
图3 接种量对乳酸菌活菌数的影响Fig.3 The effect of inoculation on LAB counts
2.2 低温乳酸菌培养条件的优化
综合单因素实验结果,选取培养温度、起始pH及接种量为自变量,活菌数对数值为响应值,采用响应面法对其进行优化,实验结果见表2。
利用Design Expert 7.0拟合实验结果得到回归方程,以Y代表响应值,以X1、X2、X3分别代表接种量、初始pH、培养温度。该实验的回归方程为:
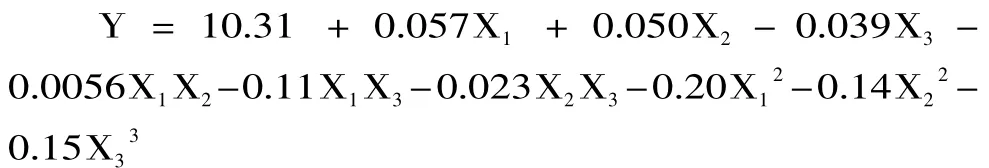
对该回归方程进行方差分析,结果见表3。由表3可知,该模型达到极显著水平(p<0.001),方程的失拟项不显著(p=0.064),说明方程误差较小,回归方程的拟合程度良好。回归方程的相关系数R2=0.9901,表明方程模型与实验数据有99.01%的符合度,可用该方程代替真实实验点进行分析。因素的一次项、二次项对响应值的影响极显著(p<0.01),同时温度和接种量的交互作用也极显著(p<0.01)。
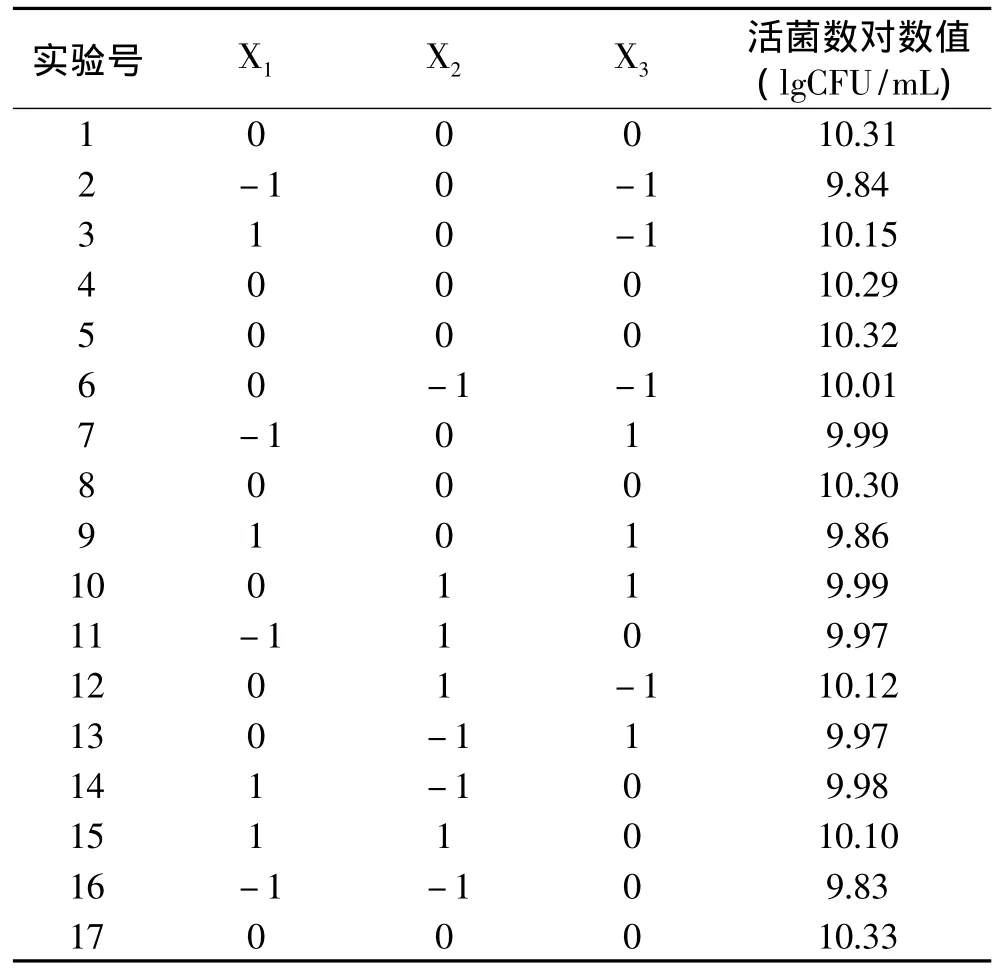
表2 Box-Benhnken实验设计及实验结果Table 2 Test design and results of Box-Benhnken
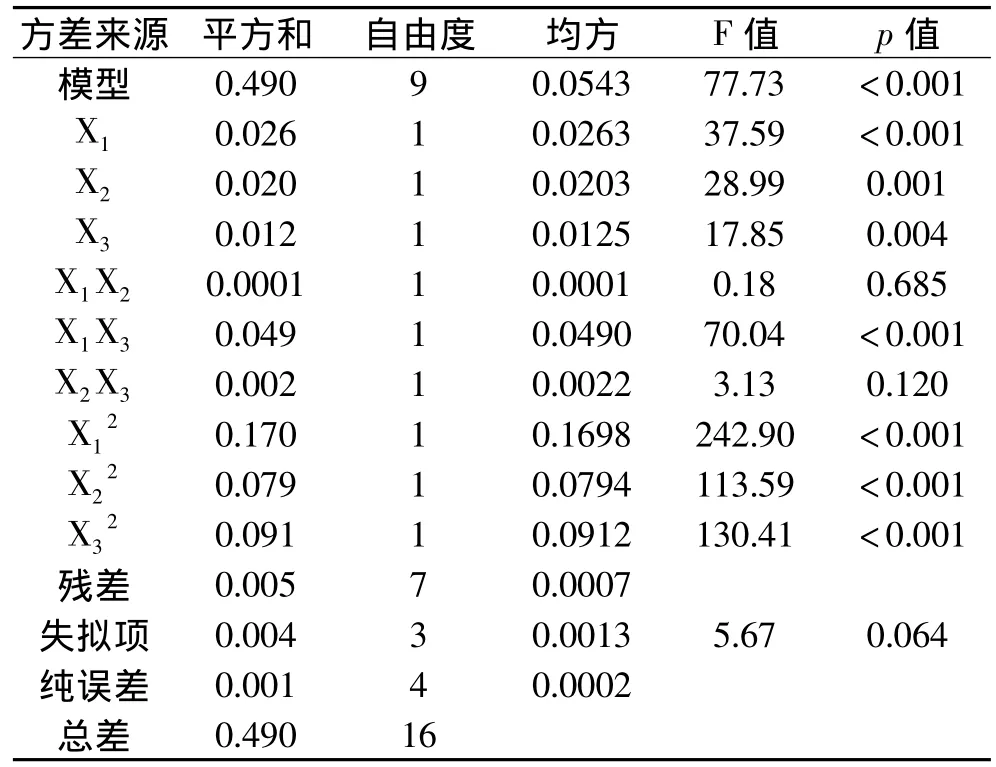
表3 Box-Benhnken实验方差分析Table 3 Analysis of variance for Box-Benhnken
以活菌数对数值作为响应值,绘制接种量与起始pH、接种量与培养温度、起始pH与培养温度之间的三维响应曲面图,分别见图4~图6。
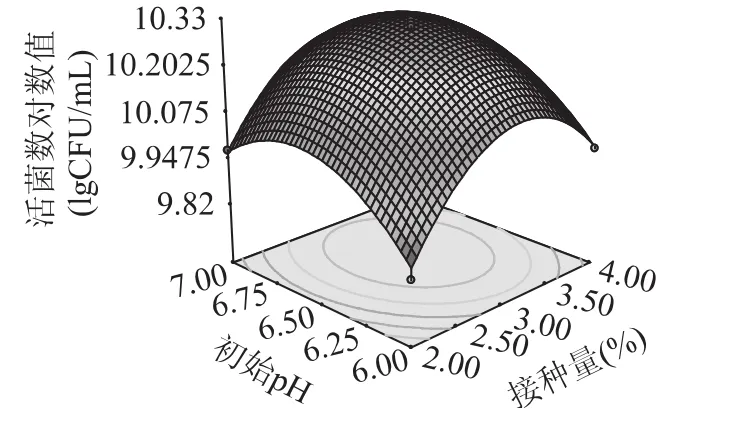
图4 接种量和初始pH对乳酸菌生长影响的响应面图Fig.4 The effect of inoculation amount and initial pH on LAB counts

图5 接种量和温度对乳酸菌生长影响的响应面图Fig.5 The effect of inoculation amount and temperature on LAB counts
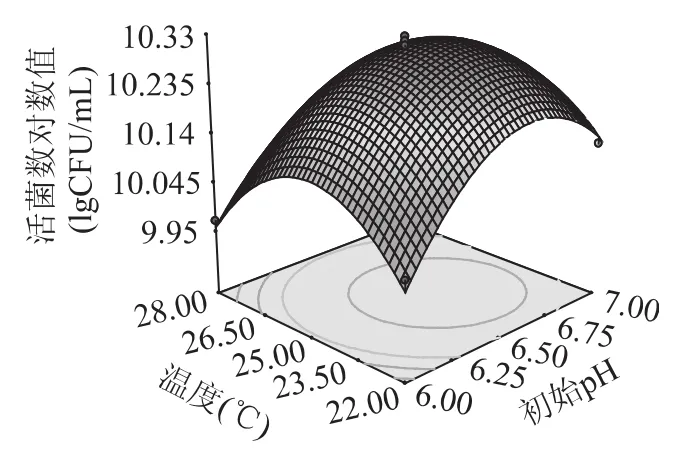
图6 初始pH和温度对乳酸菌生长影响的响应面图Fig.6 The effect of initial pH and temperature on LAB counts
图4 显示了当培养温度为中心水平时,初始pH与接种量对活菌数的影响。可以看出,初始pH与接种量不存在交互作用,且初始pH对接种量的影响较培养温度影响大。图5显示了当初始pH为中心水平时,培养温度与接种量对活菌数的影响,由图可知,培养温度与接种量的交互作用最明显,且培养温度对响应值的影响较接种量影响大。图6显示了当接种量为中心水平时,培养温度与初始pH对活菌数的影响,结果表明,培养温度与初始pH的交互作用不大。
由响应面的高点及等值线可以看出,在所选的范围内拟合曲面有极大值,对回归方程求导,得到极大值为10.32lgCFU/mL,对应的温度为24.32℃、起始pH为6.60、接种量为3.20%。为方便实验,将温度定为24.30℃、起始pH定为6.60、接种量定为3.00%。为检验响应曲面法所得结果的可靠性,采用上述发酵条件进行三次平行发酵实验,活菌数分别为:10.25、10.23、10.27lgCFU/mL,平均值为 (10.25 ±0.02)lgCFU/mL,与理论预测值相比,其相对误差约为0.99%,说明该数学模型对低温乳酸菌的生长条件预测较为准确。
3 结论
乳酸菌的增殖受诸多因素的影响,本实验通过单因素实验,研究了培养温度、起始pH、接种量对低温乳酸菌混菌培养的影响情况;在此基础上,通过Box-Behnken实验和响应面分析对低温乳酸菌混菌培养条件进行优化,得出最优培养条件为:接种量3.00%、起始p H6.60、培养温度24.30℃。在此培养条件下进行验证实验,乳酸菌活菌数可达(10.25±0.02)lgCFU/mL。
[1]Shah N P.Functional cultures and health benefits[J].International Dairy Journal,2007,17(11):1262-1277.
[2]陈洁 .中温发酵酸乳品质的研究[D].无锡:江南大学,2008.
[3]徐颖宣,徐尔尼,冯乃宪,等.微生物混菌发酵应用研究进展[J].中国酿造,2008(9):1-4.
[4]朱承亮.乳酸菌高密度培养技术的研究[D].杭州:浙江大学,2008.
[5]Chiara S,Vincenzo A,Vivien V,et al.Cell density cultivation of probiotics and lactic acid production[J].Biotechnology and Bioengineering,2003,82(2):213-222.
[6]Rosaria D A M,Modesto M,Biavati B.Antibiotic resistance of lactic acid bacteria andBifidobacteriumspp.isolated from dairy and pharmaceutical products[J].International Journal of Food Microbiology,2007,115:35-42.
[7]Antonis A,Benjamin S,Gurjot D,et al.Influence of fermentation on the acid tolerance and freeze drying survival ofLactobacillus rhamnosusGG[J].Biochemical Engineering Journal,2010,52:65-70.
[8]海洪,汪坤,金文英,等.Box-Behnken响应面法优化超声波提取蚕沙中叶绿素的工艺研究[J].食品工业科技,2009,30(3):207-209.
[9]Bas D,Boyacil H.Modeling and optimization I:usability of response surface methodology[J].Journal of Food Engineering,2007,78(3):836-845.
[10]徐向宏,何明珠 .实验设计与 Design-Expert、SPSS应用[M].北京:科学出版社,2010:147-160.
[11]Antara N S,Sujaya I N,Yokota A,et al.Identification and succession of lactic acid bacteria during fermentation of‘urutan’,a Balinese indigenous fermented sausage[J].World Journal of Microbiology & Biotechnology,2002,18:255-262.
[12]周德庆.微生物学教程[M].第二版.北京:高等教育出版社,2002:160-165.
[13]Gassem M A,Schmidtand K A,Frank JF.Exopolysaccharide production from whey lactose by fermentation withLactobacillus delbrueckiissp.bulgaricus[J].Journal of Food Science,1997,62(1):171-173.
[14]Asa S,Janett F,Hermann J,et al.Impact of fermentation pH and temperature on freeze-drying survival and membrane lipid composition ofLactobacillus coryniformisSi3[J].J Ind Microbiol Biotechnol,2008,35:175-181.
[15]李妍,赵文静,高鹏飞,等.优化益生菌Lactobacillus caseiZhang高密度培养条件[J].微生物学通报,2009,36(2):181-186.
[16]谢丽源.活性干燥乳酸菌发酵剂的研究[D].重庆:西南农业大学,2003.

