牛鼻栓三裂轮簇霉菌发酵产物的抗氧化活性研究
吴振莹,方 玲,高 强,陈双林
(南京师范大学生命科学学院,江苏南京210023)
具有抗氧化作用的天然产物可用于药品和食品中,对人体健康有重要作用[1]。国内外对抗氧化天然成分的研究十分活跃,然而目前研究较多的黄酮类、多酚类、皂苷类和酶类等传统的天然抗氧化物质多来源于植物[2-3]。近年来,真菌的抗氧化活性研究日益受到重视[4],表明真菌天然产物的抗氧化活性研究具有巨大潜力。植物内生真菌是一类存在于健康植物体内的微生物,种类和数量庞大,是具有新活性或新结构的天然物质的潜在资源库,其中也包含天然的抗氧化活性产物[5-6]。牛鼻栓(Fortunearia sinensisRehd.et Wils.)是中国特有的一种金缕梅科(Hamamelidaceae)木本植物,其叶内含有岩白菜内酯和牛鼻栓苷,具有抗氧化活性[7]。基于植物内生真菌能够产生与宿主植物相同或相似的次生代谢产物的原理[8],我们试图探寻具有较高抗氧化活性的牛鼻栓内生真菌菌株,以便进一步开发其抗氧化天然产物。在前期研究中,利用总抗氧化能力(T-AOC)试剂盒对从牛鼻栓叶片、叶柄、枝条和花中分离的60株内生真菌发酵培养物的总抗氧化活性进行测定,从而筛选出了一株抗氧化活性较高的牛鼻栓内生真菌菌株No.48,经形态分类学鉴定该菌为三裂轮簇霉菌(Verticicladium trifidum)。本文研究了该菌的总抗氧化活性和体外对超氧阴离子自由基(O-2·)、羟自由基(·OH)、二苯基苦基苯肼自由基(DPPH·)的清除能力,为进一步研究和开发其具有抗氧化活性的天然产物奠定了基础。
1 材料与方法
1.1 材料与仪器
菌种 采用总抗氧化能力(T-AOC)试剂盒对分离自牛鼻栓健康组织的内生真菌菌株的发酵液粗提物进行抗氧化活性的初测。其中,分离自枝条中的菌株No.48表现出明显较高的抗氧化活性,被选作为本研究的供试菌株。根据其产孢结构及菌落形态特征鉴定为三裂轮簇霉菌(Verticicladium trifidum)。菌种保存于南京师范大学生命科学院微生物实验室,编号No.48。
芦丁标准品 中国药品生物制品检定所;二苯基苦基苯肼(DPPH) 购自Sigma公司;总抗氧化能力(T-AOC)试剂盒 南京建成生物工程公司;培养基 菌株分离、纯化和保藏所用培养基均为马铃薯葡萄糖琼脂培养基(PDA);发酵培养基 马铃薯葡萄糖液体培养基(PDB);其它试剂 均为国产分析纯;所用水为超纯水。
旋转蒸发仪产品RE-52AA 上海亚荣生化仪器厂;真空冷冻干燥机CT-DW110 购自Heto公司;紫外可见分光光度计UVmini-1240 日本岛津公司。
1.2 发酵液提取物的制备
将活化后的菌株接种于PDB中,250mL三角瓶装液量100mL,(26 ±1)℃、130r/min 摇床培养6d,真空抽滤除去菌丝体后获得发酵液,旋转蒸发,浓缩至体积的1/10,加入适量95%乙醇沉淀后8000r/min离心10min,弃沉淀,上清液蒸去乙醇,浓缩至粘稠状,冷冻干燥,得到粗提取物。
1.3 菌株培养液提取物的抗氧化活性测定
1.3.1 抗氧化活性的测定 采用铁氰化钾还原力测定法,参照Yang等[9]的方法并加以改进。取1.2中所得发酵液粗提物,以超纯水溶解制成质量浓度为1.0mg/mL的样品溶液,稀释并精确移取不同质量浓度(0.2、0.4、0.6、0.8、1.0mg/mL)的样品溶液 1mL,加入磷酸缓冲液(0.2mol/L,pH6.6)2.5mL和30mmol/L的铁氰化钾溶液2.5mL,混合物50℃下水浴20min。再加入 0.6mol/L三氯乙酸 2.5mL,均匀混合后,3000r/min离心10min。吸取2.5mL上清液,加入超纯水2.5mL和6mmol/L的FeCl3溶液0.5mL,均匀混合,在700nm处测定其吸光度。同时以相应浓度的芦丁溶液作阳性对照,超纯水作空白对照。
1.3.2 抗氧化活性稳定性的测定 采用碘量法[10]来评价牛鼻栓内生真菌三裂轮簇霉菌(V.trifidumNo.48)发酵液提取物的抗氧化活性稳定性。精确称取相当于猪油质量的0.01%、0.02%、0.04%、0.06%的发酵液提取物,分别放入100mL锥形瓶中,加入少许超纯水溶解,然后分别加入一定量的猪油,搅拌均匀,同时设置空白对照和阳性对照,其中空白对照以相应体积的超纯水代替待测样品,阳性对照以0.04%的芦丁代替样品。将所有试样放入(58±1)℃的烘箱中强化保存,每隔24h搅拌一次,并测定其过氧化值。每组处理均做3个重复。过氧化值的测定:按照GB5009.37-2003测定。
1.4 菌株培养液提取物自由基清除能力测定
1.4.1 超氧阴离子自由基(O2-·)清除能力的测定采用邻苯三酚自氧化法,参照Furuno等[11]的方法并加以改进。取0.05mol/L pH8.0的Tris-HCl缓冲液4.5mL,置25℃水浴20min,加入不同质量浓度(0.2、0.4、0.6、0.8、1.0mg/mL)的样品溶液 0.1mL,再加入2.5mmol/L的邻苯三酚0.4mL,混合后25℃水浴反应4min,立即用 8mol/L的 HCl 0.1mL终止反应,在299nm处测定吸光值。0.1mL的超纯水代替样品作为对照组,以0.5mL超纯水代替样本溶液和邻苯三酚作为空白组。同时,以相应浓度的芦丁溶液作对照实验,每组均做3个重复。
清除率按下式计算:
清除率(%)=[A1-(A0-A10)]/A1×100
式中,A1为对照组的吸光值;A0为样品组及芦丁组的吸光值;A10为空白组的吸光值。
1.4.2 羟基自由基(·OH)清除能力的测定 根据Fenton反应,采用亚甲基蓝光度法,参照Strobel等[12]的方法,并加以改进。在25mL容量瓶中加入0.15mmol/L亚甲基蓝溶液2.0mL,磷酸缓冲液2.5mL(0.1mol/L p H7.0),0.01mol/L FeSO4溶液 1.0mL,不同质量浓度(0.2、0.4、0.6、0.8、1.0mg/mL)的样品和芦丁溶液各1.0mL,7.5mmol/L H2O2400μL,最后加超纯水稀释至总体积为25mL,室温放置10min后于660nm处测定吸光值,每组均设3个重复。
清除率按下式计算:
清除率(%)=[1-(A0-A2)/(A0-A1)]×100
式中,A0为初始亚甲基蓝溶液的吸光值;A1为加入Fenton试剂后吸光值;A2为加入样品及Fenton试剂反应后的吸光值。
1.4.3 清除二苯代苦味肼基自由基(DPPH·)能力的测定 参照 Molyneux[13]和曾培源等[14]的方法,并加以改进。用75%乙醇配制0.2mmol/L的DPPH溶液。在10mL的具塞试管中加入2mL DPPH溶液和2mL 不同质量浓度(0.2、0.4、0.6、0.8、1.0mg/mL)的样品溶液混合均匀,室温下暗处放置30min反应,517nm处测定吸光值。同时以相应浓度的芦丁作为对照,每组均做3个重复。清除率按下式计算:
清除率(%)=[1-(A0-A1)/A10]×100
式中,A0为2mL DPPH溶液+2mL样品溶液的吸光值;A1为2mL样品溶液+2mL乙醇的吸光值;A10为2mL DPPH溶液+2mL乙醇的吸光值。
2 结果与分析
2.1 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物的抗氧化能力
图1中铁氰化钾法测定菌株发酵液提取物的相对还原力表明,0.2~1.0mg/mL浓度范围内,牛鼻栓内生真菌三裂轮簇霉菌(V.trifidum)菌株No.48发酵液提取物的还原力随浓度的增加而逐渐增加,当浓度达到1.0mg/mL吸光度达到最大为0.922。牛鼻栓内生真菌三裂轮簇霉菌菌株No.48发酵液提取物的抗氧化活性显著地高于相应浓度的芦丁。
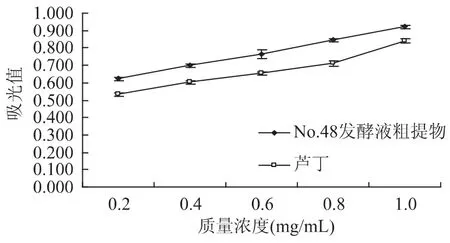
图1 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物的抗氧化能力Fig.1 Relative reducing power of the extracts of strain No.48 of endophytic Verticicladium trifidum isolated from twig of Fortunearia sinensis
2.2 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物抗氧化作用的稳定性
应用碘量法测定了不同浓度的牛鼻栓内生真菌三裂轮簇霉菌(V.trifidum)No.48发酵液提取物对猪油脂质过氧化的抑制能力在反应进行10d中的动态变化,过氧化值(POV)越低,抑制能力越强[15]。图2表明,不同浓度的供试菌发酵液提取物和芦丁最初几天的抗氧化能力差异并不大,各浓度处理的油样的过氧化值都低于空白对照,表现出一定的抗氧化活性。随着反应的进行,从第6d起,0.01%和0.02%组的过氧化值虽仍低于空白,但其过氧化值增长速度明显快,可见油脂自发氧化的自由基连锁反应已经开始较快地进行[16],抗氧化作用迅速减弱。但是,0.04%和0.06%浓度却一直保持着较稳定的抗氧化活性,至反应终了的第10d,过氧化值仍分别仅为2.01和1.54meg/kg,远低于阳性对照芦丁的12.57meq/kg。
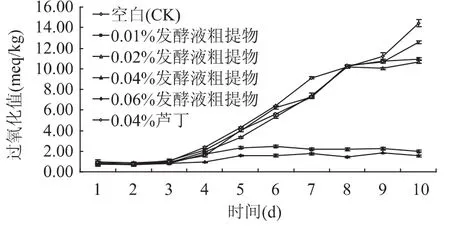
图2 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物与芦丁处理猪油的过氧化值的动态变化Fig.2 Changing trend of POV of lard coped with the extracts of strain No.48 of endophytic Verticicladium trifidum isolated from leaves of Fortunearia sinensis and rutin
2.3 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物对O-·的清除作用2
由图3可知,牛鼻栓三裂轮簇霉菌(V.trifidum)No.48发酵液提取物对邻苯三酚自氧化产生的O2-·具有较强的清除能力,且清除率随着浓度的增加而增大。浓度为1.0mg/mL时,清除率可达84.25%。除浓度0.2mg/mL时,芦丁的清除率稍大于相应浓度的发酵液提取物。在0.4~1.0mg/mL浓度范围内,其发酵液提取物对超氧阴离子自由基的清除率均高于同等浓度的芦丁。
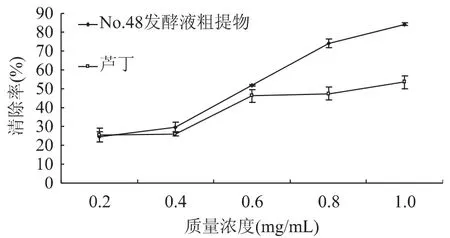
图3 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物对O2-·的清除作用Fig.3 Scavenging effect on O2-·generated by pyrogallicacid
2.4 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物对·OH的清除作用
采用亚甲基蓝光度法测定清除羟基自由基的能力,由图4可知,在0.2~1.0mg/mL浓度范围内牛鼻栓内生真菌三裂轮簇霉菌(V.trifidum)No.48发酵液提取物和芦丁清除羟基自由基的能力均随着浓度的增加而增大。尽管发酵液提取物对羟基自由基的清除作用均低于相应浓度的芦丁,但当浓度为1.0mg/mL时牛鼻栓内生真菌三裂轮簇霉菌(V.trifidum)No.48发酵液提取物对羟基自由基的清除率达到最大为74.12%,亦表现出较强的清除作用。

图4 牛鼻栓三裂轮簇霉菌发酵液提取物对Fenton反应产生·OH的清除作用Fig.4 Scavenging effect on·OH generated by the reaction of Fenton
2.5 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物对DPPH·的清除作用
DPPH·是一种很稳定有机自由基,牛鼻栓内生真菌三裂轮簇霉菌(V.trifidum)No.48发酵液提取物作用于其的结果表明,在0.2~0.8mg/mL浓度范围内,清除DPPH自由基的能力随着浓度的增加而增大,且均稍低于同等浓度的芦丁。当浓度增加到1.0mg/mL时,清除率达到最高,为84.27%,高于同等浓度的芦丁(见图5)。
3 讨论
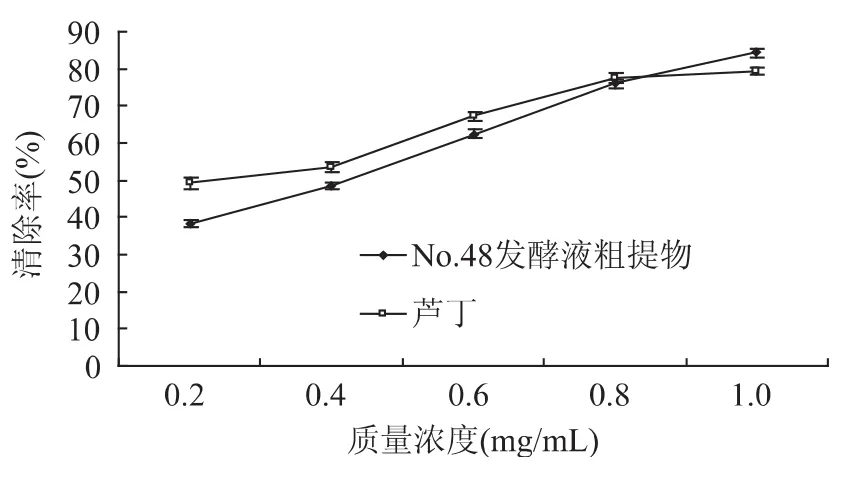
图5 牛鼻栓内生真菌三裂轮簇霉菌发酵液提取物对DPPH·的清除率Fig.5 Scavenging effect on the free radical of DPPH·
利用T-AOC试剂盒对分离自牛鼻栓各健康组织中的内生真菌发酵液提取物进行了抗氧化活性的初步测定,筛选出的三裂轮簇霉菌(Verticicladium trifidum)No.48具有相对较高的总抗氧化活性。本研究采用铁氰化钾还原力测定法和碘量法测定的相对还原力和过氧化值两个指标都显示其具有较高的抗氧化活性。此外,添加量为0.04%和0.06%浓度的发酵液提取物处理猪油数日,均具有较低的过氧化值,可以说明在1~10d范围内,该菌株发酵液提取物能够保持良好的抗氧化活性比较稳定。这也暗示其中可能含有供氢能力较强的物质,能有效地抑制油脂自发氧化的自由基连锁反应的进行。
相对还原力和过氧化值两个指标均显示牛鼻栓内生真菌三裂轮簇霉菌(V.trifidum)No.48发酵产物的总抗氧化活力高于芦丁,而且从清除超氧阴离子自由基(O2-·)、羟自由基(·OH)和二苯基苦基苯肼自由基(DPPH·)的情况来看,该菌发酵液提取物对O2-·和DPPH·均具有较强的清除作用,清除能力优于芦丁,1.0mg/mL浓度下,清除率分别达到84.25%和84.27%;虽对·OH的清除作用弱于芦丁,但浓度为1.0mg/mL时,清除率亦可达到74.12%。由此,可以认为该菌所表现出来的显著高于芦丁的总抗氧化活性是由对多种自由基清除的综合作用决定的,而不是由于清除其中一种自由基主导了抗氧化活性,其作用机理较为复杂。
三裂轮簇霉菌(V.trifidum)此前作为腐生真菌在国内外被报道[17-18],主要分布在土壤、植物残体和一些食草动物粪便等基物中。但是,众多植物内生真菌多样性研究表明[19-20],大量的腐生性真菌是植物内生真菌的重要组成部分,而且具有重要的生态价值[21]。因此,三裂轮簇霉菌V.trifidum作为内生真菌从牛鼻栓植株的健康枝条中被分离获得,暗示着该菌能够以非腐生的方式存在,并且植物活体内的轮簇霉菌可能具有不同于腐生轮簇霉菌的生物活性。牛鼻栓是牛鼻栓苷和岩白菜素的一种药源植物,而且岩白菜素具有一定的抗氧化活性[22],基于“植物内生真菌一般可以产生与宿主植物相同或相似的化学成分”的观点[8],对本研究中具有较高抗氧化活性的牛鼻栓内生真菌三裂轮簇霉菌V.trifidum菌株No.48的深入研究,有望实现其用于开发天然抗氧化物质的潜在价值。
4 结论
本文通过对牛鼻栓内生三裂轮簇霉菌发酵液提取物的相对还原力、抗脂质过氧化稳定性以及自由基清除能力的测定,可以得出如下结论:牛鼻栓内生真菌三裂轮簇霉菌株No.48表现出的这种较高的抗氧化能力及良好的稳定性且优于阳性对照芦丁,可以认为是对O-2·、·OH和DPPH· 等多种自由基清除的综合作用决定的,而不是由于清除其中一种自由基主导了抗氧化活性。牛鼻栓内生三裂轮簇霉菌表现出良好的抗氧化活性,有望作为具有天然抗氧化活性的新的微生物资源进行深入研发。
[1]Finkel T,Holbrook N J.Oxidants,oxidative stress and the biology of ageing[J].Nature,2000,408:239-247.
[2]Ilkay E O,Betvl S Y,Altun M L,et al.Radical quenching activity,ferric-reducing antioxidant power and ferrous ionchelating capacity of 16Ballotaspecies and their total phenol and flavonoid contents[J].Journal of Medicinal Food,2010,13(6):1537-1543.
[3]Zhang Y P,Nan Z B.Germination and seedling antioxidative enzymes of endophyte-infected populations ofElymus dahuricusunder osmotic stress[J].Seed Science and Technology,2010,38(2):522-527.
[4]Strobel G,Daisy B.Bioprospecting for microbial endophytes and their natural products[J].Microbiology and Molecular Biology Review,2003,67(4):491-502.
[5]Sadananda T S,Nirupama R,Chaithra K,et al.Antimicrobial and antioxidant activities of endophytes fromTabebuia argenteaand identification of anticancer agent(lapachol)[J].Journal of Medicinal Plant Research,2011,5(16):3643-3652.
[6]Zhao J T,Fu Y J,Luo M,et al.Endophytic Fungi from Pigeon Pea [Cajanuscajan(L.)Millsp.] Produce Antioxidant Cajaninstilbene Acid[J].Journal of Agricultural and Food Chemistry,2012,60(17):4314-4319.
[7]国家药典委员会编.中华人民共和国药典2010年版(一部)[M].北京:中国医药科技出版社,2010:384.
[8]Stierle A,Strobel G,Stierle D.Taxol and taxane production byTaxomyces andreanae,an endophytic fungus of Pacific yew[J].Science,1993,260(5105):214-216.
[9]Yang J X,Guo J,Yuan J F.In vitro antioxidant properties of rutin[J].LWT-Food Science and Technology,2008,41(6):1060-1066.
[10]Okada Y,Okajima H,Konishi H,et al.Antioxidant effect of naturally occurring furan fatty acids on oxidation of linoleic acid in aqueous dispersion[J].Journal of the American Oil Chemists’Society,1990,67(11):858-862.
[11]Furuno K,Akasako T,Sugihara N.The contribution of the pyrogallol moiety to the superoxide radical scavenging activity of flavonoids[J].Biological and Pharmaceutical Bulletin,2002,25(1):19-23.
[12]Strobel G,Ford E,Worapong J,et al.Isopestacin,an isobenzofuranone fromPestalotiopsismicrosporapossessing antifungal and antioxidant activities[J].Phytochemistry,2002,60(2):179-183.
[13] Molyneux P.The use of the stable free radical diphenylpicrylhydrazyl(DPPH)for estimating antioxidant activity[J].Songklanakarin Journal of Science and Technology,2004,26(2):211-219.
[14]曾培源,林雄浩,蔡巧燕,等.DPPH法测定粗疣合叶苔内生真菌的抗氧化活性[J].福建中医药大学学报,2010,20(5):41-43.
[15]Kim K J,Kim D H,Hong J E,et al.Development of 3-Aminopropyl-DL-α-tocopherylphosphate as a potent antioxidant:focus on linoleic acid autoxidation[J].Journal of the American Oil Chemists’Society,2001,78(4):441-442.
[16]万素英,赵亚军,李琳,等.食品抗氧化剂[M].北京:中国轻工业出版社,1998:10-13.
[17]Raila A,Luqauskas A,Kemzūraite A,et al.Different drying technologies and alternation of mycobiots in the raw material ofHyssopus officinalisL[J].Annals of Agricultural and Environmental Medicine,2009,16(1):93-101.
[18]王素平,张猛.针叶树枯叶丝孢菌研究I.两个中国新记录属和3 个中国新记录种[J].菌物学报,2010,29(4):592-594.
[19]Aly A H,Debbab A,Proksch P.Fungal endophytes:unique plant inhabitants with great promises[J].Applied Microbiology Biotechnology,2011,90(6):1829-1845.
[20]Orlandelli R C,Alberto R N,Rubin Filho CJ,et al.Diversity of endophytic fungal community associated withPiper hispidum(Piperaceae)leaves[J].Genetics and Molecular Research,2012,11(2):1575-1585.
[21]Sun X,Guo L D,Hyde K D.Community composition of endophytic fungi inAcer truncatumand their role in decomposition[J].Fungal Diversity,2011,47(1):85-95.
[22]Nazir N,Koul S,Qurishi M A,et al.Evaluation of antioxidant and antimicrobial activities of bergenin and its derivatives obtained by chemoenzymatic synthesis[J].European Journal of Medicinal Chemistry,2011,46(6):2415-2420.

