Pt/Ni—氧化石墨烯修饰电极用于莱克多巴胺测定*
牛司朋,冯亚娟,罗 蕾,杨云慧
(云南师范大学化学化工学院,云南昆明650500)
0 引言
苯乙醇胺类β2肾上腺素兴奋剂,尤其是莱克多巴胺,应用于动物饲养能够显著提高动物酮体率,增加瘦肉比例,故俗称为“瘦肉精”。但很容易残留于动物内脏和肌肉中,通过食物链富集到人体,会对人身健康产生极大的危害。在我国属于严禁在动物养殖过程中添加的药物[1]。
目前,常用检测莱克多巴胺的方法有:光谱分析法[2]、液相色谱—质谱法[3]、高效液相色谱法[4]、毛细管电泳法[5]、酶联免疫吸附法(ELISA)[6]、化学发光免疫分析法(CLIA)[7]、胶体金免疫层析法[8]、电化学传感器法[9]。其中,由于电化学传感器法对物质检测具有更高的响应性和灵敏度而被广泛关注。
本文设计了一种简单的电化学传感器来检测莱克多巴胺。通过Hummers WS和Offeman R E等人[10]的方法合成氧化石墨烯作为基底材料,用以增大玻碳电极的比表面积[11],然后在氧化石墨烯修饰过的电极表面沉积Pt/Ni二元合金纳米颗粒[12,13]制得电化学传感器,并将其用于莱克多巴胺定量检测。
1 实验
1.1 氧化石墨烯制备
将一定量石墨与NaCl一起研磨,然后溶掉NaCl。将石墨粉加在浓硫酸中搅拌一定时间。控制温度,加入一定量KMnO4并升温搅拌。随后加入一定量的蒸馏水于105℃下搅拌,最后加入一定量的H2O2溶液后结束整个反应。用5%的HCl和蒸馏水反复清洗纯化后制得氧化石墨。
取一定量氧化石墨超声分散在水中,使氧化石墨片层剥落,获得棕色的分散溶液,然后再离心40 min,上层分散液即为氧化石墨烯(GO)的分散溶液。
1.2 修饰电极的制备
将玻碳电极(φ=3 mm)在金相砂纸上打磨至电极表面成光滑的镜面,用α氧化铝抛光粉抛光。依次浸入稀硝酸、乙醇、二次蒸馏水中各超声洗涤5 min,晾干。
在预处理好的玻碳电极上滴涂5μL氧化石墨烯溶液,过夜备用。依次取4mL 0.2 mol/L的NaSO4,4mL 50 mmol/L的NiSO4和2 mL 0.5 mmol/L的HPtCl4·4H2O混合于烧杯中,将GO/GCE浸于溶液内,在-0.8 V恒电位沉积300 s,即制得Pt/Ni二元合金—氧化石墨烯纳米复合材料修饰的电极。用二次蒸馏水冲洗电极,不用时置于0.1 mol/L的HClO4溶液上方保存。
1.3 检测方法
将该传感器置于10mL 0.1mol/L的HClO4支持电解液中,在0~1.0 V电位范围下测得空白差分脉冲伏安(DPV)曲线。分别加入不同浓度的莱克多巴胺,搅拌并富集72 s。于0~1.0 V电位范围内测定莱克多巴胺的DPV曲线,扣除空白得到响应峰电流值。
2 结果与讨论
2.1 氧化石墨烯形貌表征
用高倍透射电镜观察了氧化石墨烯的微观形貌特征。由高倍透射电镜可看到氧化石墨烯呈薄片结构,如图1。

图1 氧化石墨烯的高倍透射电镜图Fig 1 High power transmission electron microscope images of graphene oxide
2.2 Pt/Ni二元合金—氧化石墨烯纳米复合物的能谱分析
图2为电极表面修饰的Pt/Ni二元金属—氧化石墨烯复合物的能谱图,能谱分析证实了Pt和Ni分布在复合膜中。

图2 电极表面修饰的Pt/Ni一氧化石墨烯能谱分析Fig 2 EDS analysis of the Pt/Ni-graphene oxide modified on the surface of electrode
2.3 测试底液的选择
考察了7.5×10-5mol/L的莱克多巴胺在0.1 mol/L的PBS和HClO42种底液中的响应。如图3,表明在HClO4底液中响应良好,有较好的峰形,而在PBS底液中几乎没有峰电流响应。因此,选择0.1 mol/L的HClO4作为该电化学传感器测试莱克多巴胺的底液。

图3 莱克多巴胺在两种不同溶液中的DPV曲线Fig 3 DPV curve of ractopamine in two types of solutions
2.4 Pt/Ni的协同作用
考察了在电极表面修饰氧化石墨烯后,沉积金属对响应电流的影响如图4。从图中可看出:同时沉积Pt/Ni后的响应优于单独沉积Pt或Ni时的催化效果,表明Pt/Ni对莱克多巴胺具有协同催化作用。

图4 Pt,Ni对电极响应的协同作用Fig 4 Synergistic effect of Pt,Ni on the response of electrode
2.5 修饰电极的电化学行为
考察了电极在含有不同浓度的莱克多巴胺的底液中的循环伏安(CV)行为如图5。该电极在0.2~0.6 V电位范围内对莱克多巴胺具有良好的电催化响应。

图5 不同浓度莱克多巴胺在Pt/Ni-GO/GC电极上的CV响应曲线Fig 5 CV response curves of different concentration of ractopamine on Pt/Ni-GO/GC electrode
改变不同的扫描速度,考察了该电极在含有4.0×10-5mol/L的莱克多巴胺支持底液中的CV行为,如图6。从内置图可以看出:氧化还原电流与扫描速度的平方根(v0.5)呈线性相关,说明此电流为扩散控制电流。
2.6 实验条件的优化
2.6.1 Pt/Ni二元金属沉积时间对响应电流的影响
考察了沉积时间对传感器响应电流的影响,结果见图7。沉积为300 s的响应电流最高,本实验选择沉积时间300 s。
2.6.2 富集时间对响应电流的影响
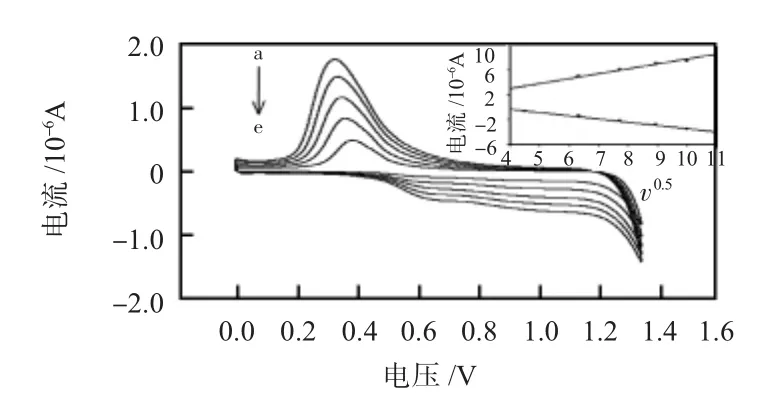
图6 扫描速度对电化学传感器响应的影响(从 a~ e:扫描速度分别是100,80,60,40,20 mV/s),内置图为氧化还原电流与扫描速度的平方根的线形曲线Fig 6 Effect of scanning rate on response of the electrochemical sensor(from a to e:scanning speed is 100,80,60,40,20mV/s),The inset diagram shows linear curve of oxidation-reduction current vs square root of scanning speed

图7 沉积时间对响应电流的影响Fig 7 Effect of depositing time on response current
考察了样品在传感器上的富集时间对响应电流的影响。结果如图8,由图得出最佳富集时间是72 s。

图8 富集时间对响应电流的影响Fig 8 Effect of concentration time on current response
2.7 电化学传感器的响应性能
在最优实验条件下,逐次测定不同浓度梯度的莱克多巴胺得到校准曲线,如图9。
测定莱克多巴胺的线性范围是1.98×10-7~2.67×10-4mol/L,检测下限为6.66×10-8mol/L。其中,线性回归方程为:i=2.9869 lg C+1.3466;相关系数为0.9949。
2.8 传感器的重复性
在0.1 mol/L HClO4缓冲溶液中考察了该传感器的重复性。用同一传感器连续3次测定同一浓度的莱克多巴胺,其峰值电流的相对标准偏差为0.31%。说明传感器重复性较好。
2.9 抗干扰性

图9 传感器在不同莱克多巴胺浓度下的校正曲线Fig 9 Calibration curves of the sensor in different ractopamine concentration
为了考察传感器的抗干扰能力,在最优化的测定条件下,在含有0.1μmol/L莱克多巴胺的HClO4底液中,分别加入不同浓度的葡萄糖、丙氨酸、甘氨酸、抗坏血酸等4种可能的干扰物质,结果见表1。表明以上物质对该电化学传感器的检测结果都没有明显影响,说明此传感器具有优良的抗干扰性能。

表1 电化学传感器的干扰测试Tab 1 Interference test of electro chemical sensor
2.10 样品分析
为了考察该传感器的实用性,在猪尿中加入莱克多巴胺标准品进行回收测试实验,结果见表2。说明该传感器可用于莱克多巴胺的检测。

表2 猪尿样品中莱克多巴胺回收测试Tab 2 Recovery testing of ractopamine in pig urine sample
3 结束语
将氧化石墨烯修饰到电极表面用以增加金属Pt,Ni的沉积量,而沉积Pt,Ni对莱克多巴胺具有良好的协同催化效果,可以用作莱克多巴胺的催化氧化材料构建电化学传感器。通过优化条件,提高了Pt/Ni二元金属合金/GO/GC电极的灵敏度和响应性能,降低了干扰物质的影响。实验证明:该电极具有较宽的检测线性范围和较低的检测下限,为检测莱克多巴胺提供了一种灵敏稳定的方法。
[1]张 华.瘦肉精的危害及检测方法[J].贵州农业科学,2004,32(1):83-84.
[2]Zhang Q L,Ni Y N,Kokot S.Molecular spectroscopic studies on the interaction between ractopamine and bovine serum albumin[J].JPharm Biomed Anal,2010,52(2):280-288.
[3]Williams L D,Churchwell M L,Doerge D R.Multiresidue confirmation ofβ-agonists in bovine retina and liver using LC-ES/MS/MS[J].J Chromatogr B,2004,813(1-2):35-45.
[4]Turberg M P,Rodewald JM,Coleman M R.Determination of ractopamine in monkey plasma and swine serum by high-performance liquid chromatography with electrochemical detection[J].J Chromatogr B,1996,675(2):279-285.
[5]马 健,张明洲,李 晓,等.高效毛细管电泳法用于猪尿中莱克多巴胺含量的检测[J].浙江农业学报,2006,18(5):333-336.
[6]Li S,He PL.An electrochemical immunosensor based on agarose hydrogel films for rapid determination of ractopamine[J].Electrochem Commun,2007,9(4):657-662.
[7]Shelver W L,Smith D J.Immunoaffinity column as sample cleanup method for determination of the beta-adrenergic agonist ractopamine and its metabolites[J].J AOAC Int,2002,85(6):1302-1307.
[8]张志键,王晓菲,戴绚丽.用胶体金免疫层析法检测饲料中莱克多巴胺含量[J].安徽农学通报,2007,13(10):15-16.
[9]Lu X,Zheng H.Detection of ractopamine residues in pork by surface plasmon resonance-based biosensor inhibition immunoassay[J].Food Chem,2012,130(4):1061-1065.
[10]Hummers WS,Offeman R E.Preparation of graphitic oxide[J].J Am Chem Soc,1958,80(6):1339-1339.
[11]Tapas K,Saswata B,Partha K.Recent advances in graphenebased biosensors[J].Biosens Bioelectron,2011,26(12):4637-4648.
[12]Gao H C,Xiao F,Ching CB,et al.One-step electrochemical synthesis of PtNi nanoparticle-graphene nanocomposites for nonenzymatic amperometric glucose detection[J].ACSAppl Mater Interfaces,2011,3(8):3049-3057.
[13]Du C Y,Chen M,Wang W G,et al.Nanoporous PdNi alloy nanowires as highly active catalysts for the electro-oxidation of formic acid[J].ACSAppl Mater Interfaces,2011,3(2):105-109.

