米非司酮对2型糖尿病大鼠糖脂代谢的影响
周 珺,贾正平,2,邱建国,张泉龙,保 芸,2,张汝学,2
(1.兰州军区兰州总医院全军高原环境损伤防治重点实验室,国家中医药管理局临床中药学重点学科,甘肃兰州 730050;2.兰州大学,甘肃兰州 730000)
糖皮质激素(glucocorticoids,GC)作为降糖激素的反调激素,它对于维持葡萄糖稳态发挥着巨大的作用[1-2],研究表明[2],GC活性升高与胰岛素抵抗密切相关,GC与其受体结合后,发挥着促进肝糖异生、葡萄糖转运系统异常等多方面作用。本文采用高脂饲料加小剂量STZ联合诱导的大鼠糖尿病模型模拟人类临床2型糖尿病,研究HPA轴的功能变化及HPA轴调节剂,即糖皮质激素受体 (glucocorticoids receptor,GR)拮抗剂—米非司酮对HPA轴的调节作用,研究其对糖尿病大鼠血糖血脂代谢的影响。
1 材料、试剂及器材
1.1 实验动物 Wistar大鼠,♀,清洁级,体质量(200±20)g,由兰州大学医学院动物实验中心提供,生产许可证号:SCXK(甘)2009-0004,动物合格证号:No.0000789,自由摄食进水,室温19℃ ~24℃。
1.2 主要试剂和仪器 链脲佐菌素(STZ,Sigma公司);米非司酮(mifepristone,MIF,北京紫竹药业);血糖、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)检测试剂盒(四川迈克科技有限责任公司);胰岛素放射免疫分析测定试剂盒(北京华英生物技术研究所);CRH、ACTH、CORT-ELISA测定试剂盒(R&D公司)。生化分析仪(Vitalab ISP-21,Vital Scientific公司);电子天平(BP210S,赛多利斯有限公司);紫外可见分光光度计(HP-8453,美国惠普公司);离心机(IEC MICROMAX,Thermo Electron公司);酶标仪(Multiscan MK3,Thermo Electron公司)。
2 实验方法
2.1 2 型糖尿病大鼠模型的建立、分组及给药 大鼠适应性饲养3 d后,以高脂饲料饲养2个月,大鼠禁食16 h后给与STZ(30 mg·kg-1,i.p.)诱发2型糖尿病模型。将血糖值≥11.1 mmol·L-1大鼠纳入实验,分为糖尿病组、MIF-L组(10 mg·kg-1·d-1)、MIF-H 组(25 mg·kg-1·d-1)。连续灌胃(i.g.)给药5周后,禁食6 h后断头处死并收集躯干血,4℃ 4 000 r·min-1离心10 min,血浆-20℃保存待用。
2.2 体重、血糖 每周测定一次空腹体重和血糖,测血糖前大鼠禁食不禁水6-7 h,乙醚麻醉后采血;实验结束时断头处死大鼠,收集所有血液。0.1 mol·L-1肝素钠抗凝,立即离心并分离血浆。用葡萄糖氧化酶法测定血浆葡萄糖含量。结果以mmol·L-1表示。
2.3 血脂的测定 血浆室温解冻后测定血脂水平,TG用GPO-PAP法测定,TC用 COD-CE-PAP法测定,HDL-C用PTA-Mg2+沉淀法测定,LDL-C用聚乙烯硫酸沉淀法测定。结果以mmol·L-1表示。
2.4 血浆中激素水平的测定 血浆室温放置解冻后,测定其中胰岛素、CRH、ACTH及皮质酮水平。胰岛素采用放免法测定,CRH、ACTH及皮质酮用ELISA测定,结果以mIU·L-1,ng·L-1,ng·L-1,μg·L-1表示。
2.5 肝糖原含量测定(蒽酮—硫酸法) 采用蒽酮-硫酸比色法测定肝糖原含量。结果以mg·g-1表示。
2.6 统计学处理 实验数据用SPSS 11.5软件处理,结果用±s表示,组间差异用t检验。
3 实验结果
3.1 大鼠体重变化 与正常组相比,模型组大鼠体重明显降低(P<0.01),MIF-L组体重明显降低(P<0.05),MIF-H组大鼠体重无明显下降;与模型组相比,第4周时,MIF-H组体重明显升高(P<0.01)。
Tab 1Effects of mifepristone on weight(g,±s)

Tab 1Effects of mifepristone on weight(g,±s)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
group n dose/mg·kg-1·d-10 week 1 week 2 week 3 week 4 week 5 week Control9 0 258.72±25.60 261.16±22.83 268.22±22.55 273.44±24.58 273.30±21.43 273.30±21.43 Model 8 0 234.61±28.59 219.65±31.76** 234.63±26.73* 231.88±30.86* 224.38±14.00** 220.13±17.8**MIF-L 9 10 235.33±22.30 220.56±21.95**236.66±25.23* 237.56±26.21* 238.96±23.21* 240.07±16.32*MIF-H 8 25 236.52±23.36 242.24±22.69 244.63±24.25 252.50±23.89 262.86±26.49##269.07±22.26##
3.2 米非司酮对血糖水平的影响 Tab 2结果显示:相比较正常对照组,模型组和MIF-L、MIF-H各组大鼠血糖明显升高,且均具有统计学意义(P<0.01),相比较模型组,给药前各组血糖无明显差异,造模后,模型组血糖逐渐升高,MIF给药组空腹血糖低于模型组,MIF-H组在给药第3周即可达到明显降糖效果(P<0.05)。
3.3 米非司酮对血脂水平的影响 与正常对照组相比,模型组大鼠 TC(mmol·L-1)(3.88±1.35,P<0.05)、TG、LDL-C含量升高,HDL-C含量下降,MIF-L组TC含量明显升高(3.79±1.46,P<0.05);相比较糖尿病模型组,MIF可明显降低LDL-C含量(1.79±0.31,P<0.01),有降低TC、TG含量,升高HDL-C含量趋势。
Tab 2Effects of mifepristone on fasting glucose level(mmol·L-1,±s)
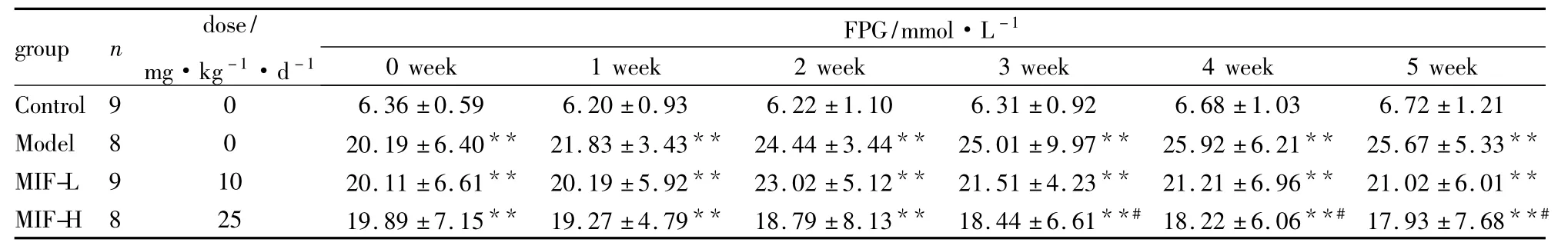
Tab 2Effects of mifepristone on fasting glucose level(mmol·L-1,±s)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
group n dose/mg·kg-1·d-1 FPG/mmol·L -1 0 week 1 week 2 week 3 week 4 week 5 week Control9 0 6.36±0.59 6.20±0.93 6.22±1.10 6.31±0.92 6.68±1.03 6.72±1.21 Model 8 0 20.19±6.40** 21.83±3.43** 24.44±3.44** 25.01±9.97** 25.92±6.21** 25.67±5.33**MIF-L 9 10 20.11±6.61** 20.19±5.92** 23.02±5.12** 21.51±4.23** 21.21±6.96** 21.02±6.01**MIF-H 8 25 19.89±7.15** 19.27±4.79** 18.79±8.13** 18.44±6.61**# 18.22±6.06**# 17.93±7.68**#
3.4 米非司酮对激素水平的影响 与正常组相比,模型组血浆CORT及CRH水平和胰岛素水平增高,MIF-H组使CORT、ACTH、CRH明显高于正常(P<0.05),MIF-L和 MIFH均可使胰岛素高于正常水平,但差异无显著性(P>0.05);与模型组相比,MIF-H可明显升高ACTH水平(P<0.01)。
Tab 3Effects of mifepristone on hormones(±s)

*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model
3.5 米非司酮对大鼠肝糖原的影响 相比较正常对照组(4.89±4.35)mg·g-1,模型组(4.42 ±3.48)mg·g-1和MIF-L组(4.55±3.78)mg·g-1大鼠肝糖原含量有所下降;相比较模型组,MIF-H(5.21±4.33)mg·g-1能增加肝糖原含量。
4 讨论
本实验结果证实,糖尿病大鼠体重降低,血糖升高,血脂紊乱,HPA轴激素水平增加,胰岛素水平升高,肝糖原含量减少。这与相关研究报道一致[3]。下丘脑-垂体-肾上腺(HPA)轴分别在下丘脑、垂体和肾上腺水平产生三类激素:CRH、ACTH和GC(大鼠体内为皮质酮(CORT)),GC又反馈性的调节CRH和ACTH的合成分泌。本实验糖尿病大鼠CRH和CORT水平升高,说明其负反馈调节已消失或减弱,HPA轴功能紊乱。
近年来,国内外大量研究发现,2型糖尿病的发生与HPA轴功能紊乱有关,GC直接参与糖代谢调节[4]。长期慢性应激使HPA轴活性增高,GC生成释放增加,其与受体结合后发挥相应的生物学效应,包括诱导胰岛β细胞功能障碍[5],拮抗胰岛素的降糖作用,削弱胰岛素对机体各方面的作用,促进脂肪分解、糖原异生,减少细胞对糖的摄取,使机体血糖升高,造成或加重组织胰岛素抵抗,使糖代谢紊乱难以控制等[3,6-7]。
MIF是一种GR拮抗剂,它可抑制GC与其受体结合,使得GC无法发挥生物学效应。机体内游离的GC与GR结合后,可介导机体内从抗炎反应到血脂、蛋白、核酸代谢等一系列生物学效应。同时,GR作为参与调节糖代谢的激素受体,与进入体内循环的配体结合并启动催化肝糖生成的相关酶的基因转录而发挥作用[8]。利用GR拮抗剂,一方面抑制过量的GC发挥作用,另一方面可抑制GR的过量表达,削弱其调控酶基因的作用,抑制糖异生的同时削弱胰岛素抵抗,降低血糖水平。本实验证实,低剂量的MIF对2型糖尿病大鼠糖脂代谢影响较弱,而MIF-H组可明显缓解糖尿病大鼠体重的明显下降,明显降低糖尿病大鼠的高血糖,说明MIF可通过拮抗GC的作用从而达到改善2型糖尿病的目的。但是长期使用非选择性GR拮抗剂,会使得糖皮质激素受体表达减少,导致HPA轴活性更加亢进,此方面有待进一步深入研究。
[1]Gagliardi L,Le Jeunne C.Corticosteroids and diabetes mellitus[J].Presse Med,2012,41(4):393-9.
[2]Beaudry J L,Riddell M C.Effects of glucocorticoids and exercise on pancreatic β cell function and diabetes development[J].Diabetes Metab Res Rev,2012,28(7):560-73.
[3]Taylor A I,Frizzell N,McKillop A M,et al.Effect of RU486 on hepatic and adipocyte gene expression improves diabetes control in obesity-type 2 diabetes[J].Horm Metab Res,2009,41(12):899-904.
[4]努尔买买提·艾买提,阿迪力·阿布力米提,哈木拉提 吾甫尔.神经内分泌免疫网络与复杂性疾病相关性研究进展[J].新疆医科大学学报,2006,29(10):921-5.
[4]NURMMAT Amat,ADILJAN·Abilmit,HAMYRAT Uper.Research progression of the relationship between neuroendocring-immune network and complicate diseases[J].J Xinjiang Med Univer,2006,29(10):921-5.
[5]Linssen M M,van Raalte D H,Toonen E J,et al.Prednisoloneinduced beta cell dysfunction is associated with impaired endoplasmic reticulum homeostasis in INS-1E cells[J].Cell Signal,2011,23(11):1708-15.
[6]Bradley Zinker,Amanda Mika,Phong Nguyen,et al.Liver-selective glucocorticoid receptor antagonism decreases glucose production and increases glucose disposal,ameliorating insulin resistance[J].Metabol Clin Exper,2007,(56):380-7.
[7]Prpic'-Križevac I,Canecki-Varžic'S,Bilic'-C'urc'ic'I.Hyperactivity of the hypothalamic-pituitary-adrenal axis in patients with type 2 diabetes and relations with insulin resistance and chronic complications[J].Wien Klin Wochenschr,2012,124(11-12):403-11.
[8]Yoon J C,Puigserver P,Chen G,et al.Control of hepatic gluconeogenesis through the transcriptional coactivator PGC-1[J].Nature,2001,413(6852):125-6.