肌肽对小鼠闭合性脑损伤的保护作用
裴旭颖,倪康欣,周 优,应 琨,张翔南,厉旭云,陆 源,陈 忠
(1.浙江大学医学院,浙江杭州 310058;2.浙江大学药学院药理教研室,卫生部医学神经生物学重点实验室,浙江杭州 310058;3.浙江大学医学院生理学教研室,浙江杭州 310058)
颅脑外伤已成为发达国家青少年伤病致死的首位病因,近些年随着我国国民经济和交通的快速发展,我国颅脑外伤发生率也逐年增加。数据表明,脑外伤的发生率约为1.07‰,其中,约60%的脑外伤由车祸造成,20% ~30%由坠落造成,约10%由殴打造成[1]。闭合性脑损伤可导致神经系统损伤,造成认知、情感、行为能力的下降,甚至死亡。目前尚无特异的延缓脑损伤患者神经功能损害的药物。因此,加强对脑损伤治疗的研究,积极研究和开发有效的脑保护药物,寻找相关的药物治疗靶点,具有重要的现实意义。
肌肽是一种由β-丙氨酸和L-组氨酸组成的水溶性二肽[2],能与大多数自由基相互作用,从而调节活性氧的含量并清除自由基。肌肽对缺血性脑损伤的保护作用已得到相关研究的证实,其机制可能与清除自由基、抗氧化以及抗细胞凋亡有关[3-4],研究提示肌肽具有重要的神经保护作用,可能是一种潜在的神经保护剂。颅脑外伤诱导的脑损伤与缺血性脑损伤在病理机制上具有许多相似之处,如神经兴奋性毒性、炎性损伤等。另有研究表明,颅脑损伤引起的局部脑血供障碍本身就是一种局灶性的缺血性损伤。本研究通过建立实验性小鼠闭合性脑损伤模型,探索肌肽的潜在保护作用,为临床相关的药物研究提供实验依据。
1 材料和方法
1.1 实验动物与分组 90只雄性ICR小鼠,体重30 g左右(由浙江大学动物实验中心提供)。遵照国家实验动物饲养和使用指南,动物饲养温度控制在(22±1)℃,12 h明暗循环,自由饮食、饮水。将小鼠随机分为4组:假手术组(n=10),溶剂对照组(n=30),250 mg/kg肌肽组(n=30)和500 mg/kg肌肽组(n=20)。
1.2 药品和仪器 肌肽(购自Sigma公司),10%水合氯醛、4%多聚甲醛;闭合性脑损伤建模装置,包括支架、带刻度垂直导杆、下落击锤(333 g)、可移动平台等;神经受损程度评分(neurological severity score,NSS)装置,包括底部开口的圆形无盖容器,三根宽度分别为1 cm、2 cm、3 cm的木杆,直径0.7 cm的悬杆等;脑组织切片、HE染色设备,光学显微镜等。
1.3 小鼠闭合性脑损伤模型制作 模型制作参考Michael[5]等的自由落体撞击伤模型,将小鼠经10%水合氯醛(400 mg/kg)腹腔麻醉后,用PVP碘消毒头皮,沿头皮正中线从耳后到眼部将皮肤剪开,分离骨膜,在冠状缝与人字缝连线中点向右旁开3~5 mm处标记撞击点,使撞击杆从3 cm高处自由下落致小鼠闭合性脑损伤。术后立即给予小鼠医用氧气(20%O2+5%CO2)2 min以防止呼吸抑制,缝合头皮后放于25℃保温箱中复苏。假手术组小鼠麻醉后按相同方法剪开头皮,但不做撞击,直接缝合头皮。
1.4 给药方案 从术前30 min开始,肌肽组按照10 ml/kg给药,分别腹腔注射肌肽250 mg/kg 和500 mg/kg[6],溶剂对照组及假手术组腹腔注射等量生理盐水,以后每日同一时间按相同方法给药。
1.5 行为学评分 参照Michael[5]等的NSS标准(表1),在实验的第1天~第7天的相同时间对各组小鼠进行NSS评价。
1.6 组织病理学观察 实验结束后于第7天麻醉处死小鼠,分别取小鼠脑组织并用4%多聚甲醛固定72 h,制成石蜡切片并进行HE染色,光学显微镜下观察脑组织变化。
1.7 统计学处理 用SPSS 17.0软件分析实验数据。小鼠体重用均数±标准差)表示,以单因素方差分析(One-way ANOVA)进行多组间差异的比较;小鼠生存率用χ2检验;NSS数据呈偏态分布,用中位数和四分位数(Median,Quartiles)表示,采用两独立样本非参数检验。P<0.05认为差异有统计学意义。

表1 小鼠神经受损程度评分Table 1 Neurological severity score for mice
2 结果
本研究在统计时剔除因麻醉过量死亡的小鼠(其中,假手术组3只、溶剂对照组1只、250 mg/kg肌肽组2只和500 mg/kg肌肽组1只)和闭合性脑损伤造模失败的小鼠(其中,溶剂对照组3只、250 mg/kg肌肽组6只和500 mg/kg肌肽组2只)。
2.1 存活率分析 假手术组小鼠闭合性脑损伤后第1天~第7天均无死亡;溶剂对照组术后第1天存活率为57.7%(15/26),术后第7天最终存活率为50%(13/26)。250 mg/kg肌肽组术后第1天的存活率为68.2%(15/22),术后第2天~第7天无新增死亡例数,最终存活率与溶剂对照组比较差异无显著性;500 mg/kg肌肽组术后第1天的存活率为82.4%(14/17),术后第2天~第7天也无新增死亡例数,其最终存活率较溶剂对照组高,经χ2检验差异有显著性(P <0.05)。
2.2 损伤后7 d内小鼠体重的变化 假手术组、溶剂对照组及肌肽给药组小鼠体重在术后第1天均降低,且溶剂对照组下降最多,假手术组下降最少。术后3d内各组小鼠体重呈现波动性下降趋势;至术后第4天,假手术组、肌肽组小鼠体重逐渐恢复,而溶剂对照组体重恢复落后于其他3组,至第5天体重才逐渐恢复,但始终为4组小鼠中最低。术后第1天~第7天,500 mg/kg肌肽组小鼠体重均高于250 mg/kg肌肽组和溶剂对照组;250 mg/kg肌肽组体重均高于溶剂对照组,但3组间差异无统计学意义(P >0.05,图1)。
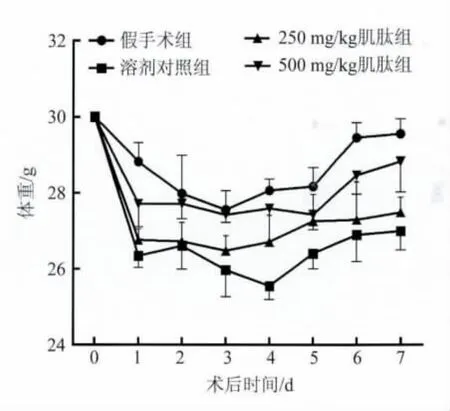
图1 肌肽对小鼠闭合性脑损伤7 d内体重变化的影响Fig.1 Effects of carcinose on body weight over 7 days after closed head injury in mice
2.3 肌肽对闭合性脑损伤小鼠行为学的影响
溶剂对照组第1天~第7天的NSS均显著高于假手术组(P<0.05),提示自由落体造模成功。与溶剂对照组比,250 mg/kg肌肽组术后第5天~第7天可显著降低小鼠NSS(P<0.05),500 mg/kg肌肽组术后第1天及第4天~第7天可显著降低NSS(P<0.05,表2)。
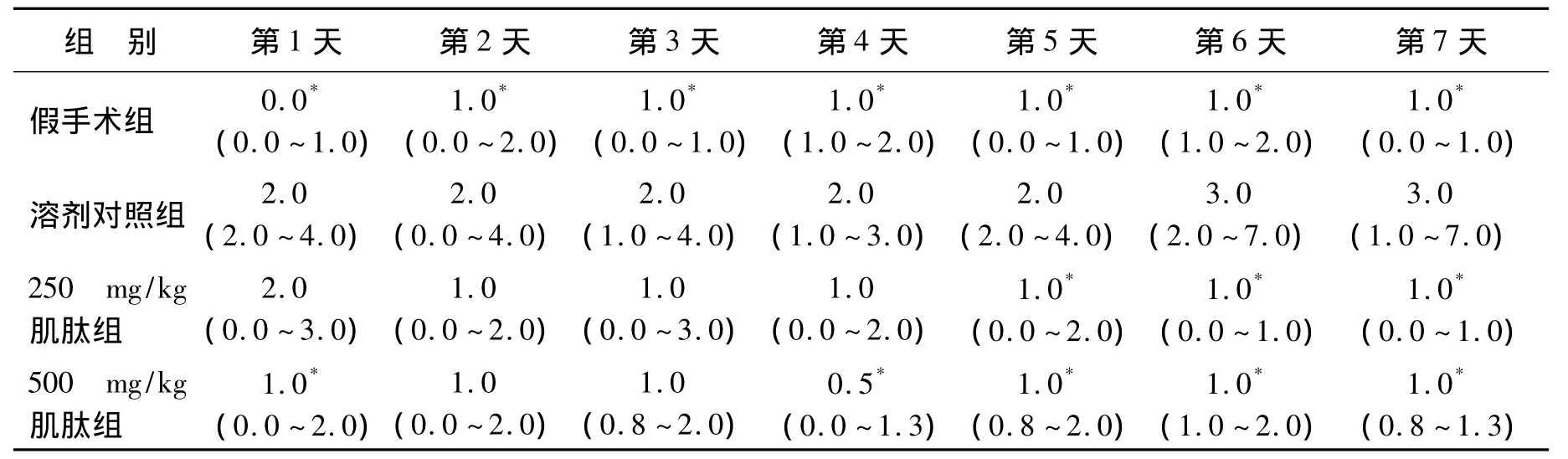
表2 闭合性脑损伤小鼠神经症状NSS评分Table 2 Neurological Severity Scores after closed head injury in mice [Median(P25~P75)]
2.4 肌肽对闭合性脑损伤小鼠组织病理学的影响 溶剂对照组和给药组小鼠自由落体脑损伤术后第7天,冠状大脑皮层组织病理切片经HE染色后,可见损伤侧半脑蛛网膜下腔充血,脑血管水肿、充血,脑实质细胞变性坏死,部分神经元细胞核固缩,并存在不同程度炎症细胞及小胶质细胞增生、浸润。250 mg/kg及500 mg/kg肌肽均能显著减轻损伤侧的脑损伤,减少出血及充血,降低炎性细胞的浸润,尤以500 mg/kg肌肽的保护作用更为显著(图2)。
3 讨论
脑外伤研究目前常用的模型有冻伤型、液压型及自由落体型。冻伤和液压模型不能很好地模拟临床上因坠击、交通事故等造成的闭合性脑外伤,相比之下,自由落体模型能更好地代表临床闭合性脑外伤的形成过程和病理特征,是一种理想的脑外伤模型。本研究采用文献[5]的方法,改进自由落体装置,选用小鼠作为实验动物,经自由落体敲击损伤后,动物表现出呼吸抑制、神经功能降低,在组织学层面,可见受损大脑皮层出现凝血块及组织损伤,并伴有死亡固缩的神经元及炎性细胞浸润,这些表型及病理学特征均较好地模拟了临床常见的闭合性脑损伤,提示该模型可用于脑外伤相关的病理生理学及药理学研究。
目前临床对脑外伤尚无十分有效的治疗药物,相关神经保护剂的使用是一种重要的治疗策略。肌肽作为一种天然存在的二肽,由β-丙氨酸和L-组氨酸组成,广泛存在于人体多种组织中,尤以骨骼肌以及新陈代谢旺盛的脑组织为多[2,7]。本课题组长期从事肌肽的抗缺血性脑损伤活性及相关机制研究,前期工作发现,肌肽可能通过清除自由基、抗氧化以及抗谷氨酸介导的细胞兴奋性毒性作用等机制发挥其保护作用[4,8]。闭合性脑损伤与缺血性脑损伤存在相似之处[9],但又较后者更为复杂。因此,结合课题组前期研究,推测肌肽可能同样具有抗脑外伤活性。本研究的结果表明,肌肽可显著提高小鼠闭合性脑损伤后7 d内的存活率,并可显著促进小鼠脑损伤后期神经功能的恢复,但对前期的保护作用不甚明显,且500 mg/kg肌肽较250 mg/kg肌肽更早显现出神经保护作用。组织病理学结果提示,肌肽可减轻脑组织充血及胶质细胞浸润,提示肌肽可能是一种潜在的抗闭合性脑损伤的保护药物。目前,肌肽已广泛用于保健品,至今尚无关于肌肽副反应的报道[6]。因此,相比临床上已应用的神经保护药物,肌肽具有更好的药物安全性,有望成为临床治疗脑外伤的理想药物。
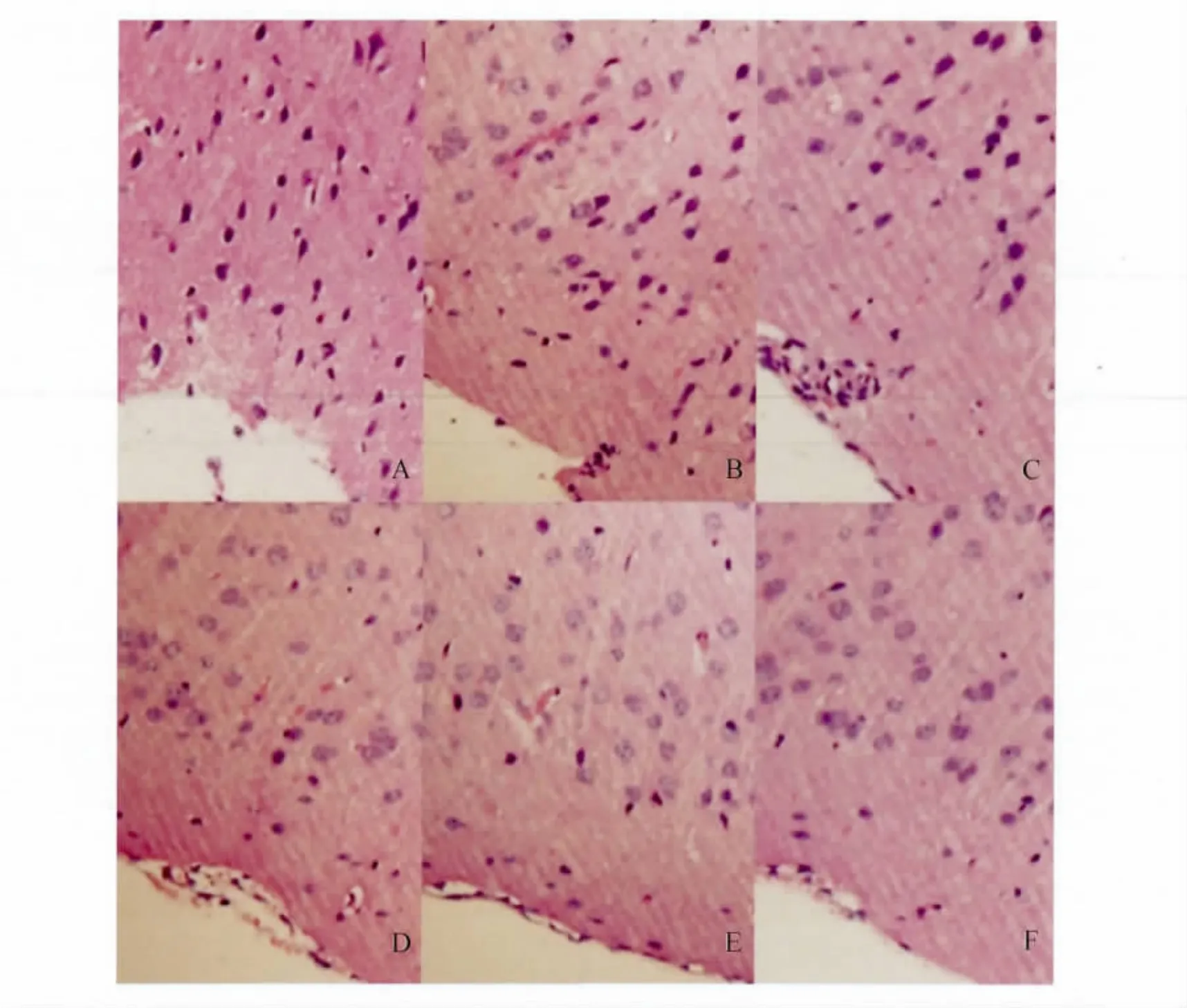
图2 小鼠闭合性脑损伤第7天后脑组织病理学变化Fig.2 Histological alternations 7 days after closed head injury in mice
目前研究认为,闭合性脑损伤病理机制包括炎症反应、氧化应激、离子失衡及兴奋性毒性作用等[10-11]。本研究发现,肌肽能显著减少闭合性脑损伤后炎症细胞的浸润,初步提示抗炎症反应可能是肌肽发挥保护作用的重要机制之一。肌肽能通过血脑屏障[12],在脑组织中代谢为组胺;组胺作为一种活性物质,在中枢神经系统内发挥了重要的抗炎作用。因此,肌肽的保护作用是否经由代谢产生组胺而发生,尚需进一步深入研究。
综上所述,本研究首次证实了肌肽对抗闭合性脑损伤的神经保护作用,肌肽可能是一种潜在的抗脑外伤药物。
[1]PUVANACHANDRA P,HYDER A A.The burden of traumatic brain injury in Asia[J].Pak J Neurol Sci,2009,4(1):27-32.
[2]BIFFO S,DELUCIA R,MULATERO B,et al.Carnosine-,calcitonin gene-related peptide-and tyrosine hydroxylase-immunoreactivity in the mouse olfactory bulb following peripheral denervation[J].Brain Res,1990,528:353-357.
[3]SHEN Yao,FAN Yanying,DAI Haibin,et al.Neuroprotective effect of carnosine on necrotic cell death in PC12 cells [J].Neuroscience Letters,2007,414:145-149.
[4]JIANG Yongmin,SENUT M C,RAJANIKANT K,et al.Differential neuroprotective effects of carnosine,anserine,and N-acetyl carnosine against permanent focal ischemia[J].Neurosci Res,2008,86(13):2984-2991.
[5]FLIERL M A,STAHEL P F,BEAUCHAMP K M,et al.Mouse closed head injury model induced by a weight-drop device [J].Nature Protocols,2009,1328-1337.
[6]ZHANG X,SONG L,CHENG X,et al.Carnosine pretreatment protects against hypoxia -ischemia brain damage in the neonatal rat model[J].Eur J Pharmacol,2011,667(1-3):202-207.
[7]BAI Jian,CHI Ge,ZHANG Jun,et al(白 剑,迟戈,张 俊,等).Protective effect of carnosine on the injury of rat vascular endothelial cells induced by hypoxia[J].Chin J Appl Physiol(中国应用生理学杂志),2010,26(1):30-32.(in Chinese)
[8]SHEN Yao,HU Weiwei,FAN Yanyin,etal.Carnosine protects against NMDA-induced neurotoxicity in differentiated rat PC12 cells through carnosine-histidine-histamine pathway and H1/H3 receptors[J].Biochemical Pharmacology,2007,73:709-717.
[9]LEKER R R,SHOHARM E.Cerebral ischemia and trauma-different etiologies yet similar mechanisms:neuroprotective opportunities[J].Brain Re,2002,39:55-73.
[10]BRAMLETT H M, DIETRICH W D.Pathophysiology of cerebral ischemia and brain trauma:similarities and differences.[J].Blood Flow Metab,2004,24:133-150.
[11]SEMPLE B D,BYE N,RANCAN M,et al.Role of CCL2(MCP-1)in traumatic brain injury(TBI):evidence from severe TBI patients and CCL2 mice[J].JournalofCerebralBlood Flow &Metabolism,2010,30:769-782.
[12]JIN C L,YANG L X,WU X H,et al.Effects of carnosine on amygdaloid-kindled seizures in Sprague-Dawley rats [J].Neuroscience,2005,135:930-947.

