Cav1.2钙通道片段CT1融合蛋白的制备及生物学活性鉴定
封瑞,胡慧媛,郭凤,于丽凤,赵美眯,龟山正树,郝丽英
(1.中国医科大学药学院药物毒理学教研室,沈阳 110001;2.鹿儿岛大学医学部,鹿儿岛 890⁃8544,日本)
L型钙通道是一类电压依赖性钙通道,是细胞兴奋时外钙内流的主要途径。其在许多生理和病理情况下起到重要的作用,例如在基因表达、肌肉收缩、激素分泌等方面都具有关键作用[1]。研究显示,心脑血管疾病与心脏和大脑的L型钙通道功能紊乱密切相关[2~4]。近些年,关于L型钙通道的研究已深入到分子水平。研究表明[5~7],L型钙通道的C末端是细胞因子对其功能调节的主要区域。为了对L型钙通道C末端的不同部位进行系统研究,通常需要获得L型钙通道蛋白的不同片段以进行体外实验。我们前期研究[8~10]发现,L型钙通道C末端的CT1(1509⁃1789)片段是钙离子、钙调蛋白(calmodu⁃lin,CaM)、蛋白激酶A(protein kinase A,PKA)等细胞因子的结合部位和调节部位,因此获得该片段的蛋白具有重要意义。
研究表明,CaM可与心肌细胞Cav1.2钙通道CT1片段结合从而对钙通道钙离子依赖性易化作用进行调节[5];CaMKⅡ也可磷酸化CT1片段上的1 512、1 570和1 695位点以调节钙通道的功能[11]。除了一些细胞因子可与钙通道结合并调节其功能以外,Cav1.2钙通道的远C末端(DCRD 2 062~2 115)可与近C末端(PCRD 1 675~1 746)结合[12],此结合作用在维持心脏正常功能方面具有重要作用,CT1片段即包括近C末端片段。因此,CT1片段是L型钙通道重要的功能部位,其在维持钙通道功能方面以及某些疾病中均具有关键作用。
基因重组技术是获得大量目标蛋白的有效方法。重组蛋白在大肠杆菌中大量表达后可通过多种方法进行分离纯化,例如液氮反复冻融法、超声破碎法[13,14]等。液氮反复冻融法耗时长,超声破碎法是刺耳的机械方法。本研究采用简单易用的非离子去垢剂来裂解细胞和溶解蛋白,纯化GST标签的CT1融合蛋白。同时,采用体外pull⁃down assay和Western blot的方法对所制备纯化的蛋白进行活性鉴定,为今后研究L型钙通道片段CT1的生物学功能奠定基础。
1 材料与方法
1.1 菌株和质粒
原核表达载体pGEX⁃6p⁃3/CT1和BL21菌株由本实验室保存。异丙基硫代⁃β⁃D半乳糖苷(IPTG)购自 Sigma公司,抗 Cav1.2(1507⁃1733)抗体购自StressMarq Biosciences公司,B⁃per购自 Thermo Sci⁃entic公司,Glutathione⁃Sepharose 4B beads,PreScis⁃sion Protease购自GE Healthcare公司。
1.2 pGEX⁃6p⁃3/CT1重组质粒的诱导表达
将测序鉴定正确的重组质粒pGEX⁃6p⁃3/CT1转化到E.coli BL⁃21中,经过蓝白筛选,将阳性克隆接种到含氨苄西林的LB培养液中,37℃震荡过夜,再将菌液稀释,37℃培养至OD600为0.6~1,再加入终浓度为1 mmol/L的IPTG,37℃震荡诱导表达4 h,离心收集菌液,准备提取融合蛋白。
1.3 CT1的提取与纯化
将收集的菌液加入B⁃per试剂(0.005 L/L菌液),同时加入蛋白酶抑制剂,DNA酶以及溶菌酶后,室温孵育15 min,再向菌液中加入1.5%N⁃lauroylsarco⁃sine sodium salt室温孵育15 min以促进CT1蛋白的溶解,12 000 r/min离心20 min,每0.015 L上清与0.2×10-3L GS⁃4B beads室温孵育1 h,600 r/min,离心10 min,弃上清,加入PBS,洗3次,向管中加入Tris缓冲液(50 mmol/L Tris pH 8.0,150 mmol/L NaCl),4℃保存。Bradford蛋白浓度测定法测定融合蛋白的浓度。牛血清白蛋白作为标准品被用来做标准曲线。
1.4 CT1蛋白鉴定
取上面制备的GST⁃CT1融合蛋白0.02×10-3L,经5×SDS loading buffer处理后,80 ℃煮10 min,上清进行12%SDS⁃PAGE电泳,根据蛋白marker检测CT1蛋白。
1.5 pull⁃down assay鉴定蛋白活性
取连接于GS⁃4B beads的GST⁃CT1蛋白0.01×10-3L于0.002 LEP管中,加入CaM(终浓度分别为0,0.7,1.4,2.1,3.5,10 μmol/L,)、CaCl2([Ca2+]2 mmol/L),细胞内液缓冲液至0.2×10-3L,4 ℃,4 h。600 r/min,离心3 min,弃上清,同样步骤清洗2遍。加入0.015×10-3L 5×SDS loading buffer洗脱处理,上清经12%SDS⁃PAGE电泳,考马斯亮蓝染胶,应用CS analyzer 3.0软件进行光密度测定。
1.6 Western blot鉴定CT1蛋白表达
将制备的CT1蛋白进行12%SDS⁃PAGE电泳,电转至PVDF膜上,5%脱脂奶粉室温封闭1 h,anti⁃Cav1.2钙通道抗体(抗C末端1 507~1 733氨基酸,StressMarq Biosciences公司,1/500)4℃孵育过夜,TBST洗膜15 min、3次后,辣根过氧化物酶标记的羊抗鼠二抗(1/5 000)室温孵育2 h,TBST洗膜15 min、3次,ECL显影。
2 结果
2.1 pGEX⁃6p⁃3/CT1重组质粒诱导表达及非离子型去污剂法纯化CT1蛋白
pGEX⁃6p⁃3/CT1转化入BL21后IPTG诱导表达,提取蛋白进行SDS⁃PAGE电泳后考马斯亮蓝染色观察IPTG诱导前和诱导后蛋白表达情况,结果发现IPTG诱导表达后分子量54 kDa处出现1条明显的特异性条带(图1A)。继续采用实验操作简单的非离子去污剂法纯化GST⁃CT1融合蛋白,此蛋白经过SDS⁃PAGE电泳考马斯亮蓝染色后观察,在分子量为54 kDa处存在GST⁃CT1融合蛋白条带(图1B)。
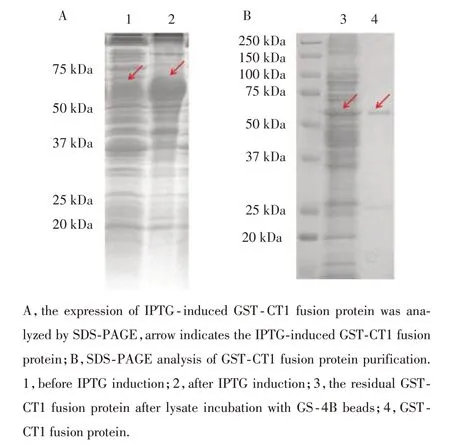
图1 GST⁃CT1融合蛋白在BL21中表达及纯化Fig.1 The expression and purification of the GST⁃CT1 fusion protein in BL⁃21
2.2 GST⁃CT1融合蛋白的Western blot鉴定
CT1蛋白片段是Cav1.2钙通道位于1 509~1 789氨基酸的一段蛋白片段,我们采用anti⁃Cav1.2钙通道的抗体对GST⁃CT1进行Western blot鉴定。本研究使用的抗体能识别1 507~1 733氨基酸部位,能够检测到心肌组织总蛋白中Cav1.2钙通道蛋白(图2A),因此能够应用此抗体对CT1蛋白进行鉴定。结果显示,在分子量为54 kDa处检测到一条特异性条带(图2B),说明表达了GST⁃CT1融合蛋白,并且非离子去污剂B⁃per能够成功制备GST⁃CT1融合蛋白。
2.3 GST⁃CT1与CaM浓度依赖性结合以鉴定CT1的生物学功能

图2 Western blot鉴定钙通道蛋白Fig.2 Western blot analysis of calcium channel protein
本实验采用pull⁃down assay的方法对制备的GST⁃CT1融合蛋白与CaM的结合情况进行研究,结果表明,在钙离子浓度为2 mmol/L时,CaM浓度依赖性的与GST⁃CT1融合蛋白中的CT1结合,见图3。
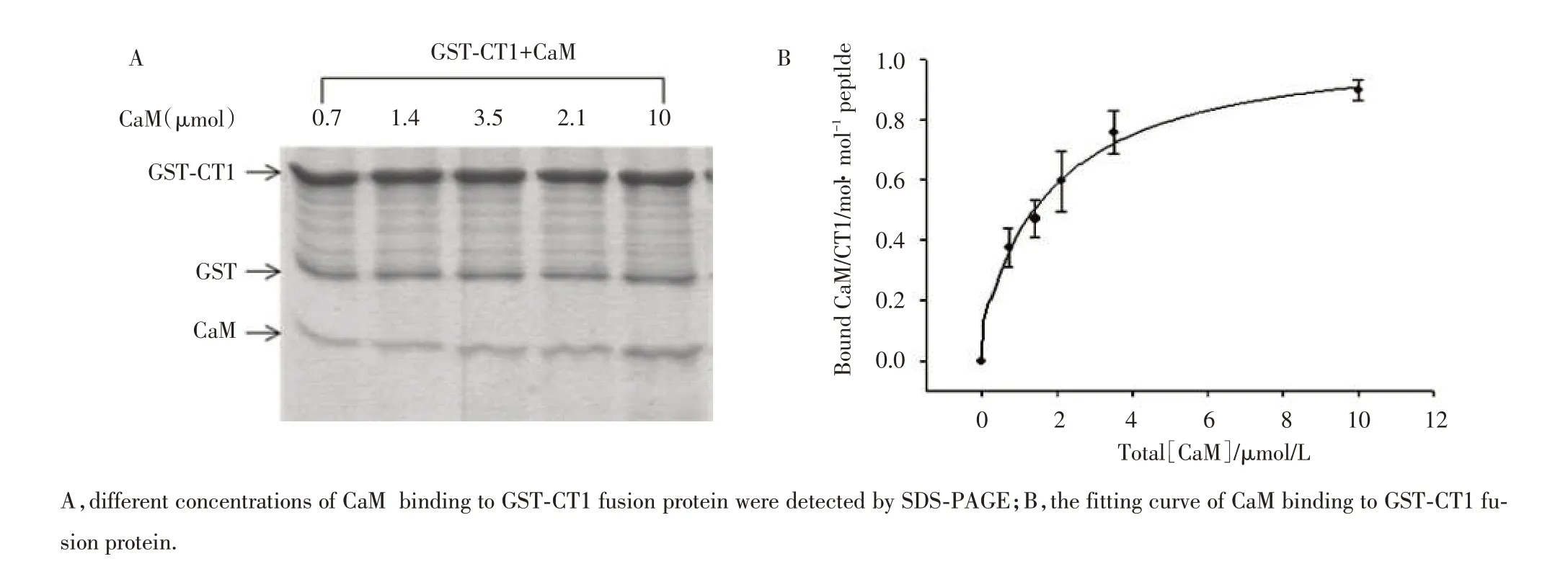
图3 CaM浓度依赖性与GST⁃CT1结合情况Fig.3 CaM bind to GST⁃CT1 fusion protein in a concentration⁃dependent manner
3 讨论
CT1片段是L型钙通道重要的功能片段,在许多生理和病理过程中起到关键作用。研究表明,许多细胞内因子对L型钙通道功能的调节是通过与钙通道C末端相互作用而实现的,可能L型钙通道C末端是钙通道最重要的功能调节区。研究发现,CaM、钙调蛋白抑素(calpastatin)、CaMKⅡ都可与钙通道C末端的近端相互作用,进而对钙通道进行调节[15~17],CT1蛋白片段即为L型钙通道C末端的近端。本研究采用非离子去污剂B⁃per制备和纯化钙通道C末端1 509~1 789部位的蛋白片段(CT1片段),对此蛋白片段进行了Western blot鉴定。同时,采用pull⁃down assay的方法对CT1片段进行了生物学功能的检测,结果显示,非离子去污剂B⁃per方法纯化制备的GST⁃CT1蛋白具有其本身的生物学功能,能够应用于其他实验进行相关研究,更进一步证实了本研究所制备的蛋白为具有生物学功能的GST⁃CT1融合蛋白。
目前,关于融合蛋白分离纯化的方法很多,每种方法都有其优点与缺点,本研究采用温和非离子去污剂B⁃per方法对GST⁃CT1融合蛋白进行分离纯化,与液氮反复冻融法和超声破碎法比较,此方法具有技术简单、操作快速等优点,除此之外,B⁃per方法制备蛋白还具有其他一些优点,例如某些蛋白诱导表达的过程中可能会产生一些包涵体,这会影响目标蛋白的提取,B⁃per方法在应用促溶剂的情况下,可成功抽提细菌裂解液中的包涵体蛋白;在使用B⁃per方法制备蛋白的过程中,蛋白始终保持浓缩,特别适用于小体积蛋白的抽提;B⁃per方法制备蛋白只需要使用B⁃per试剂就可使细胞裂解完全,不需要其他仪器;B⁃per方法制备蛋白使用Tris缓冲体系,对后续的相关蛋白研究提供了方便。但是,此方法在成本投入方面可能相对较高。因此,实验研究中要根据具体的情况选择合适的方法进行蛋白分离纯化。
本研究成功诱导表达GST⁃CT1蛋白,并采用简单、快速的B⁃per处理方法对GST⁃CT1融合蛋白进行分离纯化,同时,对GST⁃CT1融合蛋白进行了鉴定和功能检测。本研究不仅提供了融合蛋白制备的好方法,也为深入研究CT1片段与某些蛋白质的相互作用及其生物学意义奠定了坚实的基础,同时,也为阐明L型钙通道相关调节机制以及明确某些相关疾病的发病机制提供新的研究思路。
[1]Berridge MJ.Elementary and global aspects of calcium signalling[J].J Physiol,1997,499(Pt 2):291-306.
[2]Bers DM.Altered cardiac myocyte Ca regulation in heart failure[J].Physiology,2006,21(6):380-387.
[3]Song LS,Pi YQ,Kim SJ,et al.Paradoxical cellular Ca2+signaling in severe but compensated canine left ventricular hypertrophy[J].Circ Res,2005,97(5):457-464.
[4]Wang SQ,Stern MD,Ríos E,et al.The quantal nature of Ca2+sparks and in situ operation of the ryanodine receptor array in cardiac cells[J].Proc Natl Acad Sci USA,2004,101(11):3979-3984.
[5]Asmara H,Minobe E,Saud ZA,et al.Interactions of calmodulin with the multiple binding sites of Cav1.2 Ca2+channels[J].J Phar⁃macol Sci,2010,112(4):397-404.
[6]Zhou H,Yu K,McCoy KL,et al.Molecular mechanism for divergent regulation of Cav1.2 Ca2+channels by calmodulin and Ca2+⁃binding protein⁃1[J].J Biol Chem,2005,280(33)29612-29619.
[7]Xiong LW,Kleerekoper QK,He R,et al.Sites on calmodulin that in⁃teract with the C⁃terminal tail of CaV1.2 channel[J].J Biol Chem,2005,280(8):7070-7079.
[8]Xu JJ,Hao LY,Kameyama A,et al.Calmodulin reverses rundown of L⁃type Ca2+channels in guinea pig ventricular myocytes[J].Am J Physiol Cell Physiol,2004,287:C1717-C1724.
[9]Pitt GS.Calmodulin and CaMKⅡ as molecular switches for cardiac ion channels[J].Cardiovasc Res,2007,73(4):641-647.
[10]Hao LY,Wang WY,Minobe E,et al.The distinct roles of calmodu⁃lin and calmodulin kinaseⅡin the reversal of run⁃down of L⁃Type Ca2+channels in Guinea⁃pig ventricular myocytes[J].J Pharmacol Sci,2009,111(4),416-425.
[11]Lee TS,Karl R,Moosmang S,et al.Calmodulin kinaseⅡis in⁃volved in voltage⁃dependent facilitation of the L⁃type Cav1.2 calci⁃um channel:Identification of the phosphorylation sites[J].J Biol Chem,2006,281(35):25560-25567.
[12]Joanne TH,Vladimir YY,Lin TC,et al.Autoinhibitory control of the CaV1.2 channel by its proteolytically processed distal C⁃termi⁃nal domain[J].J Physiol,2006,576(1):87-102.
[13]王利利,刘彩红,朱亚.高GChTwist融合蛋白载体构建及其表达条件优化[J].中国医科大学学报,2012,41(3):204-207.
[14]邵阳光,刘姣,李丰.GST⁃HDAC4融合蛋白载体的构建及其蛋白表达[J].中国医科大学学报,2013,42(2):149-151.
[15]Han DY,Minobe E,Wang WY,et al.Calmodulin⁃and Ca2+⁃depen⁃dent facilitation and inactivation of the CaV1.2 Ca2+channels in Guinea⁃pig ventricular myocytes[J].J Pharmacol Sci,2010,112(3):310-319.
[16]Minobe E,Asmara H,Saud ZA,et al.Calpastatin domain L is a partial agonist of the calmodulin⁃binding site for channel activa⁃tion in Cav1.2 Ca2+channels[J].J Biolo Chem,2011,286(45):39013-39022.
[17]Hao LY,Xu JJ,Minobe E,et al.Calmodulin kinaseⅡactivation is required for the maintenance of basal activity of L⁃Type Ca2+chan⁃nels in Guinea ⁃pig ventricular myocytes[J].J Pharmacol Sci,2008,108(3),290-300.

