慢性乙型肝炎病毒感染者外周血单个核细胞中T-bet、 GATA3和FoxP3 mRNA的表达及其意义
杨 智,陈洪涛,张 毅,吴诗品
(1.暨南大学第二临床医学院 深圳市人民医院感染内科,广东 深圳 518020; 2.暨南大学生命科学技术学院,广东 广州 510632)
慢性乙型肝炎病毒感染者外周血单个核细胞中T-bet、GATA3和FoxP3mRNA的表达及其意义
杨 智1,陈洪涛1,张 毅2,吴诗品1
(1.暨南大学第二临床医学院 深圳市人民医院感染内科,广东 深圳 518020; 2.暨南大学生命科学技术学院,广东 广州 510632)
目的:检测慢性乙型肝炎病毒感染者外周血单个核细胞(PBMCs)中T-bet、GATA3和FoxP3 mRNA的表达水平,探讨其对慢性HBV感染者病情转归的影响。方法:选择86例住院患者,根据慢性乙型肝炎防治指南诊断标准,共分为4组,包括慢性乙型肝炎(CHB)中度组患者33例、CHB重度组患者21例、重型肝炎组患者16例和乙型肝炎肝硬化组患者16例,另选取健康者10名作为对照组。采用RT-PCR法检测外周血单个核细胞T-bet、GATA3和FoxP3 mRNA的表达水平。结果:CHB中度、CHB重度、重型肝炎、肝硬化组患者和对照组研究对象PBMCs中T-bet的表达水平分别为0.597±0.094、0.724±0.071、0.860±0.060、0.528±0.059和0.514±0.071;CHB重度及重型肝炎组患者T-bet表达水平均高于对照组(Plt;0.05);CHB中度组患者T-bet表达水平低于CHB重度组患者(Plt;0.05);CHB重度组患者T-bet表达水平低于重型肝炎组患者(Plt;0.05)。CHB中度、CHB重度、重型肝炎、肝硬化组患者和对照组GATA3的表达水平分别为0.966±0.037、0.973±0.021、0.725±0.028、0.759±0.037和0.535±0.028;各组患者GATA3表达水平均高于对照组(Plt;0.05);重型肝炎组患者GATA3表达水平低于CHB中、重度组患者(Plt;0.05)。CHB中度、CHB重度、重型肝炎、肝硬化组患者和对照组FoxP3的表达水平分别为0.935±0.034、0.919±0.047、0.804±0.021、0.984±0.060和0.772±0.083,除重型肝炎组患者外其他各组患者FoxP3表达水平均较对照组显著升高(Plt;0.05);重型肝炎组患者FoxP3表达水平低于其他各组(Plt;0.05)。CHB中度、CHB重度、重型肝炎、肝硬化组患者和健康对照组T-bet/GATA3的表达分别为0.618±0.100、0.744±0.072、1.187±0.082、0.697±0.078和0.963±0.133,各组比值与健康对照组比较差异均有统计学意义(Plt;0.05),CHB中度组患者T-bet/GATA3比值低于CHB重度组和重型肝炎组(Plt;0.05);重型肝炎组患者T-bet/GATA3比值高于其他各组(Plt;0.05)。结论:随着肝病炎症的加剧,T-bet与GATA3的表达呈反方向变化,慢性HBV感染患者T-bet/GATA3比值与 FoxP3 mRNA表达呈显著负相关关系。
肝炎,乙型,慢性;免疫;T盒21转录因子;转录因子GATA结合蛋白3;叉状头/翅膀状螺旋转录因子
肝脏是一个免疫细胞丰富的器官,不同的免疫细胞能诱发其免疫耐受、免疫激活及免疫清除等作用,有复杂的免疫活性。慢性乙型肝炎病毒(hepatitis B virus,HBV)感染时,因为病毒长期存在,T淋巴细胞的激活和效应在病情的进展中起着不同的免疫病理作用。辅助性T细胞(help T cell,Th)包括Th1、Th2及调节性T细胞(regulatory T cell,即CD4+CD25+Treg),作为T细胞分化的不同亚群,其表达数量可能决定了HBV感染的清除和病变的程度。而在T细胞亚群分化过程中,转录因子具有重要的调节作用。T盒21转录因子(T-box 21 transcription factor,T-bet)、转录因子GATA结合蛋白3(GATA-binding protein-3,GATA3)和叉状头/翅膀状螺旋转录因子(forkhead box P3,Foxp3)分别特异性地表达于Th1、Th2和CD4+CD25+Treg细胞[1-3]。2000年Szabo 等[1]通过免疫印迹分析发现:T-bet只出现于Th1细胞系,而T-bet在Th1细胞的分化中起着决定性的作用,且T-bet的表达在Th1细胞发展的早期阶段迅速增高,而在Th2细胞的发展过程中则不表达[4]。GATA3是1991年发现的一种细胞谱系特异性因子,是具有锌指结构的GATA家族中成员。GATA3对Th1 细胞的发育起抑制作用,主要在Th2 细胞中表达,是Th2 细胞发育过程中重要的转录因子[5]。Foxp3属于Fox转录因子家族,对鼠和人Treg细胞的发育和功能都至关重要[6]。目前国内外已对Th1、Th2及CD4+CD25+Treg细胞分别在慢性HBV感染中的免疫病理作用进行较深入的研究,对各细胞关键调节因子亦有一定研究,但未发现对3种细胞之间相互关系分析报道。本研究通过检测慢性HBV感染者外周血单个核细胞(PBMCs)中转录因子T-bet、GATA3和Foxp3 mRNA的表达水平,并与正常人群进行比较分析,探讨T-bet、GATA3和Foxp3在慢性乙型肝炎(chronic hepalitis B,CHB)发病机制中的作用,并分析几种转录因子的相互关系及其对病情转归的影响。
1 资料与方法
1.1 一般资料 选择2011年4—10月暨南大学医学院附属深圳市人民医院感染内科病房住院的86例慢性HBV感染者作为研究对象,诊断均符合2000年西安全国第十次病毒性肝炎及肝病学术会议修订的“病毒性肝炎防治方案”标准[7]。纳入标准:HBsAg阳性,HBeAg阳性或阴性,HBV-DNA定量升高,肝功能异常者。排除标准:①并发其他类型病毒性肝炎者,如并发丙型肝炎和丁型肝炎等;②其他非病毒性肝炎及其引起的肝硬化,如药物性肝炎、酒精性肝硬化和代谢性肝硬化等;③目前有明显的非本病临床症状和体征而影响证侯确定者;④因精神、语言等因素而影响资料收集者。其中CHB中度33例,CHB重度21例,重型肝炎16例,乙型肝炎肝硬化16例。选择10名来自本科室健康医务人员(无肝病及其他基础疾病者)作为健康对照组。病例组与健康对照组在年龄和性别等方面具有可比性,组间比较差异无统计学意义(Pgt;0.05)。研究对象的临床资料见表1。
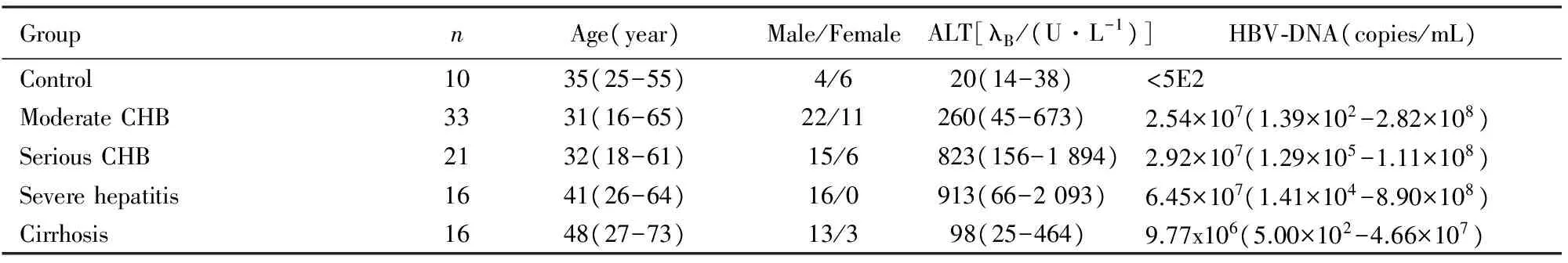
表1 患者及健康对照者入组时一般情况
1.2 主要试剂和仪器 淋巴细胞分离液购于天津GBD公司;RT试剂盒、PCR试剂盒和DNA Marker均购于美国Fermetas公司;引物由天津金斯瑞公司合成;PCR仪由德国Eppendorf公司提供;电泳仪、凝胶成像分析系统由美国Bio-Rad公司提供。
1.3 标本采集和处理 抽取患者和健康对照者外周静脉血3~4 mL,用常规淋巴细胞分层液密度梯度离心法分离PBMCs。用总RNA提取试剂盒提取总RNA,-20℃保存。
1.4 PCR引物设计 根据GenBank检索的基因序列,利用Premier 5软件分别设计T-bet、GATA3、FoxP3和β-actin引物(本实验使用β-actin为内部参照系统),所有引物由天津金斯瑞公司合成。T-bet上游引物:5′-TGGTGCTGCGTCTTGCTTT-3′,下游引物:5′-CTGGCGGGCTGATGGTTAT-3′,扩增片段长度为233 bp。GATA3上游引物:5′-GTGTTACCGTTCACCAGTTGC-3′,下游引物:5′-GCAGGAATAGGGACAAGACAG-3′,扩增片段长度为391 bp。FOXP3上游引物:5′-TGGTGGGAGGCAGAGGTGGT-3′,下游引物:5′-ATGCAGCTTTGAGGTTGTTTGA-3′,扩增片段长度为406 bp。β-actin上游引物:5′-CGGGAAATCGTGCGTGACAT-3′,下游引物:5′-CAGGAAGCAAGGCTGGAAGA-3′,扩增片段长度为186 bp。
1.5 T-bet、GATA3和FoxP3 mRNA的检测 RT-PCR方法:以提取的总RNA 12 μL 为模板合成cDNA,以cDNA 为模板分别扩增T-bet、GATA3和FoxP3基因片段,并以β-actin 作为内部参照系统。PCR 采用同管扩增法,反应步骤:每管先加入目的基因上下游引物各1 μL,加入内参β-actin的上下游引物各0.1 μmol (1 μL),进行PCR 反应30个循环,即得PCR 产物。PCR 反应条件为:94℃、2 min(启动);94℃、30 s(变性),57℃、30 s(退火),72℃、45 s(延伸),共30次循环;72℃延伸5 min。PCR 产物在1.5%的琼脂糖凝胶中电泳,在凝胶成像系统中拍照分析。数据读取:目的基因灰度值/同泳道中内参的灰度值,所得数据代表各细胞因子在PBMCs中的表达水平。
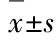
2 结 果
2.1 各组患者及健康对照组PBMCs中T-bet的表达水平 CHB重度组、重型肝炎组和健康对照组T-bet的表达水平高于健康对照组(Plt;0.05),CHB中度组、肝硬化组和健康对照组间比较差异无统计学意义(均Pgt;0.05)。进一步行多重比较,CHB中度组患者T-bet表达水平低于CHB重度组患者(Plt;0.05);CHB重度组患者T-bet表达水平低于重型肝炎组患者(Plt;0.05);CHB中度组患者T-bet表达水平明显低于重型肝炎组患者(Plt;0.05);而CHB中度组患者T-bet表达水平与肝硬化组比较差异无统计学意义(Pgt;0.05)。见图1和表2。
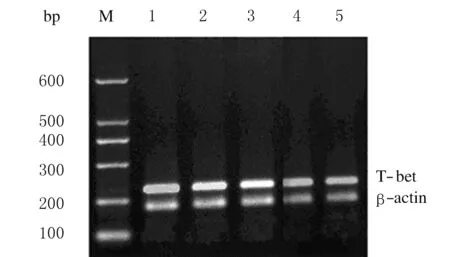
图1 各组PBMCs中T-bet表达的电泳图
Fig.1 Electrophoregram of T-bet expressions in PBMCs in various groups
M:Marker;Lane 1:Moderate CHB group;Lane 2:Serious CHB group;Lane 3:Severe hepatitis group;Lane 4:Cirrhosis group;Lane 5:Control group.
2.2 各组患者及健康对照组PBMCs中GATA3的表达水平 各组患者GATA3表达水平均高于健康对照组(Plt;0.05)。进一步行多重比较,重型肝炎和肝硬化组患者较CHB中、重度组患者GATA3表达水平低(Plt;0.05);重型肝炎组患者GATA3表达水平低于肝硬化患者,但差异无统计学意义(Pgt;0.05)。见图2和表2。
2.3 各组患者及健康对照组PBMCs中FoxP3的表达水平 除重型肝炎组外其他各组患者FoxP3表达水平均高于健康对照组(Plt;0.05)。进一步行多重比较,CHB重度组患者FoxP3表达水平较CHB中度组低,但差异无统计学意义(Pgt;0.05);重型肝炎组患者FoxP3表达水平低于其他各组(Plt;0.05);重型肝炎组患者FoxP3表达水平较对照组稍高,但差异无统计学意义(Pgt;0.05)。见图3和表2。
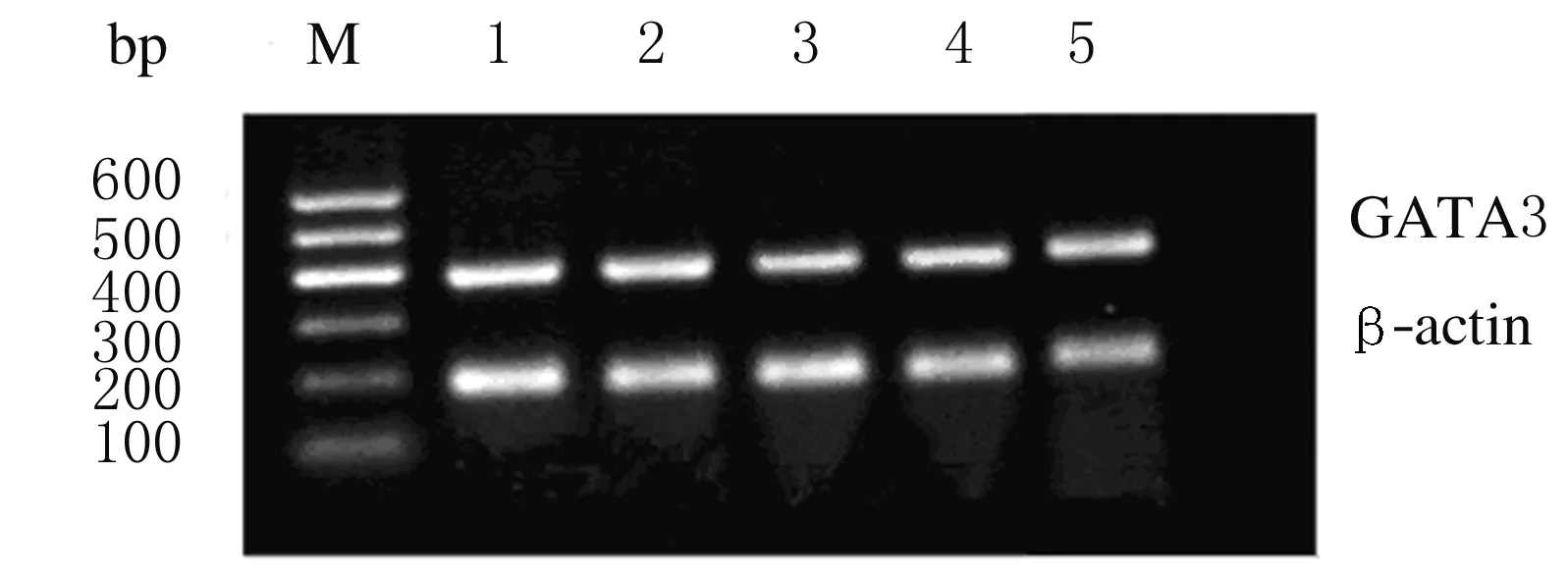
图2 各组PBMCs中GATA3表达的电泳图
Fig.2 Electrophoregram of GATA3 expressions in PBMCs in various groups
M:Marker;Lane 1:Moderate CHB group;Lane 2:Serious CHB group;Lane 3:Severe hepatitis group;Lane 4:Cirrhosis group;Lane 5:Control group.
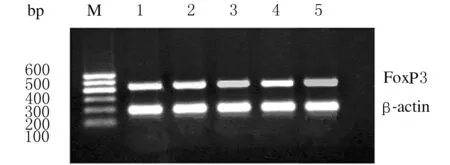
图3 各组PBMCs中FoxP3 表达的电泳图
Fig.3 Electrophoregram of FoxP3 expressions in PBMCs in various groups
M:Marker;Lane 1:Moderate CHB group;Lane 2:Serious CHB group;Lane 3:Severe hepatitis group;Lane 4:Cirrhosis group;Lane 5:Control group.
2.4 各组患者及健康对照组T-bet/GATA3比值 重型肝炎组患者T-bet/GATA3比值最高,各组患者与健康对照组比较差异均有统计学意义(Plt;0.05);CHB 中度组患者T-bet/GATA3 比值低于CHB 重度组和重型肝炎组(Plt;0.05);重型肝炎组患者T-bet/GATA3 比值高于其他各组(Plt;0.05)。见表2。
2.5 慢性HBV感染患者FOXP3的表达水平与T-bet/GATA3比值相关性分析 Pearson相关性分析显示:慢性HBV感染患者FoxP3的表达水平与T-bet/GATA3比值呈显著负相关关系(r=-0.612,Plt;0.05)。见图4。
表2 各组患者和健康对照组PBMCs中T-bet、GATA3和FoxP3的表达水平
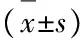
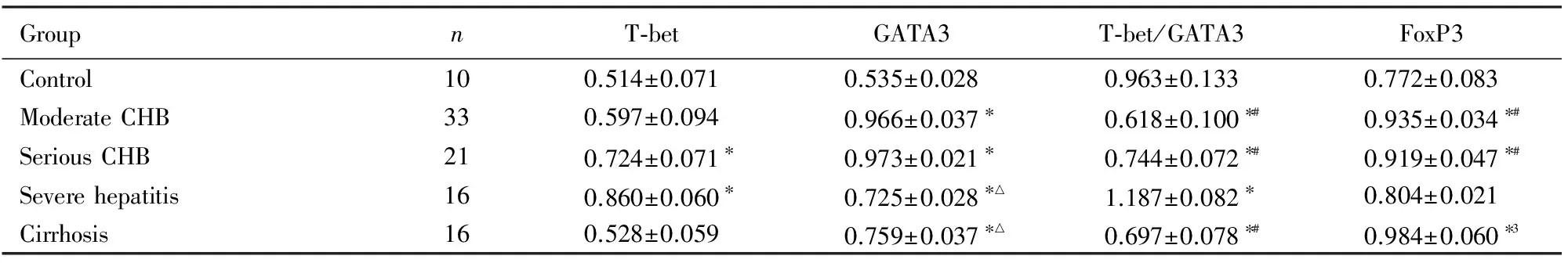
GroupnT⁃betGATA3T⁃bet/GATA3FoxP3Control100.514±0.0710.535±0.0280.963±0.1330.772±0.083ModerateCHB330.597±0.0940.966±0.037∗0.618±0.100∗#0.935±0.034∗#SeriousCHB210.724±0.071∗0.973±0.021∗0.744±0.072∗#0.919±0.047∗#Severehepatitis160.860±0.060∗0.725±0.028∗△1.187±0.082∗0.804±0.021Cirrhosis160.528±0.0590.759±0.037∗△0.697±0.078∗#0.984±0.060∗3
*Plt;0.05 compared with control group;△Plt;0.05 compared with moderate CHB and serious CHB groups;#Plt;0.05 compared with severe hepatitis group.
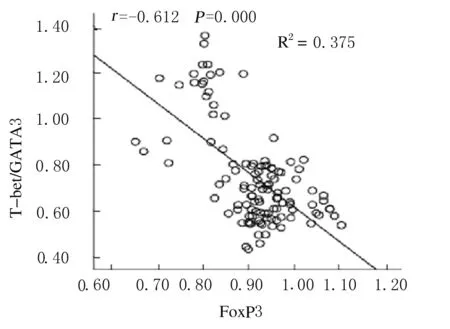
图4 慢性HBV感染患者T-bet/GATA3比值与FoxP3的相关性分析
Fig.4 Correlation analysis on T-bet/GATA3 ratio and FoxP3 in patients with chronic HBV infection
3 讨 论
HBV本身并不引起肝细胞的损害,肝细胞破坏的主要机制在于机体的免疫学损伤[8-9]。细胞免疫反应和体液免疫反应均参与HBV感染时肝脏的免疫反应,其中T淋巴细胞介导的细胞免疫反应是一个由多种免疫细胞和免疫分子参与并受到严格调控及制约的复杂生理过程[10]。慢性HBV感染时肝脏参与自然免疫和适应性免疫之间的动态相互作用,自然免疫参与早期的免疫反应。因为病毒长期存在,适应性免疫尤其是T淋巴细胞的激活和效应的不同,导致了病情结局的不同,其中Th1/Th2失衡及CD4+CD25+Treg细胞的表达数量可能决定了HBV感染病毒的清除和病变的程度。
Szkaradkiewicz等[11]研究显示:急性乙型肝炎的细胞因子谱中急性期Th1细胞占67%,Th2细胞占33%,而恢复期Th1细胞占21%,Th2细胞占74%,表明Th1细胞优势与清除病毒相关,Th2细胞优势在于维持慢性携带状态,Th1/Th2失衡可能决定HBV感染的清除和病变的程度。Tsai等[12]研究显示:在CHB治疗有效病例,Th1细胞因子谱占优势,对病毒抗原的增殖应答显著升高,优势Th1应答与CTL活性显著加强相关。在决定Th1 /Th2 细胞分化的众多因素中,转录因子T-bet和GATA3 起着重要作用[13],因此T-bet/GATA3的表达水平一定程度上反映了Th1 /Th2在慢性HBV感染患者不同病程中的参与情况。本研究发现:在肝脏炎症急性加重时,T-bet表达明显升高,而GATA3则相反,在肝脏炎症进入病情迁延期时表达增加。由此,本文作者认为:在CHB病程中,有时以Th1样细胞应答为主,表现为ALT升高和肝病急性加剧,随之病毒清除,可自发缓解;病情缓和时,Th2细胞开始占优势,进入慢性肝炎持续期,急性再活动时可诱导Th1再上升。因此在肝损害程度加重时,特别是重型肝炎时,以Th1样细胞应答为主,T-bet表达水平亦明显升高,而GATA3表达降低,相反则病情进入慢性迁延期,两者对慢性HBV感染患者进展到不同病程起着相反的作用。在作用过程中Th1、Th2细胞分别分泌不同的细胞因子,Th1型因子清除病毒并引起慢性肝损害;但伴随Th2型因子拮抗其抗病毒效应,其清除效率不如在急性乙型肝炎。Th1优势免疫应答涉及炎症和组织损伤,而Th2细胞的激活抑制了急性和慢性炎症。T细胞激活后Th1应答发生较早,Th2细胞在应答性进展中逐渐积累,以限制Th1的组织损伤效应。Th2细胞优势维持慢性携带状态,而Th1细胞优势与清除病毒相关。两者在慢性HBV感染者中表达的不同,促使病变进展的不同程度。
Treg细胞常用的分子标记包括CD4+CD25+、FoxP3和CD127等,FoxP3在T细胞上特异性表达,并且是Treg细胞发育和功能所必需的,可反映Treg细胞的水平和功能活性,目前被作为证实Treg细胞的金标准[14]。Stoop 等[15]检测发现:CHB患者外周血CD4+T细胞中Treg细胞比例和FoxP3 表达量均高于恢复期患者和健康人,Treg细胞能抑制HBcAg特异性T细胞反应和IFN-γ分泌,提示Treg和FoxP3 高表达能抑制HBV特异性免疫反应,促进HBV 感染慢性持续。研究[16-18]发现:Treg细胞可以通过抑制HBV 特异性的CD8+T 细胞的激活,一方面抑制过度免疫病理损伤,另一方面有利于病毒的持续感染,在乙型肝炎的发病机制中起关键作用。本研究发现:在慢性HBV感染者肝病急性加重期时,FoxP3的表达与健康对照组无显著差异,而肝病进入慢性迁延期时,FoxP3表达明显升高。进而推测Treg细胞在慢性HBV感染患者中能够抑制免疫反应,避免HBV清除过程中的组织损伤,但同时不利于病毒清除,使肝病进入慢性迁延期。CD4+CD25+Treg细胞能抑制CD4+、CD8+T细胞和NK细胞的效应功能,在维持免疫耐受性中起重要作用。CD4+CD25 +Treg细胞能抑制T细胞增殖和产生IFN-γ,故其数量和功能的改变可能与HBV持续感染相关。HBV感染的主要免疫学特征是病毒特异性CD4+和CD8+T细胞不同程度的低应答状态,特异性T细胞低效应未能完全清除病毒,却可能在感染过程中发生病变活动,病变累积最终发生严重慢性肝病。
进一步分析发现:慢性HBV感染患者T-bet/GATA3比值与 FoxP3呈显著负相关关系,提示在慢性HBV感染中,FoxP3的增高与GATA3的上调和(或)T-bet的下调有着相似的意义,推测其在慢性HBV感染中存在某种协同作用,三者分别为Treg调节T细胞、Th1和Th2细胞的特异性调节因子。Th1细胞介导细胞免疫应答,表达优势与清除病毒相关;Th2促使B细胞发育,辅助B细胞产生抗体,扩大体液免疫应答,表达优势维持慢性携带状态,倾向免疫耐受性。T细胞激活后Th1应答发生较早,Th2样细胞在应答性进展中逐渐累积,以限制Th1的组织损伤效应。而CD4+CD25+Treg细胞能抑制T细胞增殖及其产生IFN-γ,患者不能对病毒抗原产生充分免疫应答,T细胞处于低应答的免疫耐受性,使宿主不能清除病毒而持续感染,故其数量和功能的改变可能与HBV持续感染相关。
T-bet和GATA3在慢性HBV感染患者中的免疫反应中随病变程度呈相反方向变化,因此本文作者推测:T-bet下降和GATA3上升在免疫反应中可能均起到促进Treg细胞抑制功能的作用,这进一步证实了本实验中T-bet/GATA3比值与FoxP3的负相关关系。因而本文作者认为:Th1、Th2和Treg细胞在共同协调机体对HBV的免疫反应和过度免疫损伤的平衡中可能发挥了巨大的作用,由于个体免疫表达的差异,从而导致最终发展至不同的结局。
综上所述,随着肝病炎症的加剧,T-bet与GATA3的表达呈反方向变化,提示Th1/Th2失衡可能影响慢性HBV感染患者病毒的清除和病情的转归。慢性HBV感染患者病情迁延期FoxP3 mRNA表达明显升高,而重型肝炎时表达水平明显偏低,提示CD4+CD25+Treg细胞可能参与调节机体对HBV感染的免疫耐受。慢性HBV感染患者T-bet/GATA3比值与 FoxP3 mRNA表达呈显著负相关,提示在慢性HBV感染中,FoxP3的增高与GATA3的上调和(或)T-bet的下调有着相似的意义,推测其在慢性HBV感染中存在某种协同作用。本实验进一步证明T淋巴细胞介导的细胞免疫反应参与复杂的肝脏免疫反应,对慢性HBV感染患者的不同转归起着不同的作用。
[1] Szabo SJ,Kim ST,Costa GL,et al.A novel transcription factor,T-bet,directs Th1 lineage commitment [J].Cell,2000,100(6): 655-669.
[2] Seki N,Miyazaki M,Suzuki W,et al.IL-4 induced GATA3 expression is a time-restricted instruction switch for Th2 cell differentiation [J].J Immunol,2004,172(10): 6158-6166.
[3] Haiqi H,Yong Z,Yi L.Transcription regulation of Foxp3 in regulatory T cells [J].Immunobiology,2011,216(6): 678-685.
[4] Usui T,Preiss JC,Kanno Y,et al.T-bet regulates Th1 responses through essential effects on GATA-3 function rather than on IFNG gene acetylation and transcription[J].Exp Med,2006,203(3):755-766.
[5] Zhu J,Yamane H,Cote Sierra J,et al.GATA-3 promotes Th2 responses through three different mechanisms: induction of Th2 cytokine production,selective growth of Th2 cells and inhibition of Th1 cell-specific factors [J].Cell Res,2006,16(1):3-10.
[6] Chen Z,Lin F,Gao Y,et al.FOXP3 and RORγt: transcriptional regulation of Treg and Th17[J].Int Immunopharmacol,2011,11(5):536-542.
[7] 中华医学会传染病与寄生虫病分会、肝病学分会.病毒性肝炎防治方案 [J].中华传染病杂志,2001,19(1): 56-62.
[8] Wang FS,Zhang Z.Host immunity influences disease progression and antiviral efficacy in humans infected with hepatitis B virus [J].Expert Rev Gastroenterol Hepatol,2009,3(5):499-512.
[9] Boonstra A,Woltman AM,Janssen HL.Immunology of hepatitis B virus and hepatitis C virus infections [J].Best Pract Res Clin Gastroenterol,2008,22(6):1049-1061.
[10]Das A,Maini MK.Innate and adaptive immune responses in hepatitis B virus infection [J].Dig Dis,2010,28(1):126-132.
[11]Szkaradkiewicz A,Jopek A,Wysocki J,et al.HBcAg-specific cytokine production by CD4 T lymphocytes of children with acute and chronic hepatitis B [J].Virus Res,2003,97(2):127-133.
[12]Tsai SL,Sheen IS,Chien RN,et al.Activation of Th1 immunity is a common immune mechanism for the successful treatment of hepatitis B and C:tetramer assay and therapeutic implications [J].J Biomed Sci,2003,10(1):120-135.
[13]Nasta F,Ubaldi V,Pace L,et al.Cytotoxic T-lymphocyte antigen-4 inhibits GATA-3 but not T-bet mRNA expression during T helper cell differentiation [J].Immunology,2006,117(3):358-367.
[14]Hori S,Nomura T,Sakaguchi S,et al.Control of regulatory T cell development by the transcription factor Foxp3 [J].Science,2003,299( 5609) : 1057-1061.
[15]Stoop JN,van der Molen RG,Baan CC,et al.Regulatory T cells contribute to the impaired immune response in patients with chronic hepatitis B virus infection [J].Hepatology,2005,41(4):771-778.
[16]Peng G,Li S,Wu W,et al.Circulating CD4+CD25+regulatory T cells correlate with chronic hepatitis B infection [J].Immunology,2008,123(1):57-65.
[17]高会霞,刘玉珍,卢建华,等.原发性胆汁性肝硬化患者肝组织FoxP3+和转化生长因子β1的表达及临床意义[J].临床肝胆病杂志,2012,28(12):952-955.
[18]张 政,王福生.慢性乙型肝炎免疫致病机制和免疫治疗现状[J].临床肝胆病杂志,2012,28(11):801-804.
ExpressionsofT-bet,GATA3andFoxP3mRNAinPBMCsinpatientswithchronichepatitisBvirusinfectionandtheirsignificances
YANG Zhi1,CHEN Hong-tao1,ZHANG Yi2,WU Shi-pin1
(1.Department of Infectious Diseases,Shenzhen People’s Hospital,Second Clinical Hospital,Jinan University, Shenzhen 518020,China;2.College of Life Science and Technology,Jinan Univeisity,Guangzhou 510632,China)
ObjectiveTo detect the expressions of T-bet,GATA3 and Foxp3 mRNA in peripheral blood mononuclear cells(PBMCs) in patients with chronic hepatitis B(CHB) infection,and to investigate the influence in the development of chronic HBV infection.MethodsEighty-six in-patients were selected.According to the diagnostic criteria of CHB prevention guidelines,they were divided into four groups:33 moderate CHB patients,21 serious CHB patients,16 severe hepatitis patients and 16 cirrhosis patients.10 healthy volunteers were used as controls.RT-PCR method was used to detect the expressions of T-bet,GATA3 and Foxp3 mRNA in PBMCs in patients with CHB.ResultsThe expression levels of T-bet in moderate CHB group,serious CHB group,severe hepatitis group,cirrhosis group and control group were 0.597±0.094,0.724±0.071,0.860±0.060,0.528±0.059,and 0.514±0.071,respectively.The T-bet levels of the patients in serious CHB and severe hepatitis groups were higher than that in control group(Plt;0.05);the T-bet level of the patients in moderate CHB group was lower than that in serious CHB group(Plt;0.05).The expression of T-bet in serious CHB patients was lower than that in severe hepatitis group(Plt;0.05).The levels of GATA3 of the patients in moderate CHB group,serious CHB group,severe hepatitis group,cirrhosis group and control group were 0.966±0.037,0.973±0.021,0.725±0.028,0.759±0.037,and 0.535±0.028,respectively.The levels of GATA3 in patients groups were greatly higher than that in control group(Plt;0.05).The GATA3 expression levels in severe hepatitis group was significantly lower than those in moderate and serious CHB groups(Plt;0.05).The expression levels of Foxp3 in moderate CHB group,serious CHB group,severe hepatitis group,cirrhosis group and control group were 0.935±0.034,0.919±0.047,0.804±0.021,0.984±0.060,and 0.772±0.083,respectively.The Foxp3 expression level of the patients in severe group was lower than those in the other patients groups(Plt;0.05).The T-bet/GATA3 ratios in moderate CHB group,serious CHB group,severe hepatitis group,cirrhosis group and control group were 0.618±0.100,0.744±0.072,1.187±0.082,0.697±0.078, and 0.963±0.133, respectively.The T-bet/GATA3 ratio of the patients in severe hepatitis group was markedly higher than those in the other patient groups(Plt;0.05).ConclusionThe expressions of T-bet and GATA3 are contrary during the different courses of disease.The ratio of T-bet/GATA3 is negatively correlated with the expression of Foxp3 in the patients with chronic HBV infection.
hepatitis B,chronic;immunity;T-box 21 transcription factor;GATA-binding protein-3;forkhead box p3
1671-587Ⅹ(2013)05-0953-07
10.7694/jldxyxb20130520
2013-03-28
广东省科技厅青年自然科学基金资助课题(D2011283)
杨 智(1978-),女,四川省资阳市人,主治医师,医学硕士,主要从事感染病学临床与基础研究。
吴诗品(Tel:0755-22942578,E-mail:wupoem@126.com)
R512.62
A

