新风胶囊对佐剂关节炎大鼠肺功能及Treg、Foxp3、TGF-β1/Smads的作用
万 磊,刘 健,黄传兵,汪 元,谌 曦,张皖东,王桂珍,范海霞,葛 瑶,陈瑞莲,曹云祥,纵瑞凯
(安徽中医药大学第一附属医院风湿免疫科,合肥 230031)
类风湿关节炎(Rheumatoid arthritis,RA)是一种以慢性关节炎症为主要表现的自身免疫疾病,疾病反复迁延易导致关节畸变,最终出现关节功能丧失。RA病变并非局限于关节,常伴有关节以外的其他脏器病变,因肺含有丰富的结缔组织和血管,因此肺组织受累几率增加,RA肺病变会侵及肺、胸膜等,而侵及肺易导致肺间质纤维化、肺动脉高压等病变,严重危及患者生命[1,2]。随着RA 的发生、发展易出现肺部病变,直接表现为肺功能减低,同时RA患者肺功能降低早于呼吸系统临床表现及胸部X线片异常[9-10],因此,RA患者肺功能检测对于诊断和治疗肺部病变意义重大。RA病程延长,肺受累的机率增高,影响RA患者后期的生活质量[3]。研究表明[4],具有健脾化湿通络功效的中药复方新风胶囊(黄芪、薏苡仁、雷公藤、蜈蚣等组成)能显著提高RA患者肺功能,下调致炎因子TNF-α、上调抗炎因子IL-10及改善肺部症状。为进一步探讨新风胶囊对RA肺功能影响的作用机制,我们观察新风胶囊对佐剂关节炎(AA)大鼠 TGF-β1/Smads信号传导通路的影响,并阐述新风胶囊改善RA肺功能的可能作用机制。
1 材料
1.1 实验动物 清洁级雄性 Wistar大鼠60只,鼠龄8月左右,体质量(200±20.8)g,由南京医科大学实验动物中心提供。
1.2 药品及试剂 新风胶囊(XFC):安徽中医学院第一附属医院制剂中心提供,0.4 g/粒,批号20111203;阳性对照药甲氨喋呤(MTX):上海医药有限公司信谊制药总厂生产,2.5 mg/片,批号20110812;阳性对照药雷公藤多苷片(TPT):上海医科大学红旗制药厂生产,10 mg/片,批号20111002。弗氏完全佐剂(FCA):美国SIGMA公司,批号:098k8732;CD4、CD25单抗:美国 eBioscience公司,批号:11-0140、12-0210;TGF-β1单抗:美国santa cruz公司,批号:SC-146R,Samd3、Samd7 单抗:美国 Life Span公司,批号:LS-C56241、LS-C35742。
1.3 主要仪器 AniRes2003动物肺功能仪:北京贝兰博科技有限公司生产;KMI135型切片机:德国 LEICA公司;DMLB型光镜:德国LEICA公司;Epics XL型流式细胞仪:美国Beckman Coulter公司。
2 方法
2.1 模型复制、分组及给药 大鼠适应性喂养7 d后,随机分为正常对照 (NC)组和模型组,向模型组大鼠右后足跖皮内注射FCA 0.1 ml致炎,复制成AA大鼠模型,并于第18天加强免疫一次[5]。致炎第19天后,将模型组大鼠随机分为4组:模型对照(MC)组、XFC组、MTX组、TPT组,当天给药。各组给药量:XFC组1.2 g·kg-1、TPT 组10 mg·kg-1,每天1 次;MTX组:3 mg·kg-1,每周1次;NC组、MC组给予等容积安慰剂生理盐水灌胃,每天1次,各组连续用药30 d。
2.2 大鼠足跖肿胀度、关节炎指数(AI)测算足趾肿胀度=(Vt-Vn)/Vn×100%(Vn、Vt分别代表造模前后的容积),分别在造模前1 d、致炎后第18天、给药后测量各组大鼠后足跖的容积,计算各组大鼠足跖肿胀度[6]。AI的计算:致炎第12天后开始观察并记录全身关节病变程度,大鼠全身病变按5级评分法评价,根据未注射CFA的其余3只肢体病变程度累积积分,计算出 AI[7]。
2.3 肺功能测定 给药30 d后,用动物肺功能仪测定大鼠肺功能。肺功能测定参数:25%肺活量的最大呼气流量(FEF25)、50%肺活量的最大呼气流量(FEF50)、75%肺活量的最大呼气流量(FEF75)、最大呼气中期流量(MMF)、用力最大呼气流量(PEF)。操作过程:用10%水合氯醛(0.30 ml/100 g)腹腔注射麻醉,于大鼠喉部纵向切开,横向分离肌肉组织,剥离露出气管,将气管呈“T”字形切开后行气管插管,用细绳系紧插管,防止插管脱落;将大鼠置于体描箱内,保持头低位,与动物呼吸机管路相连,行机械通气,使肺扩张以达到气体交换目的,测定肺功能参数;在测定过程中,采用了外加压力的办法,实现负压呼气方式,将二氧化碳排出体外,通过信号调节器,调节呼吸频率范围为260次/min,潮气量为100~150 ml,呼吸比调节为1∶2.5。通过软件分析系统进行数据采集、实时分析控制、曲线动态显示、趋势图、肺功能参数数据转换和存储等。
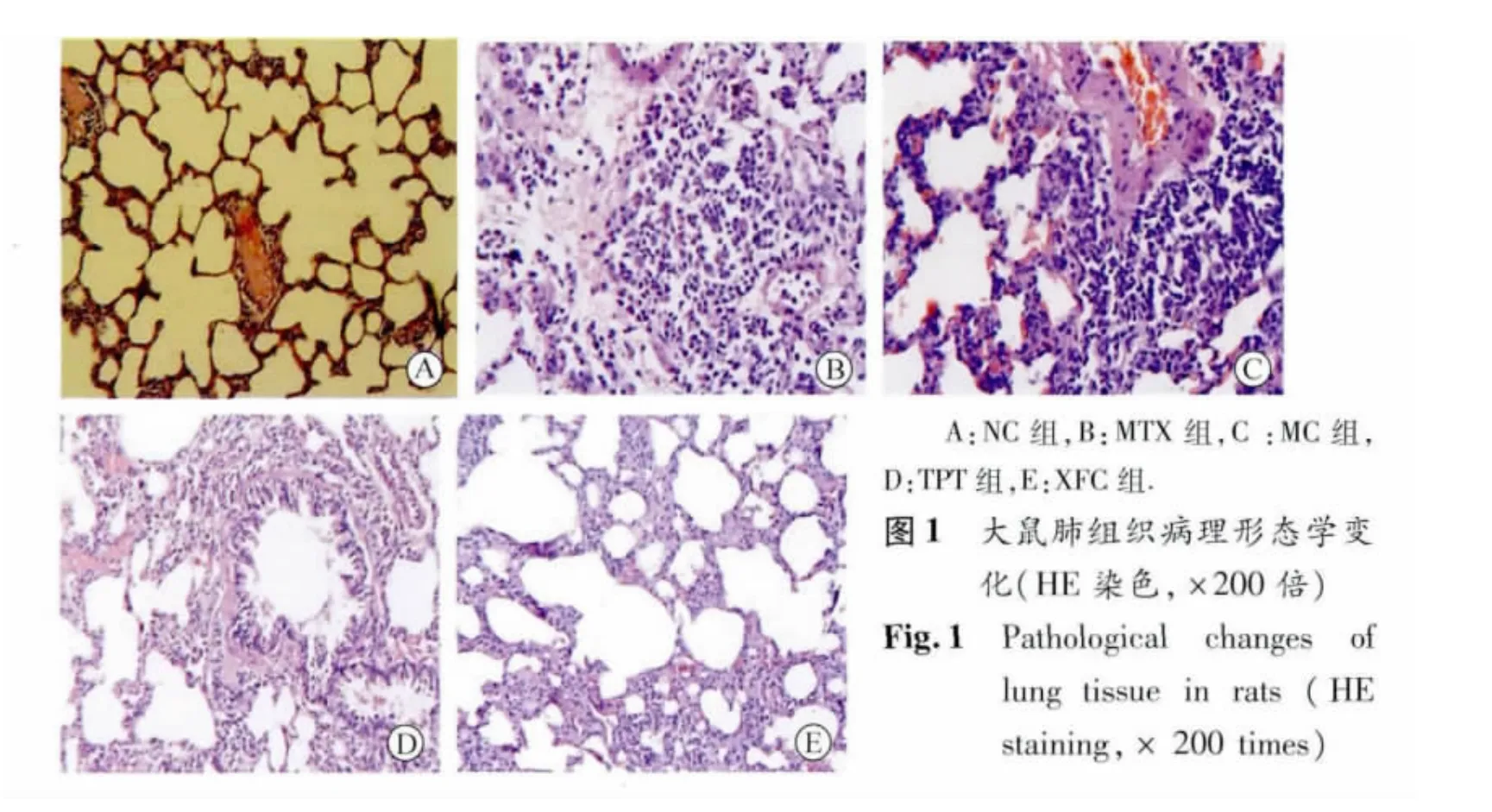
2.4 大鼠肺组织病理形态学观察 将肺组织于多聚甲醛中固定6~8 h后,浸蜡、石蜡包埋并切片,HE染色;光镜观察肺组织病理形态学变化,确定肺泡炎症程度[8]。肺组织无任何病理学改变:无肺泡炎(-);肺泡隔因细胞浸润增宽,病变范围局限在全肺的20%以下:轻度肺泡炎(+);病变范围占全肺的20% ~50%:中度肺泡炎(++);呈弥漫性分布,病变范围大于50%:重度肺泡炎(+++);分别记为0、1、2、3 分。
2.5 CD4+CD25+调节T细胞(Treg)的检测取大鼠外周新鲜血液,将细胞调节每管106个细胞,分别加入 CD4 0.25 μg、CD25 1.0 μg,避光30 min;加红细胞裂解液1 ml,避光30 min;用PBA洗两遍,离心弃上清,加500μL PBA上流式细胞仪检测。
2.6 肺组织 Foxp3、TGF-β1、Smad3、Smad7 检测 参照试剂盒链霉抗生物素蛋白-过氧化酶(SP)法进行操作:一抗 Foxp3、TGF-β1、Smad3、Smad7单克隆抗体用抗体稀释液1∶100稀释,生物素化二抗山羊抗小鼠IgG 1∶500稀释,显色剂为二氨基联苯胺(DAB),阴性对照采用0.01 mol/L PBS液代替一抗进行染色。每张切片任选5个视野,采用图象分析软件Image-pro plus进行图像分析,用积分光密度(IOD)表示Foxp3、TGF-β、Smad3、Smad7 蛋白的表达。免疫组化半定量方法:切片结果按染色强度分为弱(淡黄)、中(黄)、强(棕黄)三等,并分别记为1、2、3分。观察看片,计算各染色强度的细胞所占百分比Pi,据公式H=∑(i±1)×Pi(i:染色强度;Pi各染色强度细胞百分比;H:蛋白表达评分)计算出每张染色片的H值。H值范围为0~400;0分为所有细胞均无染色,400分为所有细胞均为强染色,0~400之间为不同程度的蛋白表达水平.通常H<100为阴性。为消除不同切片染色不一致带来的误差,本实验所有切片均由2名有经验的病理科医师采用双盲法评估算分,每组切片中任选1张用0.01 M PBS液代替一抗进行染色,为阴性对照。
2.7 数据处理 采用SPSS 17.0软件包进行统计学处理,实验数据采用均数±标准差()表示,各组间的数据比较采用单因素方差分析;两两比较采用q检验,检验水准为0.05。
3 结果
3.1 大鼠体质量、足跖肿胀度及关节炎指数的变化 给药前,MC组、MTX组、TPT组、XFC组大鼠足跖肿胀度、关节炎指数显著高于NC组,大鼠体质量明显低于NC组(P<0.05或P<0.01)。给药后,MC组大鼠足跖肿胀度、关节炎指数显著高于NC组(P<0.01);XFC组、MTX组、TPT组大鼠足跖肿胀度、关节炎指数显著低于MC组(P<0.05或 P<0.01);XFC组与其他治疗组比较,大鼠体质量显著升高(P<0.01)。见表1。
3.2 大鼠肺功能的变化 与NC组相比,MC组大鼠肺功能参数 FEF25、FEF50、FEF75、MMF、PEF降低;与 MC 组相比,XFC 组 FEF50、FEF75、MMF、PEF升高;与 XFC组比较,MTX组FEF50、FEF75、MMF、PEF 降低;TPT 组 FEF25、FEF50、FEF75、MMF 降低(P < 0.05 或 P <0.01)。见表2。
表1 各组大鼠体质量、足跖肿胀度及关节炎指数的变化Table 1 Changes of body weight,paw swelling and arthritis index in rats(n=12)
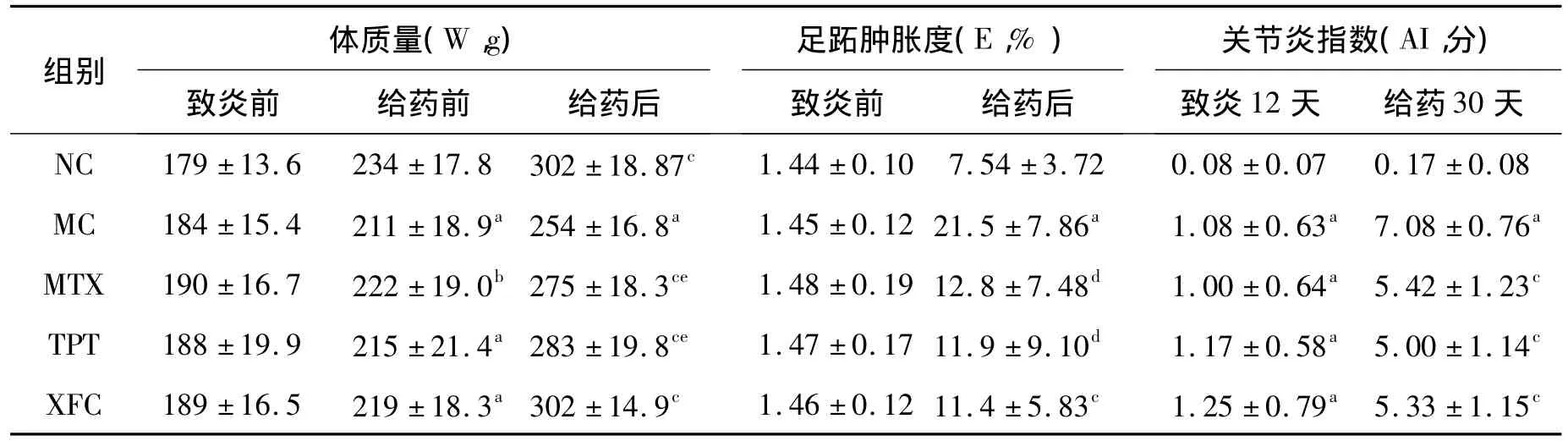
表1 各组大鼠体质量、足跖肿胀度及关节炎指数的变化Table 1 Changes of body weight,paw swelling and arthritis index in rats(n=12)
与 NC组比较,a:P <0.01,b:P <0.05;与 MC 组相比,c:P <0.01,d:P <0.05;与 XFC 组比较,e:P <0.01.
体质量(W,g)足跖肿胀度(E,%)关节炎指数(AI,分)组别致炎前 给药前 给药后 致炎前 给药后 致炎12天 给药30天1.44 ±0.10 7.54 ±3.72 0.08 ±0.07 0.17 ±0.08 MC 184 ±15.4 211 ±18.9a 254 ±16.8a 1.45 ±0.12 21.5 ±7.86a 1.08 ±0.63a 7.08 ±0.76a MTX 190 ±16.7 222 ±19.0b 275 ±18.3ce 1.48 ±0.19 12.8 ±7.48d 1.00 ±0.64a 5.42 ±1.23c TPT 188 ±19.9 215 ±21.4a 283 ±19.8ce 1.47 ±0.17 11.9 ±9.10d 1.17 ±0.58a 5.00 ±1.14c XFC 189 ±16.5 219 ±18.3a 302 ±14.9c 1.46 ±0.12 11.4 ±5.83c 1.25 ±0.79a 5.33 ±1.15 NC 179 ±13.6 234 ±17.8 302 ±18.87c c
表2 各组大鼠肺功能各参数的变化Table 2 Changes of lung function parameter in rats(n=12)
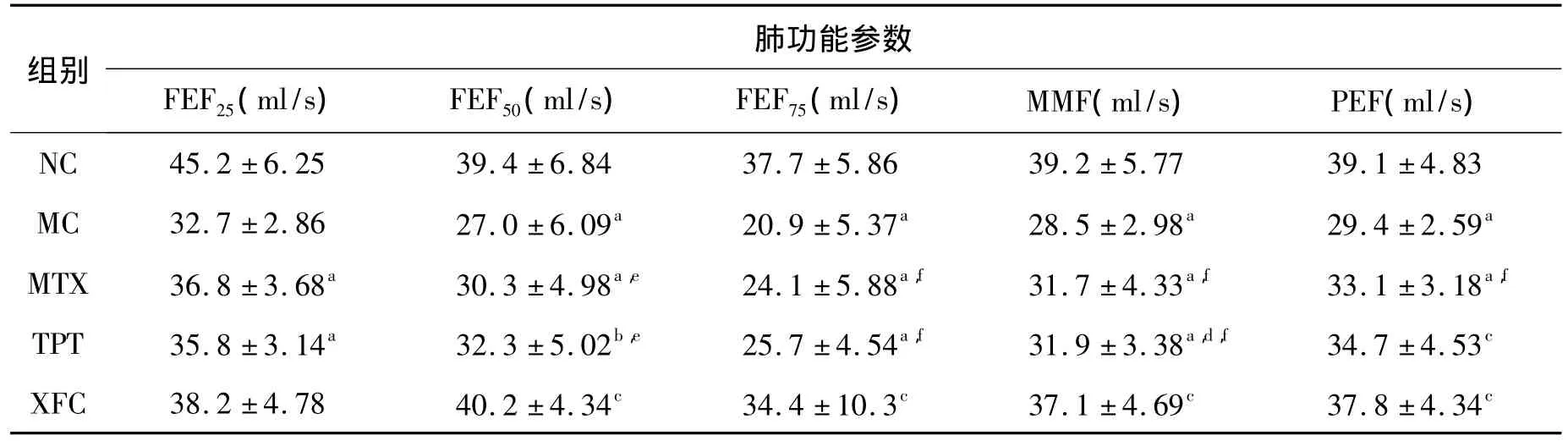
表2 各组大鼠肺功能各参数的变化Table 2 Changes of lung function parameter in rats(n=12)
与NC 组比较,a:P <0.01,b:P <0.05;与MC 组相比,c:P<0.01,d:P <0.05;与XFC 组相比,e:P <0.01,f:P<0.05.
组别肺功能参数FEF25(ml/s) FEF50(ml/s) FEF75(ml/s) MMF(ml/s) PEF(ml/s)9.1 ±4.83 MC 32.7 ±2.86 27.0 ±6.09a 20.9 ±5.37a 28.5 ±2.98a 29.4 ±2.59a MTX 36.8 ± 3.68a 30.3 ±4.98a,e 24.1 ±5.88a,f 31.7 ±4.33a,f 33.1 ±3.18a,f TPT 35.8 ± 3.14a 32.3 ±5.02b,e 25.7 ±4.54a,f 31.9 ±3.38a,d,f 34.7 ±4.53c XFC 38.2 ±4.78 40.2 ±4.34c 34.4 ±10.3c 37.1 ±4.69c 37.8 ±4.34 NC 45.2 ±6.25 39.4 ±6.84 37.7 ±5.86 39.2 ±5.77 3 c
3.3 大鼠肺泡炎积分、外周血Treg及肺组织Foxp3变化 与NC组比较,MC组大鼠肺泡炎积分升高,外周血 CD4+CD25+Treg、肺组织Foxp3表达降低(P<0.01)。与MC组相比,各治疗组肺系数、肺泡炎积分降低,CD4+CD25+Treg、肺组织 Foxp3升高(P<0.05或 P<0.01)。与XFC组相比,阳性对照药 MTX组CD4+CD25+Treg表达降低(P <0.05)。见表3,图1。
表3 各组大鼠肺泡炎积分、Treg、Foxp3的变化Table 3 The changes of alveolitis integral,Treg,Foxp3 in rats(n=12)
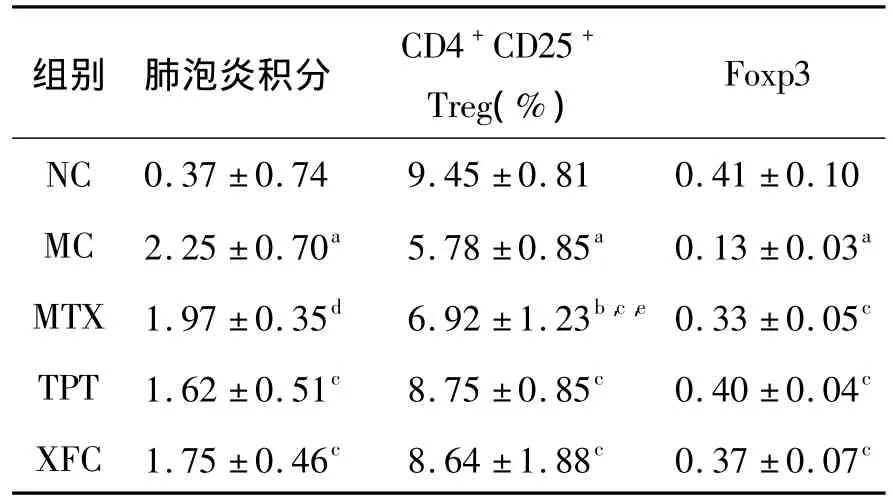
表3 各组大鼠肺泡炎积分、Treg、Foxp3的变化Table 3 The changes of alveolitis integral,Treg,Foxp3 in rats(n=12)
与 NC组比较,a:P <0.01,b:P <0.05;与 MC 组相比,c:P <0.01,d:P <0.05;与 XFC 组比较,e:P <0.05.
组别 肺泡炎积分 CD4+CD25+Treg(%)Foxp3 NC 0.37 ±0.74 9.45 ±0.81 0.41 ±0.10 MC 2.25 ±0.70a 5.78 ±0.85a 0.13 ±0.03a MTX 1.97 ±0.35d 6.92 ±1.23b,c,e 0.33 ±0.05c TPT 1.62 ±0.51c 8.75 ±0.85c 0.40 ±0.04c XFC 1.75 ±0.46c 8.64 ±1.88c 0.37 ±0.07c
3.4 大鼠肺组织 TGF-β1/Smads信号通路的变化 MC组大鼠肺组织TGF-β1、Smad3升高,Smad7降低;药物干预后,TPT组、XFC组肺组织 TGF-β1、Smad3降低,Smad7升高,MTX 组Smad7升高(P<0.05或 P<0.01)。XFC 组与MTX组、TPT组之间比较无显著差异(P>0.05)。见表4,图2。
表4 各组大鼠肺组织 TGF-β1、Smads、Smad7蛋白的变化Table 4 Changes of TGF-β1,Smads,Smad7 protein of lung tissue in rats(IOD,n=12)
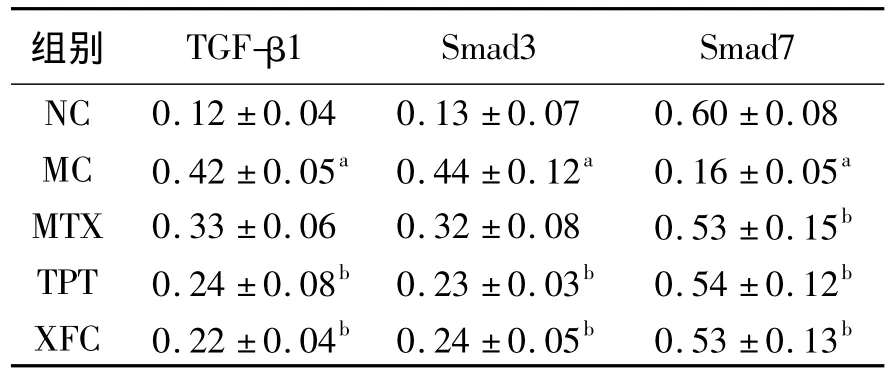
表4 各组大鼠肺组织 TGF-β1、Smads、Smad7蛋白的变化Table 4 Changes of TGF-β1,Smads,Smad7 protein of lung tissue in rats(IOD,n=12)
注:与NC组比较,a P<0.01;与 MC组相比,b P<0.01.
组别 TGF-β1 Smad3 Smad7 NC 0.12 ±0.04 0.13 ±0.07 0.60 ±0.08 MC 0.42 ±0.05a 0.44 ±0.12a 0.16 ±0.05a MTX 0.33 ±0.06 0.32 ±0.08 0.53 ±0.15b TPT 0.24 ±0.08b 0.23 ±0.03b 0.54 ±0.12b XFC 0.22 ±0.04b 0.24 ±0.05b 0.53 ±0.13b
4 讨论
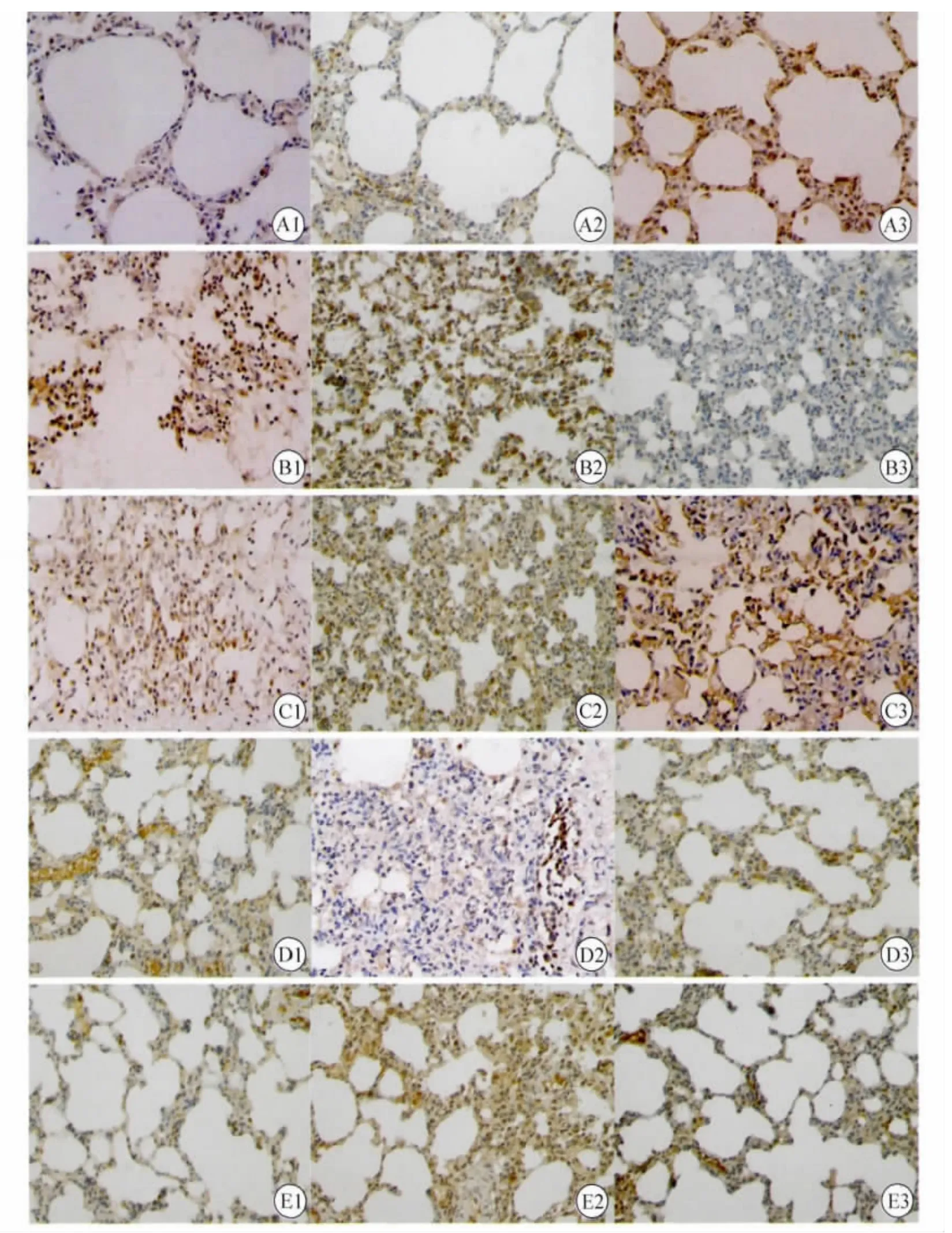
图2 各组大鼠肺组织TGF-β1、Smad3、Smad7蛋白表达(SP,×200倍)Fig.2 Expressions of TGF-beta1,Smad3,Smad7 protein of lung tissue in rats(SP,× 200 times)
肺功能参数中MMF、PEF反映的是通气功能,而 FEF25、FEF50、FEF75反映气道功能。本组研究结果显示,AA模型组大鼠足跖肿胀度、关节炎指数、肺泡炎积分升高和肺部病理形态学改变,佐剂致炎后,大鼠在出现关节炎症同时,其肺功能参数水平 FEF25、FEF50、FEF75、MMF、PEF降低,说明炎症的刺激进一步导致免疫复合物的沉积,诱导出现肺部病变,出现肺功能降低和损害。而进一步研究发现,AA大鼠肺组织TGF-β1、Smad3蛋白表达明显升高,Foxp3蛋白、Smad7蛋白表达降低,同时,AA大鼠外周血CD4+CD25+Treg降低。提示Treg及其表面标志物Foxp3可能参与肺功能降低的过程,Treg、Foxp3表达水平低下,出现免疫耐受降低,不能维持和调节正常的免疫功能,导致对TGF-β1/Smads通路调节功能紊乱。而TGF-β1/Smads通路表达失衡,TGF-β1水平过高会进一步加重炎症对肺组织的刺激,从而最终导致肺功能降低。这与我们前期研究相似。通过新风胶囊干预后,AA大鼠体质量明显提高,肺功能参数FEF50、FEF75、MMF、PEF 改善,同时 AA 大鼠足跖肿胀度、关节炎指数、肺泡炎抑制。表明新风胶囊不但能改善AA大鼠关节炎症反应,而且能提高肺功能水平和抑制肺泡炎的发生。进一步研究发现,新风胶囊组中肺组织TGF-β1及Smad3蛋白表达降低的同时,Smad7及调节T细胞的表面标志物Foxp3蛋白的表达升高,提示新风胶囊可能是通过上调Foxp3的表达,促使 CD4+CD25-T细胞活化,活化的 CD4+CD25-T细胞进一步向CD4+CD25+T细胞转换[11]。同时,通过下调 TGF-β1的表达抑制炎症进一步发生,活化CD4+CD25+T细胞协同TGF-β1进一步激活 TGF-β1/Smads信号传导通路,降低胶原的表达和分泌,维持免疫耐受和组织(肺等)的修复。
TGF-β会促进炎症发展,且在炎症部位活性增强,使成纤维细胞大量增殖,导致AA大鼠关节肿大,严重的出现肺间质纤维化。TGF-β功能的发挥依赖于Smads蛋白的信号转导及调控[12-14]。Ⅰ型 TGF-β 受体(TβRⅠ)被 TGF-β激活后能磷酸化 Smad3蛋白,磷酸化的 RSmad3与C-Smad3形成寡聚合物后进入细胞核内,与其它转录因子共同调节靶基因的转录,而Smad7是TGF-β信号转导途径的主要抑制性调控蛋白,能够与TβRⅠ牢固结合,阻止 TβRⅠ磷酸化 Smad3蛋白,终止 TGF-β的信号传导,从而阻止了炎性反应的持续,造成对肺和关节等组织脏器的损伤。CD4+CD25+Treg是一种重要的调节性 T细胞,它来源于胸腺的CD4+CD25-T细胞。CD4+CD25+Treg具有免疫无能性和免疫抑制性两大功能特征。而Foxp3是CD4+CD25+Treg表面特异性标志,在CD4+CD25+Treg的生长发育和功能发挥、维持机体免疫耐受和免疫应答稳定起重要作用[15]。关于调控Foxp3表达的细胞因子最有争议的是TGF-β,有研究者在体外培养 CD4+CD25-Treg,并与 TGF-β、IL-2、TCR 及 CD28 混合培养,可诱导Foxp3的表达及激活免疫抑制物的产生[16]。
新风胶囊其主要成分为黄芪、薏苡仁、雷公藤、蜈蚣等,以益气健脾、化湿通络诸法联用,具有抗炎、消肿、镇痛作用[17]。其中黄芪富含黄酮、多糖、甙类和多种氨基酸,因此能增强免疫功能,调节糖代谢,加速受损组织修复。而且黄芪能够显著降低肺系数及肺组织匀浆脂质过氧化物含量,组织学检查表明,黄芪组能明显减轻博来霉素所致的肺损伤大鼠,说明黄芪对博来霉素致肺损伤有保护作用[18]。雷公藤具有免疫抑制作用,可抑制RA患者体内异常免疫反应,研究发现雷公藤多甙能改善肺泡炎和纤维化,雷公藤T4单体也可减轻肺泡炎和肺纤维化程度,雷公藤毛单体腹腔注射对肺纤维化模型大鼠肺组织病理及肺羟脯氨酸含量也有影响,结果表明雷公藤毛单体可使肺泡炎和肺纤维化程度有所减羟,并使肺羟脯氨酸含量下降,说明其单体具有一定的抗肺纤维化的疗效[19]。浸出物能抑制人中性粒细胞产生活性氧,并显著抑制中性粒细胞、淋巴细胞膜的甲基转移酶、磷脂酶A2和前列腺素E2的分泌。黄芪、薏苡仁与雷公藤相配一方面可以调节免疫,另一方面可以防止雷公藤免疫抑制造成机体免疫功能过于低下。
TGF-β 在体内能使 Treg 增殖[20],而我们研究发现,在AA大鼠肺组织中TGF-β1表达水平升高,而大鼠血液中调节T细胞降低,可能是由于血液中大量TGF-β1游离至组织中,使血液中TGF-β1水平降低,从而不能促进CD4+CD25-T细胞的增殖,抑制了CD4+CD25+Treg的表达。因此,我们将进一步研究血液中TGF-β1表达水平的含量,并探讨其与CD4+CD25+-Foxp3+Treg表达的关系。
[1]MORI S,KOGA Y,SUGIMOTO M.Different risk factors between interstitial lung disease and airway disease in rheumatoid arthritis[J].Respir Med,2012,106(11):1591-1599.
[2]WASSMUTH R,WAGNER U.Prognostic use of human leukocyteantigen genotyping for rheumatoid arthritis susceptibility,diseasecouse,and clinical stratification[J].Rheum Dis Clin North Am,2002,28(1):13-37.
[3]LIU Jian,FAN Haixia,YANG Meiyun(刘 健,范海霞,杨梅云).Effects of Xinfeng capsule and it's influence on pulmonary function and life quality of patients with rheumatoid arthritis [J].Chin Archives TCM(中华中医药学刊),2007,25(10):2061-2063.(in Chinese)
[4]LIU Jian,WAN Lei,FENG Yun-xia,et al(刘 健,万 磊,冯云霞,等).Investigate the treatment of rheumatoid arthritis reduced lung function and collaterals Jianpihuashitang[J].T Clin Med TCM(中医药临床杂志),2011,23(6):471-473.(in chinese)
[5]XIONG Guolin,HUANG Haixiao,XIE Ling,et al(熊国林,黄海潇,谢玲,等).The reproduction of an improved model of rheumatoid arthritis in rats[J].J Med Chin People's Liberation Army(解放军医学杂志),2007,32(2):121-123.(in Chinese)
[6]XU Shuyun,BIAN Rulian,CHEN Xiu(徐叔云,卞如濂,陈 修).Pharmacological experimental methodology(药理实验方法学)[M].3rd edition.Beijing:The people's medical publishing house,2002:919-921.(in Chinese)
[7]ZHANG Juntian(张钧田).Modern pharmacology experiment methods(现代药理实验方法)[M].Beijing:Beijing medical college and Beijing union medical college joint publishing house,1998:1383.(in chinese)
[8]SZAPIEL S V,ELSON N A,FULMER J D,et al.Bleomycin-induced interstitial pulmonary disease in the nude,athym-icmouse [J].Am Rev Respir Dis,1979,120(4):893-899.
[9]BERGSTR M U,JACOBSSON LT,NILSSON J,et al.Pulmonary dysfunction,smoking,socioeconomic status and the risk of developing rheumatoid arthritis[J].Rheumatology(Oxford),2011,50(11):2005-2013.
[10]SKARE T L,NAKANO I,ESCUISSIATO D L,et al.Pulmonary changes on high-resolution computed tomography of patients with rheumatoid arthritis and their association with clinical,demographic,serological and therapeutic variables[J].Rev Bras Reumatol,2011,51(4):325-30,336-337.
[11]LIU Jian,WAN Lei,LIU Lei,et al(刘 健,万磊,刘 磊,等).The effect of Chinese medicine Xinfeng capsule on pulmonary function in patientswith rheumatoid arthritis[J].Chinese Journal of Clinical Healthcare(中国临床保健杂志),2011,14(2):113-116.(in Chinese)
[12]LAN H Y,CHUNG A C.TGF-β/Smad signaling in kidney disease [J].Semin Nephrol,2012,32(3):236-243.
[13]ZI Z,CHAPNICK D A,LIU X.Dynamics of TGF-β/Smad signaling [J].FEBS Lett,2012,586(14):1921-1928.
[14]ZHAN Jing,WU Huiling,FENG Jianying(詹静,吴慧玲,冯剑颖).Expression of BMP/Smad signal transduction pathway leading rabbit mandibular condyle [J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2006,35(5):485-490.(in Chinese)
[15]CAI Yongjun,SUN Wenji(蔡永君,孙文佶)Progress in regulatory T cells research [J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2006,35(5):568-572.(in Chinese)
[16]CHEN W,JIN W,HARDEGEN N,et al.Conversion of peripheralCD4+CD25-naive T cells to CD4+CD25+regulatory T cells by TGF-beta induction of transcription factor Foxp3 [J].J Exp Med,2003,198(12):1875-1886.
[17]LIU Jian,WAN Lei,SHENG Changjian,et al(刘健,万 磊,盛长健,等).Pulmonary function of patients with rheumatoid arthritis and Xinfeng Capsule influence[J].T Clin Med TCM(中医药临 床 杂 志),2010,22(9):798-802.(in Chinese)
[18]WANG Yongsheng,XU Xiaoya,YANG Bo,et al(王永生,徐小雅,杨 波,等)Study on the Therapeutical effect of astragaloside IV on bleomycin-induced lung fibrosis in rats [J].Modern Preventive Medicine(现代预防医学),2012,39(12):3090-3092.(in Chinese)
[19]YANG Sufang,QIU Songping,LIN Jingyu,et al(杨素芳,邱颂平,林静瑜,等).Tripterygium glycosides intervention effect on pulmonary fibrosis in rats[J].Fujian University of Traditional Chinese Medicine(福建中医药大学学报),2011,21(3):36-39.(in Chinese)
[20]CHEN Z F,XU Q,DING J B,et al.CD4+CD25+Foxp3+Treg and TGF-beta play important roles in pathogenesis of Uygur cervical carcinoma[J].Eur J Gynaecol Oncol,2012,33(5):502-507.

