超高效液相色谱串联质谱法同时快速测定牛奶中不同类型的11种兽药残留
方慧文,卢跃鹏,周 原,江小明,杨 永
(武汉产品质量监督检验所 国家饮料及粮油制品质量监督检验中心(武汉),湖北 武汉 430048)
四环素类、青霉素类、磺胺类和泰乐菌素常被用于治疗动物生长过程中的疾病,同时也造成这些药物在动物细胞、组织、器官或可食性产品(蛋、奶)中的残留,直接影响人体健康。兽药残留的分析方法主要有微生物法[1-2]、高效液相色谱法[3-6]、气相色谱质谱法[7-9]、液相色谱串联质谱法[10-13]等。同时测定多类兽药残留的难点在于兽药种类多,性质相差较大,导致前处理方法因不能兼顾每种药物而使回收率、定量下限等无法满足测定要求,此外,基质效应也给方法的建立带来困难。由于以上原因,导致目前已报道的多类兽药同时测定的方法[14-15]中前处理方法多较为复杂。近年来,灵敏度非常高的超高效液相色谱串联质谱仪的问世,为简单快速、能够同时测定多类兽药残留的前处理方法的建立提供了可能。
本文利用超高效液相色谱串联质谱仪高灵敏度的特点,建立了测定牛奶中四环素类、青霉素类、磺胺类和泰乐菌素的分析方法,该方法最大限度地减少了前处理过程中目标物的损失和基质效应的影响,获得了良好的测定结果,方法前处理简单,试剂消耗少,测定时间短,结果准确可靠,已成功用于牛奶中四环素类、青霉素类、磺胺类和泰乐菌素的测定。
1 实验部分
1.1 仪器与试剂
API5500 QTRAP型串联质谱仪(美国AB公司);Agilent 1290超高效液相色谱仪(美国Agilent公司);Milli-Q超纯水器(美国Millipore公司);超声波清洗仪(上海科导公司);3-18K型冷冻离心机(德国Saitorius公司)。
土霉素、金霉素、四环素、青霉素G、氨苄青霉素、磺胺嘧啶、磺胺噻唑、磺胺甲基嘧啶、磺胺二甲嘧啶、磺胺间甲氧嘧啶、泰乐菌素均购自德国Dr.Ehrenstorfer公司;实验用水为经Milli-Q净化的超纯水;甲醇(HPLC级,德国Merck公司);甲酸(美国Tedia公司);其它试剂均为分析纯。
1.2 标准储备溶液与工作溶液的配制
准确称取适量的各兽药标准物质,用乙腈溶解并定容至100 mL容量瓶中,配制成100 mg/L的混合标准储备液(4℃冷藏保存)。使用时准确移取混合标准储备液1.00 mL于100 mL容量瓶中并用乙腈定容,配成1.00 mg/L的混合标准溶液,再用起始流动相逐级稀释成适当浓度的混合工作溶液。
1.3 仪器条件
色谱条件:色谱柱为Eclipse XDB-C18(100 mm×2.1 mm,1.8 μm);流动相为5 mmol/L甲酸溶液(A)和甲醇(B),梯度洗脱程序:0~5.0 min,90%~10%A;5.0~7.0 min,10%A;7.0~7.1 min,10%~90%A;7.1~10.0 min,90%A;流速为0.2 mL/min;柱温40℃;进样量5 μL。
质谱条件:离子源为ESI(+),检测方式为多反应检测(MRM),喷雾电压为5 500 V,离子源温度为500℃,源内气压力为50 psi,辅助加热气压力为60 psi,气帘气压力为35 psi,驻留时间为20 ms。
1.4 样品处理
准确称取牛奶样品5.0 g(精确至0.01 g)于50 mL的离心管中,加入10 mL乙腈溶液,超声提取10 min,提取液过0.2 μm滤膜后,用起始流动相稀释10倍后上机测定。
2 结果与讨论
2.1 前处理条件的选择
2.1.1 提取溶剂的选择 乙腈是一种中等极性的提取溶剂,与大部分兽药的极性较接近。此外,牛奶的主要成分为水(含量在86%~89%之间),其它成分主要有干物质、脂肪、蛋白质、乳糖等,乙腈具有沉淀蛋白的作用,在提取牛奶中残留兽药的同时,可沉淀牛奶中的蛋白质,离心后即可除去蛋白质和部分固形物,达到净化的效果,操作简便、快捷。因此,本文选择乙腈作为提取溶剂,并考察了牛奶与乙腈的体积比分别为1∶1、2∶3、1∶2时,牛奶中蛋白的沉淀量。结果发现:当牛奶与乙腈的体积比为1∶2时,经离心分离后,样品溶液澄清透明,蛋白质几乎沉淀完全。
2.1.2 净化方法的选择 超高效液相色谱串联质谱仪灵敏度非常高,采用稀释提取液的净化方法,可以简化前处理过程,避免复杂前处理过程中目标物的损失,同时也降低了基质效应对测定结果的影响。随着稀释倍数的增加,基质效应对测定结果的影响逐渐减小甚至消失,但会急剧降低方法的定量下限,因此,必须确定最佳稀释倍数。本文用起始流动相将添加浓度为10.0 μg/kg(四环素类添加浓度为150 μg/kg)的样品提取液分别稀释2、5、8和10倍后上机测定,当稀释倍数增加但峰面积基本不变时即为最佳稀释倍数。稀释样品中各目标物与原样品中对应的目标物峰面积的比值见表1。
由表1可见,随着稀释倍数的增加,磺胺二甲嘧啶和磺胺间甲氧嘧啶的峰面积逐渐减小,而泰乐菌素的峰面积逐渐增大,其它几种兽药的峰面积基本保持稳定。表明牛奶基质对磺胺二甲嘧啶和磺胺间甲氧嘧啶的响应存在增强效应,对泰乐菌素的响应存在抑制效应,当稀释倍数达到10时,3种目标物的峰面积趋于稳定,基质效应基本消除,因此选择最佳稀释倍数为10倍。
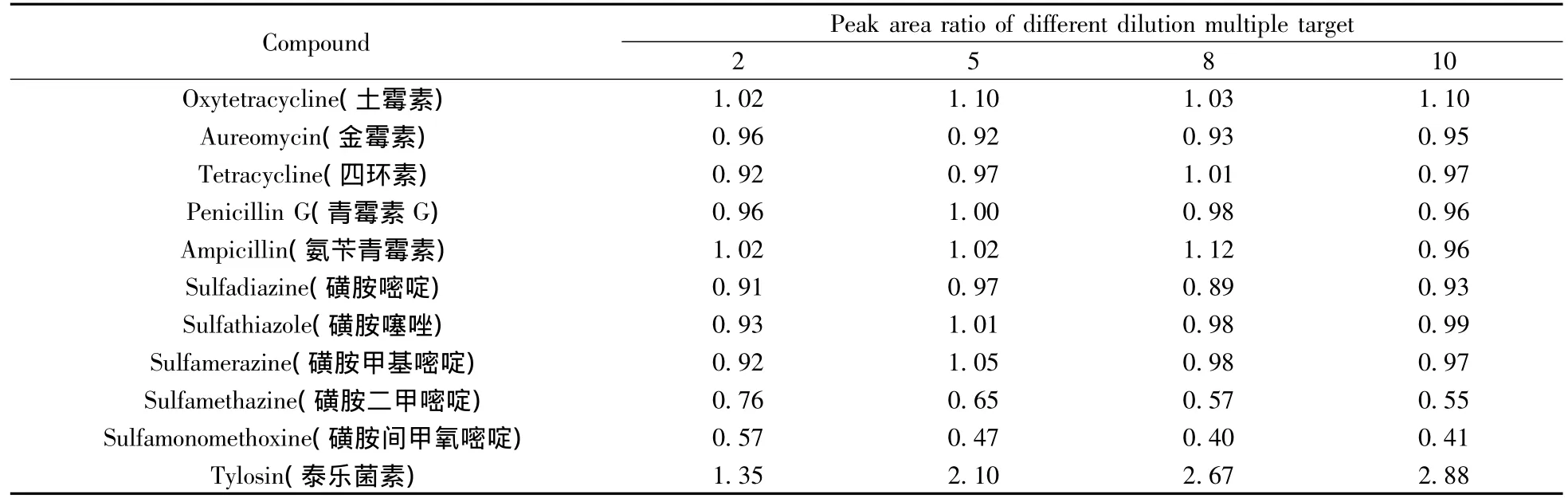
表1 基质效应对11种兽药测定结果的影响Table 1 Matrix effect on the determination results of 11 veterinary drugs
2.2 仪器条件的优化
本文的前处理将样品进行了稀释,因此,需通过优化色谱和质谱条件提高各兽药的响应,从而降低方法的定量下限,使之满足检测标准的要求。本文采用内径为2.1 mm的C18液相色谱柱,以提高柱容浓度;采用梯度洗脱的方式,使绝大多数目标物在较高的有机相中流出,以提高其响应;在流动相中加入0.1%甲酸以提高目标物的离子化效率。最终确定的色谱条件见 “1.3”。
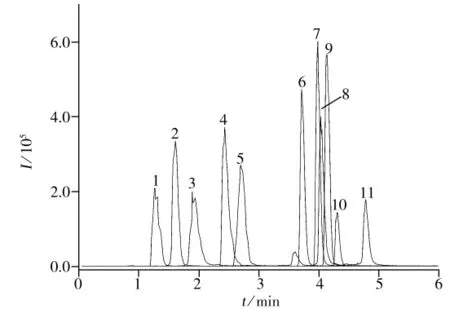
图1 11种兽药的MRM谱图Fig.1 MRM chromatogram of 11 veterinary drugs the numbers denoted were the same as those in Table 2
ESI+离子化模式下,在适当质荷比范围内分别对11种兽药作Q1全扫描,通过优化溶剂和去簇电压,找到了11种兽药分子的[M+H]+母离子。然后采用子离子扫描模式,通过优化碰撞能、去簇电压、入口电压等确定各对离子的最佳质谱参数(见表2)。在以上仪器条件下,对11种兽药标样进行测定,其MRM谱图如图1所示,出峰顺序(保留时间)见表2。
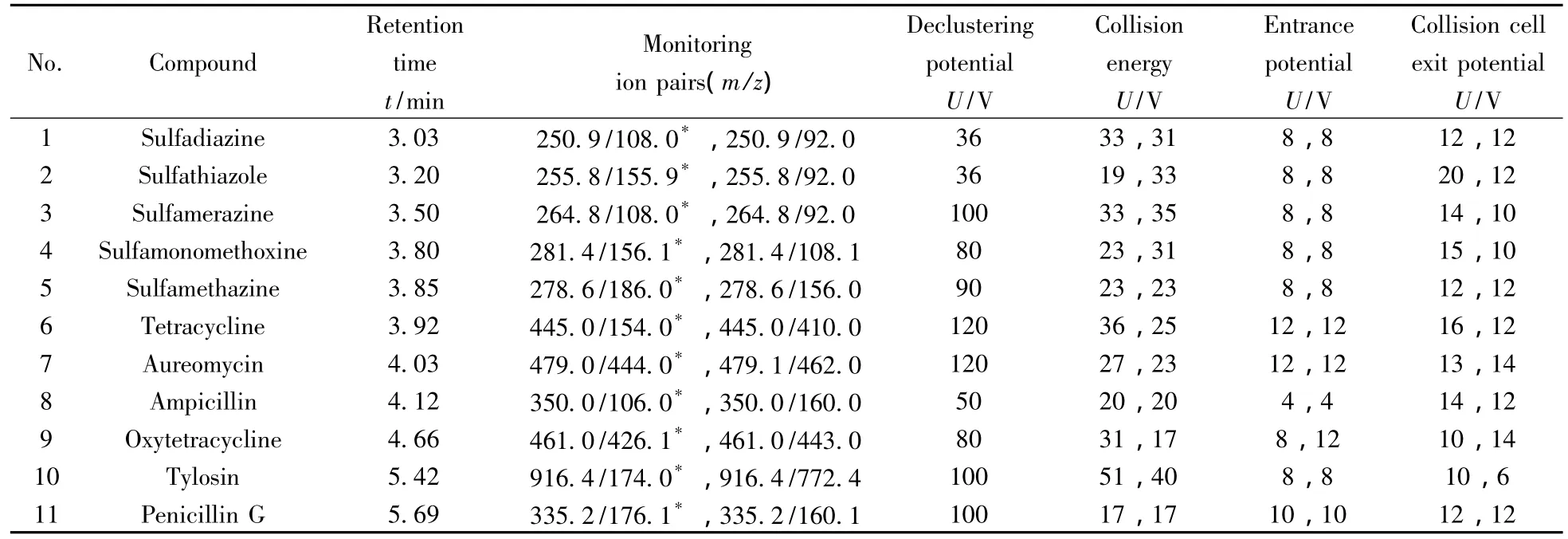
表2 11种兽药的质谱分析参数Table 2 MS parameters for 11 veterinary drug analysis
2.3 线性范围与定量下限
分别配制11种兽药的系列混合标准工作溶液,在最佳实验条件下进行测定,以定量离子对的峰面积为纵坐标(Y),质量浓度为横坐标(X)绘制工作曲线,计算得到其线性方程、相关系数、线性范围,以低浓度样品连续进样计算得到定量下限(S/N=10),结果见表3。由表3可以看出,11种兽药在各自的线性范围内线性关系良好,线性系数均大于0.998,定量下限为0.3~15 μg/kg。

表3 11种兽药的线性方程、线性范围、相关系数(r)、定量下限、加标回收率及相对标准偏差Table 3 Linear equations,linear ranges,correlation coefficients(r),quantitation limits,spiked recoveries and RSDs of 11 veterinary drugs
2.4 加标回收率与精密度
在采集的样品中任意选定1个空白样品进行加标回收率和精密度测定,准确量取空白样品5.0 g共18份,分别添加低、中、高3个浓度标准溶液,每个浓度平行测定6次,测定结果见表3。由表3可见,11种兽药的回收率为81%~117%,相对标准偏差为0.6%~10.2%,表明本文所建立的方法具有可靠的准确度和精密度。
2.5 实际样品的测定
应用本文所建立的方法,对武汉市内采集到的50个批次的牛奶进行测定,在其中4个批次的原奶中检出磺胺二甲嘧啶,含量在60~300 μg/kg之间,未发现其他种类的兽药残留。
3 结论
本文以牛奶中多类兽药残留的同时测定为研究对象,充分利用超高效液相色谱串联质谱仪的高灵敏度,最大限度减少前处理过程中由于目标物性质的较大差异造成的损失以及前处理过程的基质效应对检测的不利影响,成功建立了同时测定牛奶中多类兽药残留的方法,获得了令人满意的测定结果,为多类兽药残留的检测研究提供了一种思路。
[1]Wang Z B,Wang X H,Xu B,Qiao H,Wang F X,Wang S.J.Chin.Inst.Food Sci.Technol.(王忠斌,王向红,徐蓓,乔好,王凤侠,王硕.中国食品学报),2008,8(5):120-125.
[2]Guo Z H,Wang G Q,Wang Y.Chin.J.Vert.Drug.(郭志红,王国青,王艳.中国兽药杂志),2010,44(10):42-45.
[3]Lin J,Lin Y F,Lin L F,Zhao J H,Wu W F.Chin.J.Anal.Lab.(林荆,林奕帆,林立峰,赵建晖,吴文凡.分析试验室),2008,27(12):247-249.
[4]Gao W H,Wang F C,Lü H Y,Luo M,Hu J.Food Sci.(高文惠,王凤池,吕红英,罗敏,胡静.食品科学),2007,28(10):430-432.
[5]Wang J H,Lin L M,Chen C H.J.Instrum.Anal.(王建华,林黎明,陈长法.分析测试学报),2002,21(4):79-81.
[6]Shen X G,Li W C,Liu R,Gu X Y,Yu J X,Zhang J H,Su Y J.J.Instrum.Anal.(沈祥广,李维铖,刘戎,古小燕,余静贤,张嘉慧,苏贻娟.分析测试学报),2012,31(8):945-950.
[7]Wu Y L,Liu S Y,Liu Y J,Shen J Z,Wang H,Shan J H.Chin.J.Anal.Chem.(吴银良,刘素英,刘勇军,沈建忠,王海,单吉浩.分析化学),2006,34:S23-S26.
[8]Gong X H,Xu Y J,Zhang X Z,Xing H Y,Liu Y H,Song L H.Food Sci.(宫向红,徐英江,张秀珍,邢红艳,刘义豪,宋莉辉.食品科学),2009,30(2):168-169.
[9]Wu P G,Chen H H,Wang Q,Ying Y F,Zhao Y X,Song G L,Xu X M.Chin.J.Chromatogr.(吴平谷,陈慧华,王强,应永飞,赵永信,宋国良,徐小明.色谱),2008,26(1):39-42.
[10]Yue Z F,Lin X Y,Tang S B,Chen X X,Ji C N,Hua H H,Liu Y.Chin.J.Chromatogr.(岳振峰,林秀云,唐少兵,陈小霞,吉彩霓,华红慧,刘昱.色谱),2007,25(4):491-495.
[11]Li X Y,Wang H.J.Food Res.Dev.(李小运,王浩.食品研究与开发),2010,31(4):105-107.
[12]Qi S L,Wu M,Yan L J,Wu S H,Zou W,Lin L Y,Zhou Y.J.Instrum.Anal.(齐士林,吴敏,严丽娟,吴抒怀,邹伟,林立毅,周昱.分析测试学报),2009,28(6):677-681.
[13]Bu M N,Shi Z H,Kang J,Fan C L,Pang G F.J.Instrum.Anal.(卜明楠,石志红,康健,范春林,庞国芳.分析测试学报),2012,31(5):552-558.
[14]Wang L,Li Y Q,Wang H B,Guan Y L.Chin.J.Anal.Chem.(王炼,黎源倩,王海波,官艳丽.分析化学),2011,39(2):203-207.
[15]Aguilera-Luiz M M,Vidal J L M,Romero-González R,Frenich A G.J.Chromatogr.A,2008,1205:10-16.

