PARP-1抑制剂ABT-888对依托泊苷诱导A549细胞增殖及凋亡的影响
章 俊 刘赞朝
(贵阳医学院肿瘤医院病理科,贵阳550004)
化疗药物依托泊苷(VP-16)是鬼臼毒素的半合成衍生物,临床上广泛用于治疗急性粒细胞白血病、肺癌等恶性肿瘤[1]。研究表明,依托泊苷为细胞周期特异性药物,它可与DNA拓扑异构酶Ⅱ结合,干扰DNA拓扑异构酶Ⅱ的功能,使DNA复制过程中产生的瞬间链的断裂难以修复,促进细胞凋亡[2,3]。尽管VP-16对于多数肿瘤细胞均有杀伤作用,但其不良反应(骨髓抑制,消化道反应等)较多,限制了它的临床应用,因此探索影响其肿瘤作用的各种相关因素具有十分重要的意义。
聚腺苷二磷酸核糖聚合酶[Poly(ADP-ribose)polymerase,PARP]存在于多数真核细胞中,是当今肿瘤基因治疗的一个新靶点,此酶通过将ADP-核糖单元从烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD+)转移至各种受体蛋白的谷氨酸残基上,在DNA的碱基切除修复过程中发挥重要作用[4]。鉴于此,在肿瘤的临床治疗上产生了一种围绕PARP的治疗策略:PARP抑制剂与DNA损伤类化疗药物联用以抑制由PARP介导的DNA修复,从而增强肿瘤治疗效果,并通过减少用药(或放射)剂量以降低毒副作用[5,6]。临床试验表明该类药物毒副作用小、效果明确且短期耐受性良好,对于癌症治疗前景广阔。
肺癌是我国常见的肿瘤之一,80%以上为非小细胞肺癌,而这些患者中约50%在诊断时已属晚期,加之老年患者合并心肺功能疾病,不能耐受手术,所以化疗是这类癌症患者的主要治疗措施,而效果良好和毒副反应小的药物(或药物联用)是我们的首选。ABT-888是一种强有效的PARP抑制剂,是第三代PARP抑制剂的代表。有研究证实,ABT-888单独使用时即可降低肺癌细胞株H460中克隆基因的存活率,且能够抑制DNA损伤的修复;与替莫唑胺联用时,则可显著增强后者的抗癌活性[7,8]。本研究拟探讨ABT-888与肺癌常用化疗药VP-16联用对非小细胞肺癌细胞A549的增殖与凋亡的影响,并通过彗星实验和Western blot技术观察细胞DNA损伤水平及线粒体凋亡蛋白细胞色素c释放的,以初步探讨二者联用的可能机制,为肺癌的临床治疗提供基础理论依据。
1 材料与方法
1.1 细胞株和试剂 人非小细胞肺癌细胞株A549购买于中国科学院细胞库。胎牛血清、DMEM培养基为Gibco公司产品。依托泊苷为Sigma公司产品。ABT-888为Selleck公司产品。线粒体蛋白提取试剂盒和BCA蛋白定量试剂盒购自碧云天公司。凋亡检测试剂盒购买自杭州联科生物公司。四甲基氮唑蓝(methylthiaLzolyItetraLzolium,MTT)购自Sigma公司。β-actin一抗、细胞色素c一抗和二抗均购于南京巴傲得公司。
1.2 方法
1.2.1 细胞培养 A549细胞用含10%胎牛血清的DMEM培养液培养,于含5%CO2、37℃培养箱内培养。
1.2.2 MTT试验 取对数生长期的细胞制备悬液,以3.0 ×103个细胞(100 μl)接种于 96 孔板,24小时后进行实验。依托泊苷(VP-16)浓度参考本课题组预实验结果及国内其他文献报道,选用5 μg/ml。细胞随机分成5组:①对照组(不加任何处理);②VP-16处理组(5 μg/ml VP-16处理);③VP16+5 μmol/L ABT-888 处理组 (5 μg/ml VP16+5 μmol/L ABT-888 联合处理);④VP16+10 μmol/L ABT-888 处理组 (5 μg/ml VP16+10 μmol/L ABT-888联合处理);⑤VP16+20 μmol/L ABT-888处理组 (5 μg/ml VP16+20 μmol/L ABT-888 联合处理)。每组设4个复孔,孵育24小时后,每孔加入6 mg/ml的 MTT 20 μl,37℃孵育4 小时,弃上清,加入150 μl二甲基亚砜溶解结晶,测定570 nm处的吸光度 OD 值。细胞增殖率 =[实验组 OD值/对照组 OD值×100%]。
1.2.3 流式细胞术检测细胞凋亡 取对数生长期细胞制备悬液,以5×104个细胞接种于6孔板,24小时后进行实验。按1.2.2方法处理细胞24小时后收集细胞,制备5.0×106ml-1单细胞悬液,取100 μl悬液,加入400 μl 1 ×Binding Buffer重悬细胞,分别加入5 μl Annexin V-FITC 和10 μl PI混匀,室温避光孵育15分钟后,由专业技术人员上机检测。其中,存活细胞位于左下象限,早期凋亡细胞集中在右下象限,晚期凋亡细胞集中在右上象限,坏死细胞位于左上象限[9]。
1.2.4 彗星实验检测细胞DNA损伤 取对数生长期细胞制备悬液,以3×104个细胞接种于6孔板,24小时后进行实验。按1.2.2方法处理细胞24小时后收集细胞,参照文献[10]方法,制备悬液,采用三层凝胶法制片,经裂解、电泳后,碘化丙啶(PI)染色,荧光显微镜下观察细胞彗星形态,每个浓度制备3张平行片子,每张片子统计100个彗星样细胞,通过CASP彗星图像分析软件计算彗星图像的头部DNA百分率、尾部DNA百分率、尾矩和Olive尾矩,其中,Olive尾矩是DNA损伤的综合指标,本研究选择Olive尾矩作为评价细胞DNA损伤程度的指标。
1.2.5 Western blot检测细胞线粒体和胞浆中细胞色素c蛋白水平 线粒体蛋白提取及蛋白定量按试剂盒说明书操作。15%SDS-聚丙烯酰胺凝胶中电泳2.5小时,转移至PVDF膜后,一抗4℃孵育过夜后加入辣根过氧化物酶标记的二抗室温孵育1小时,ECL化学发光,采用荧光化学发光凝胶成像分析系统检测蛋白水平变化,用图像分析软件(Image Pro.Plus 4.5)对蛋白条带的灰度进行分析。
2 结果
2.1 MTT检测结果 如图1所示,A549细胞处理24小时后,各组增殖率均显著低于对照组(P<0.01);ABT-888浓度为5 μmol/L时与 VP-16(5 μg/ml)共同处理对A549细胞增殖率的抑制作用较VP-16单独作用稍强,且差异有显著性(P<0.05);当ABT-888 浓度为10 μmol/L和20 μmol/L时与VP-16(5 μg/ml)共同处理对A549细胞增殖率的抑制作用较VP-16单独作用时显著增强(P<0.01)。
2.2 流式细胞术检测结果 如图2所示,A549细胞处理24小时后,各组细胞以早期凋亡为主,且早期凋亡率和晚期凋亡率均显著高于对照组(P<0.01);当ABT-888与VP-16联用时,伴随ABT-888浓度的增加,早期凋亡细胞和晚期凋亡细胞数量百分比随之增加,呈剂量-效应关系,且两种形式凋亡的细胞数量百分比均比VP-16单独作用显著升高(P <0.05)。
2.3 彗星实验检测结果 如图3所示,A549细胞处理24小时后,各组细胞DNA损伤程度相比于对照组均显著增加(P<0.01);ABT-888与VP-16联合处理时,伴随ABT-888浓度的增加,细胞DNA损伤程度随之加重,呈量效关系,且各联合处理组细胞DNA损伤程度均比VP-16单独处理组明显升高(P <0.05)。
2.4 Western blot检测结果 如图4所示,A549细胞被处理24小时后,各组细胞线粒体中cytochrome c水平显著降低,而胞浆中cytochrome c水平则显著升高,与对照组相比有统计学意义(P<0.05)。当ABT-888与VP-16联用时,除(VP-16+5μmol/L ABT-888)组外,其余联合处理组线粒体的 cyto chrome c均显著低于VP-16单独处理组(P<0.05);所有联合处理组细胞胞浆的cytochrome c均显著高于VP-16单独处理组(P<0.01)。
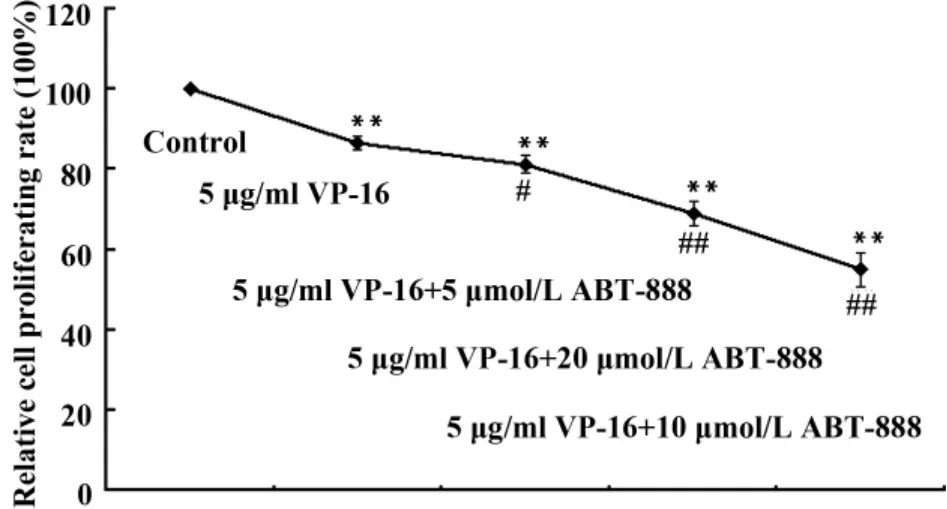
图1 MTT试验分析VP-16和ABT-888处理24小时后A549细胞增殖率的变化Fig.1 MTT assay analyse the cell proliferating ratio of A549 cells after treatment with VP-16 and/or ABT-888 for 24 h
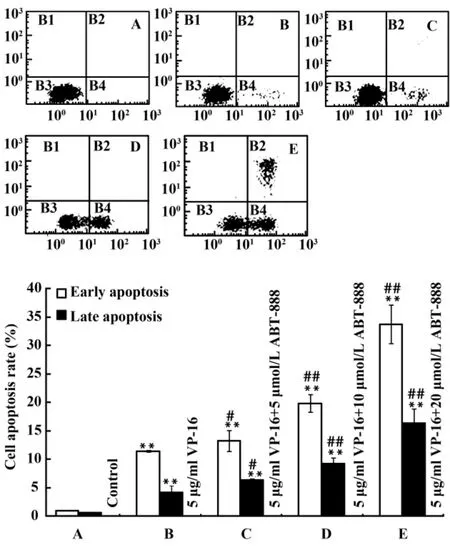
图2 流式细胞术分析VP-16和ABT-888处理24小时后A549细胞凋亡率的变化Fig.2 Flow cytometer analyses the apoptotic ratio of A549 cells after treatment with VP-16 and/or ABT-888 for 24 h
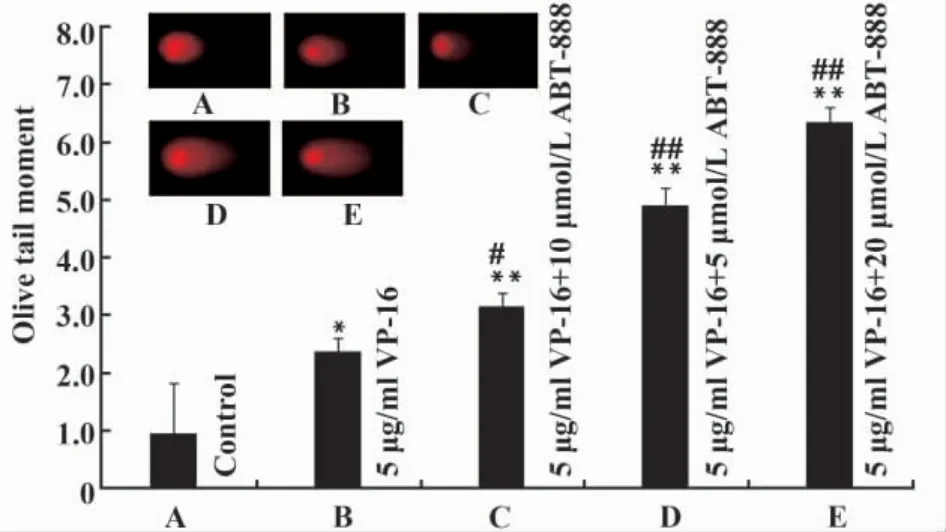
图3 彗星实验分析VP-16和ABT-888处理24小时后A549细胞DNA损伤程度变化Fig.3 Comet assay analyse the DNA damage content in A549 cells after treatment with VP-16 and/or ABT-888 for 24 h
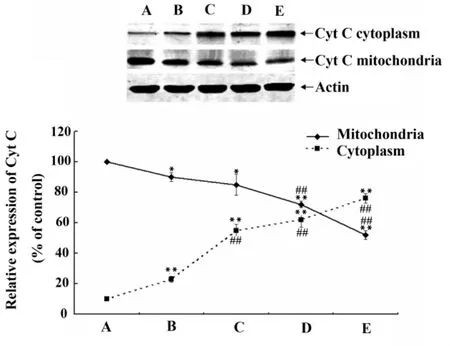
图4 Western blot分析经VP-16和ABT-888处理24小时后A549细胞中cytochrome c在线粒体和胞浆中的分布变化Fig.4 The distribution of cytochrome c in mitochondria and cytoplasm of A549 cells after treatment with VP-16 and/or ABT-888 for 24 h analysed by Western blot
3 讨论
PARP是存在于真核细胞中催化聚ADP核糖化的一种细胞核酶,在DNA修复和凋亡中发挥重要的作用。PARP家族有18个亚型,其中PARP-1占比例最大,发挥着90%以上的功能,在介导DNA损伤修复、消耗细胞能量池从而导致细胞机能障碍和坏死、促进炎症基因转录等方面发挥了重要作用[4]。PARP-1的缺失可使肿瘤细胞对DNA损伤因子易感,这可能与某些肿瘤的发生有关[11],同时,抑制PARP-1可以减少DNA的修复效率,增强肿瘤化疗效果[12]。Nozaki等[13]给予诱癌剂处理,PARP-/-小鼠结肠腺瘤和腺癌、肝脏结节发生率均明显高于正常对照组(PARP+/+),提示PARP-1表达的缺失与结肠肿瘤的发生有关。Nomura等[14]发现,肝癌组织中PARP-1蛋白表达量明显高于邻近非肿瘤组织,提示PARP-1在肝癌组织中的高表达可能与某些肝癌细胞的耐药有关。ABT-888(veliparib)是由Abbott开发的一种强效PARP-1抑制剂,它与替莫唑胺、顺铂、环磷酰胺具有广谱协同作用且耐受性良好,其联合放疗也能明显提升对肿瘤的杀伤作用[4]。通过口服,其在小鼠、猫、犬体内的生物利用度分别达92%、61%和72%[15]。目前ABT-888与其他化疗药物联合应用治疗人类肿瘤的研究也陆续进入了Ⅰ、Ⅱ、Ⅲ期临床阶段。
本研究探讨ABT-888对VP-16诱导的A549细胞增殖和凋亡的影响。结果表明:相对于对照组,VP-16组和VP-16与ABT-888联用组细胞死亡率显著升高;同时,VP-16与ABT-888联用组细胞死亡率亦明显高于VP-16单独作用组,且有明显的量效关系,这提示在本实验体系中,ABT-888的使用增强了A549细胞对化疗药物VP-16的药敏作用。进一步实验结果表明,VP-16组和VP-16与ABT-888联用组细胞DNA损伤均较对照组显著加重,且联用组的DNA损伤水平却明显高于VP-16单独使用组;Western blot结果则反映出VP-16与ABT-888联用组细胞中线粒体细胞色素c的释放明显多于对照组和VP-16单独使用组,由于细胞色素c的释放是线粒体依赖性细胞凋亡的关键事件,因此,结合其他实验结果表明,在本实验中,ABT-888通过抑制PARP活性阻碍了VP-16诱导的DNA损伤的修复,进而促进了后者对线粒体依赖性细胞凋亡的诱导效应,相关分子机制仍有待进一步研究。
本研究结果表明,在5~20 μmol/L浓度范围内的ABT-888可显著增强肺癌细胞株A549对VP-16的药敏作用,为今后肺癌的药物治疗研究提供了一个可能的治疗靶点。
1 Hande K R.Etoposide:four decades of development of a topoisomerase II inhibitor[J].Eur J Cancer,1998;34(10):1514-1521.
2 Yuan X W,Zhu X F,Liang S G et al.Interferonalpha enhances etoposide-induced apoptosis in human osteosarcoma U2OS cells by a p53-dependent pathway[J].Life Sci,2008;82(7-8):393-401.
3 Sunter N J,Cowell I G,Willmore E et al.Role of topoisomerase II-beta in DNA damage response following IR and etoposide[J].J Nucleic Acids,2010;doi:10.4061/2010/710589.
4 韩 炜,钟 俊,王永峰et al.PARP抑制剂用于肿瘤治疗的研究进展[J].Chin J New Drugs,2011;20(12):1086-1092.
5 Peralta-Leal A,Rodriguez-Vargas J M,Aguilar-Quesada R et al.PARP inhibitors:new partners in the therapy of cancer and inflammatory diseases[J].Free Radic Biol Med,2009;47(1):13-26.
6 Chalmers A J.The potential role and application of PARP inhibitors in cancer treatment[J].Br Med Bull,2009;89(9):23-40.
7 Kummar S,Kinders R,Gutierrez M E et al.Phase 0 clinical trial of the poly(ADP-ribose)polymerase inhibitor ABT-888 in patients with advanced malignancies [J].J Clin Oncol,2009;27(16):2705-2711.
8 Trudeau M E,Crump M D,Charpentier et al.Temozolomide in metastatic breast cancer(MBC):a phase II trial of the national cancer Institute of canada-clinical trials group(NCIC-CTG)[J].Ann Oncol,2006;17(6):952-956.
9 Park J W,Yook J M,Ryu H M et al.Phosphate-induced apoptosis in human peritoneal mesothelial cells in vitro [J].Am J Nephrol,2011;34(1):77-86.
10 Corcuera L A ,Arbillaga L,Vettorazzi A et al.Ochratoxin A reduces aflatoxin B1 induced DNA damage detected by the comet assay in Hep G2 cells [J].Food Chem Toxicol,2011;49(11):2883-2889.
11 Dandri M,Burda M R,Burkle A et al.Petersen.Increase indenovo HBV DNA integrations in response to oxidative DNA damage or inhibition of poly(ADP-ribosyl)ation[J].Hepatology,2002;35(1):217-223.
12 Farmer H,McCabe N,Lord C J et al.Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy[J].Nature,2005;434(7035):917-921.
13 Nozaki T,Fujihara H,Watanabe M et al.Parp-1 deficiency implicated in colon and liver tumorigenesis induced by azoxymethane[J].Cancer Sci,2003;94(6):497-500.
14 Nomura F,Yaguchi M,Togawa A et al.Enhancement of poly-adenosine diphosphate-ribosylation in human hepatocellular carcinoma[J].J Gastroenterol Hepatol,2000;15(5):529-535.
15 Donawho C K,Luo Y,Luo Y et al.ABT-888,an orally active poly(ADP-ribose)polymerase inhibitor that potentiates DNA-damaging agents in preclinical tumor models[J].Clin Cancer Res,2007;13(9):2728-2737.