阿魏药酒抗肿瘤作用的初步探讨
赵 贝,李鸿儒,杜钢军,刘伟杰,王莹莹,李佳桓
(河南大学药学院 药物研究所,河南 开封475004)
中药可作用于肿瘤发生、发展的多个环节,其抗肿瘤活性已得到国际公认,为近年来研究的热点[1]。阿魏是我国人民长期应用的中药之一,早在《新修本草》中就有记载[2]。阿魏有特殊的臭气,味苦而辛,有理气消肿、活血消疲、祛痰和兴奋神经的功效[3-4]。近年来,由于发现其中具有植物雌激素活性成分和抗癌物质而备受人们关注。我们实验的目的是在整体、细胞、分子三个水平上探究阿魏药酒的抗肿瘤活性,以期为临床抗肿瘤应用提供指导。
1 材料
1.1 药品与试剂
阿魏(购自开封市天济大药房,经河南大学中药研究室鉴定为真品);阿魏药酒(取阿魏、黄酒以10∶100的比例浸泡1周,纱布过滤,供动物实验使用,无菌过滤滤液供细胞实验使用);CAT测定试剂盒、T-SOD测定试剂盒(南京建成生物工程研究所);Col-I测定试剂盒(进口分装)。
1.2 动物及瘤株
昆明小鼠,雌性,20~26g,河南省医学实验动物中心提供(合格证号:豫动合字101号);H22肝癌,本实验室于昆明小鼠在体传代保存;4T1乳腺癌,BALB/c小鼠在体传代保存。
1.3 仪器
HDL洁净台(北京东联哈尔仪器制造有限公司);ElX 800UV型酶标仪(美国 Bio-Tek公司);TDL-50B台式离心机(上海安亭科学仪器厂);LDZX-75KBS立式压力蒸气灭菌锅(上海申安医疗器械厂);LGR16-W高速冷冻离心机(北京京立离心机有限公司);电子天平FA 1004N(上海精密仪器有限公司);XDS-500D倒置显微镜(上海蔡康光学仪器有限公司);DYY-7C电泳仪。
2 方法
2.1 对H22小鼠肝癌皮下移植肿瘤的影响
将接种10d左右生长良好的H22小鼠腹水稀释成5×106个细胞/mL,以0.2mL/只接种于20只雌性昆明小鼠右腋部皮下,建立H22肝癌皮下移植对照。接种后将小鼠按体质量分为2组,每组10只。对照组:灌胃黄酒;阿魏组:灌胃质量分数为10%的阿魏药酒。实验当天开始以0.2mL/10g给药,1次/d监测小鼠体质量,给药2次,给药间隔为8h,连续25d。肿瘤长出后开始用游标卡尺隔天测肿瘤直径2次,计算瘤体积。实验25d眶静脉取血分离血清用于检测Col-I、T-SOD、CAT,然后处死小鼠,剥离腋部肿瘤、脾脏、胸腺、肝脏并称重,按文献[5]方法计算肿瘤抑制率及脏器指数。
Col-I、T-SOD、CAT检测按试剂盒说明进行,抑瘤率、脏器指数按文献[5]方法进行。
肿瘤体积(cm3)= 肿瘤长度×肿瘤宽度×肿瘤宽度/2;抑瘤率(%)=(正常对照组瘤质量均值-用药组瘤质量均值)/正常对照组瘤质量均值×100%;脏器指数%=脏器体质量/处死当日体质量×100%。
2.2 对血清中过氧化氢酶、肌酸激酶、总超氧化物歧化酶活性的影响
2.2.1 过氧化氢酶测定 过氧化氢酶(CAT)分解过氧化氢的反应可通过加入钼酸铵而迅速中止,剩余的过氧化氢与钼酸铵作用产生一种淡蓝色的络合物,在405nm处测定其生成量,可计算出CAT的活力。
血清中CAT活力(U/mL)=(对照管OD 值-测定管OD 值)×271×1/(60×取样量20μL)×样本测试前稀释倍数。
2.2.2 总超氧化物歧化酶(T-SOD)活力的测定通过黄嘌呤及黄嘌呤氧化酶反应系统产生超氧阴离子自由基,后者氧化羟胺形成亚硝酸盐,在显色剂的作用下呈现紫红色,用可见分光光度计测其吸光度。当被测样品中含SOD时,则对超氧阴离子自由基有专一性的抑制作用,使形成的亚硝酸盐减少,比色时测定管的吸光度值低于对照管的吸光度值,通过公式计算可求出被测样品中的SOD活力。
总SOD活力(U/mL)=(对照管吸光度-测定管吸光度)/对照管吸光度/50%×反应体系的稀释倍数×样本测试前的稀释倍数。
2.2.3 I型胶原酶联免疫检测 采用ELISA试剂盒测定样品中小鼠I型胶原(Col I)的水平。向预先包被了小鼠I型胶原单抗的酶标孔中加入Col I,37℃温箱中温育30min,洗涤后,加入HRP标记过的Col I抗体。再经过温育和洗涤,去除未结合的酶,然后加入底物A、B,产生蓝色,并在酸的作用下转化成最终的黄色显色,10min后加入终止液,于450nm处测其吸光度,根据回归方程计算样品浓度。
2.3 对肿瘤细胞增殖的影响
将4T1小鼠乳腺癌传代细胞用胰酶-EDTA(2∶1)消化液消化,将消化后的细胞用含体积分数为10%小牛血清的DMEM完全培养液调整细胞浓度,吹打成单细胞悬液接种于96孔板,100μL/孔,补充不同浓度阿魏的同样培养基100μL/孔,每孔4个复孔。阿魏的终浓度设为0、0.5、0.25、0.125g/L。设置于体积分数为5%CO2培养箱内37℃条件下培养48h后,弃去药物,加入5g/L的 MTT 100μL/孔,放置4h后甩出 MTT,加入DMSO 100μL/孔,混匀后于酶标仪570nm处测吸光度A,计算抑制率[6]。
抑制率(%)=1-加药组OD值/不加药物组OD值 ×100%。
2.4 对淋巴细胞增殖的影响
取2只昆明小鼠处死,无菌分离脾脏,用D-Hanks缓冲液研磨脾脏,Tris-NH4CL裂解红细胞提取出脾淋巴细胞,用含体积分数为10%小牛血清的DMEM完全培养液稀释,吹打混匀成单细胞悬液。接种于48孔培养板内的6孔作无ConA的对照组,250μL/孔。在细胞悬液中加入0.2g/L ConA 1.42mL,充分混匀后接种于剩余孔内,250μL/孔,补充不同浓度阿魏的同样培养基250μL/孔,每孔3个复孔。阿魏的终浓度设为0、0.5、0.25、0.125g/L。置于体积分数为5%CO2培养箱内37℃条件下培养48h,吸去上清液,每孔加入MTT 250μL,培养4h后用移液器吸出MTT,加入DMSO 250μL/孔,转入96孔板,混匀后于酶标仪570nm测吸光度A。
2.5 对基质金属酶活性的影响
将模具准备安装好后制备灌注分离胶和浓缩胶,待胶凝固后置入电泳槽中,加入电泳缓冲液,取动物实验瘤组织提蛋白,用样品处理液处理后以20μL/孔加样。浓缩时80V,到分离胶时可加大至100V,至溴酚蓝指示剂迁移至下缘时停止电泳。将胶剥离至含0.39mmol/L Triton X-100,50mmoL/L Tris -HCL,5mmoL/L CaCl2的洗脱液中振荡洗脱2次,每次1h,再用漂洗液(除不含Triton X-100外,其余同洗脱液)漂洗2次,20min/次,随即将凝胶置于孵育液中37℃孵育12~16h。孵育结束后经染色液染色4h,倒掉染色剂,清水冲洗,倒入脱色液脱色2~3次至蓝色背景和白色条带清晰为止,结果显示,MMP-2(72KDa)和MMP-9(92KDa)为位于蓝色背景上的透亮带。
2.6 统计学处理
数据均以¯x±s表示,2组间差异性比较采用t检验。P<0.05表示有显著性差异,P<0.01表示有非常显著性差异。
3 结果
3.1 对H22肝癌小鼠体质量、肿瘤及免疫器官的影响
与对照组相比,给药后小鼠体质量下降并不明显,给药期间小鼠状态良好,见图1;阿魏组瘤体积与对照组比较,P>0.05,无显著性差异,但肿瘤生长速度比对照组缓慢,抑瘤率为12.8%,见图2;肝脏指数、胸腺指数均下降,脾脏指数有所升高,但均无显著性差异,见表1。
3.2 对荷瘤小鼠体内抗氧化酶及I型胶原的影响
与对照组比较,给药后小鼠血清中的Col-I表达有特别显著性增强(P<0.01),抗氧化酶活力均有所增强,其中T-SOD的活力有显著性增强(P<0.05),见表2。
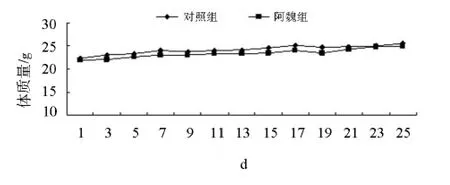
图1 小鼠体质量生长曲线
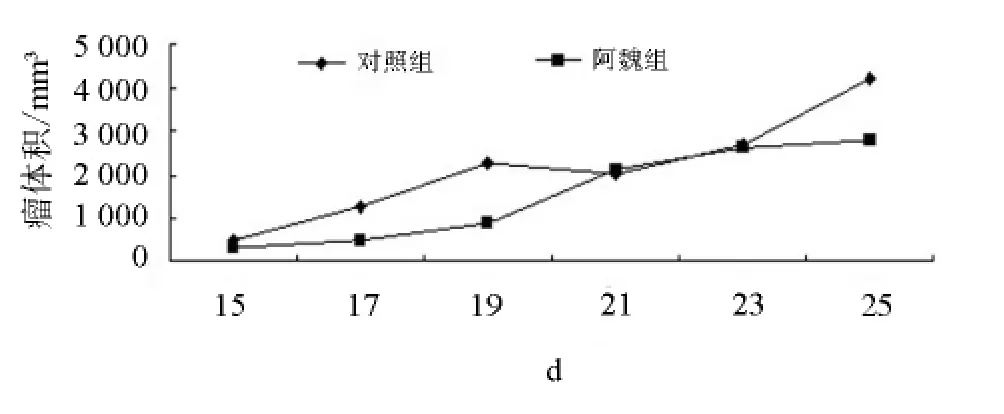
图2 小鼠瘤体积生长曲线

表1 对荷瘤小鼠肿瘤及脏器的影响(¯x±s,n=10)

表2 对荷瘤小鼠血清中酶的影响(¯x±s,n=10)
3.3 对小鼠脾淋巴细胞和4T1乳腺癌细胞的影响
不同浓度的阿魏对小鼠脾淋巴细胞增殖有不同影响,当阿魏浓度为0.25g/L时对淋巴细胞增殖影响最大,见表3。实验各浓度对4T1小鼠乳腺癌细胞生长均无抑制作用,见表4。
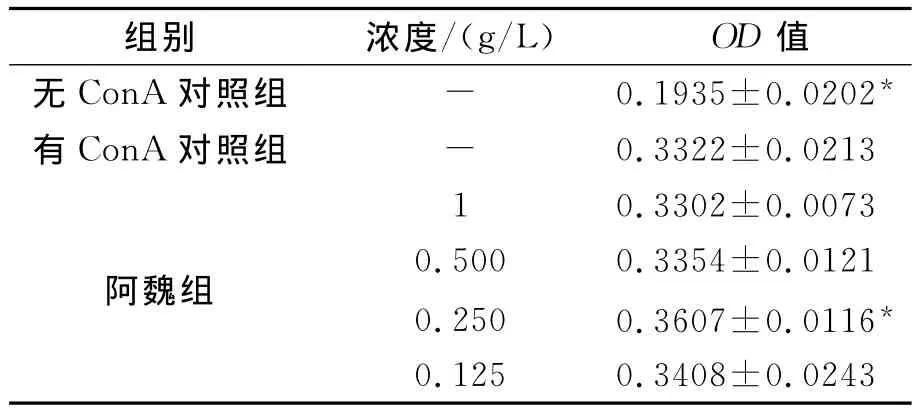
表3 对淋巴细胞增殖的影响
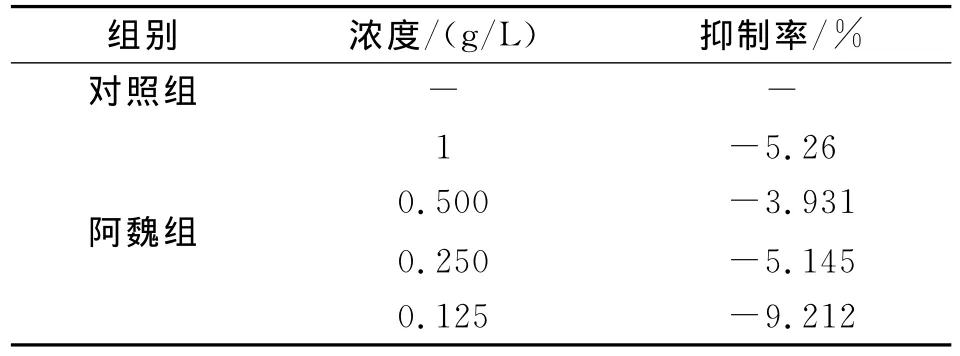
表4 对4T1小鼠乳腺癌细胞的影响
3.4 对基质金属蛋白酶的影响
与对照组相比,72kDa的MMP-2亮度较暗,且面积约为对照组的50%;92kDa的 MMP-9面积与对照组基本相同,但亮度稍低,见图3。

图3 基质金属蛋白酶比较
4 讨论
我们从整体、细胞、分子三个水平进行了阿魏药酒的抗肿瘤活性研究。实验中,阿魏药酒对H22肝癌皮下肿瘤抑瘤效果不明显,抑瘤率仅为12.8%,但小鼠生长状态较好,脏器指数均无显著性差异。考虑到本次实验肿瘤接种时瘤株生长较快的特点,结合阿魏在传统中药中只是一个化痞散结药物,阿魏的抗肿瘤作用可能不是直接的,这可以从细胞试验中阿魏药酒对肿瘤细胞的抑制率均为负值,不仅没有抑制作用,反而表现出促进趋势中得到验证。
肿瘤的侵袭与转移发生的最关键一步是对细胞外基质(ECM)和基底膜(BM)的降解。Col-I是细胞外基质主要成分,大量表达的I型胶原对于肿瘤的转移是抑制的[7]。瘤细胞侵袭转移能力与其诱导产生基质金属蛋白酶(MMP)降解ECM、BM的能力密切相关,其在许多肿瘤中呈高表达[8]。阿魏组Col-I表达显著增多,且在电泳实验中MMP-2条带面积明显小于对照组,MMP-9条带亮度较对照组暗,提示阿魏药酒对肿瘤的浸润与转移有阻止作用。
目前的研究证实,氧自由基水平的增高以及细胞抗氧化酶活性的改变可以导致肿瘤的发生,而肿瘤患者通常也表现出机体氧化还原状态的失衡。实验中对血清抗氧化酶活性的测定显示,阿魏药酒对抗氧化酶活性有影响,给药组小鼠T-SOD、CAT活力均比对照组高。虽CAT无显著性差异,但仍有增高趋势,对TSOD则有显著性影响。说明阿魏药酒具有一定抗氧化能力,可能与阻止肿瘤的浸润转移有一定关系。
综上所述,阿魏药酒对肿瘤的直接抑制作用弱,但可阻止肿瘤的浸润和转移,一定浓度能提高机体免疫能力,有抗氧化作用。体现了消痞散结中药的特点,如与其他抗肿瘤中药联合使用可能更为合理。
[1]黄自丽,黄修燕,郑起.中药抗肿瘤作用及其作用机制研究进展[J].医学综述,2010,5(3):135-140.
[2]谭秀芳,李晓瑾,杜翠玲,等.药用植物阿魏概况及研究进展[J].中国民族民间医药杂志,2006,10(1):123-127.
[3]韩红英,李国玉,王金辉.阿魏化学成分和药理作用的研究现状[J].农垦医学,2010,12(3):76-83.
[4]赵保胜,桂海水,朱寅荻,等.阿魏化学成分、药理作用及毒性研究进展[J].中国实验方剂学杂志,2011,9(17):88-91.
[5]杜刚军,林海红,徐启泰,等.反应停的抗新生血管形成及抗肿瘤作用研究 [J].中国药理学通报,2005,10(21):471-476.
[6]李佳桓,林海红,杜刚军.巴豆不同给药方式对荷瘤小鼠的影响[J].河南大学学报:医学版,2012,31(1):8-11.
[7]邓云,于彬,覃文新,等.胶原样分子与肿瘤关系研究进展[J].生命科学,2009,21(2):276-279.
[8]张海琴,侯明晖,王琳,等.ColⅠ、ColⅣ及Fn与恶性肿瘤关系研究进展[J].青岛大学医学院学报,2009,45(4):401-403.

