鸡胚发育过程四种放射状胶质细胞标记物的对比分析①
杜 蕊 杨慈清 李玲玲 段明慧 卢 习 陈树林 赵善廷
(西北农林科技大学动物医学院,杨陵712100)
禽类视顶盖(Optic tectum)具有明显分层结构,在其层的形成过程中,RGCs对神经元的迁移起着重要作用[1]。禽类神经元(Neuron)的迁移方式主要有2种,分别为放射状迁移(Radial migration)和切向迁移(Tangential migration)[2]。其中神经元的放射状迁移主要有2种方式,依赖于放射状胶质细胞的迁移[3](Glia-guided locomotion)和不依赖胶质细胞的胞体位移式迁移[4](Glia-independent somal translocation)。放射状胶质细胞是一种短暂存在于中枢神经系统(Central nervous system,CNS)发育过程中的细胞,为第一种迁移的神经元提供“脚手架”。BLBP、RC2和Nestin是研究脊椎动物中枢神经系统RGCs的三种常用的标志物。BLBP最先从小鼠的脑中分离获得,是脂肪酸结合蛋白家族(Fatty acid binding protein,FABP)的成员,是一种分子量小、高度保守的细胞质蛋白,它特异表达于发育中的脊椎动物的中枢神经系统中尤其是在发育中的CNS的RGCs及成熟小脑中贝格曼胶质细胞(Bergmann glial cell)[5,6]。RC2 可以识别位于脑室壁可转化为星形胶质细胞的不同水平的RGCs,还可以识别脊髓中的假单极神经元,小脑中贝格曼胶质细胞的前体细胞,以及位于神经上皮中具有放射状双极细胞形态的一类神经元等[7]。Nestin属于第4类中间丝蛋白(Intermediate filament protein,IFP),被认为是一种神经干细胞(Neural stem cell,NSC)的标记物,并且在进化上高度保守[8]。GFAP最早在多发性硬化症(Multiple sclerosis,MS)病人的胶质瘢痕中分离出来[9,10]。目前,GFAP 被认为是星形胶质细胞(Astrocyte)的特异性标志物。在发育中禽类视顶盖结构的研究经常被用来标记胶质细胞,本试验通过对4种标记物在视顶盖发育过程中标记的细胞进行比较,说明这4种胶质细胞的标记物所标记的细胞存在一定差异,该结果可为禽类视顶盖发育过程胶质细胞标记的研究提供理论基础。星形胶质细胞与中枢神经系统的免疫反应关系密切,研究其前体细胞即放射状胶质细胞对于研究免疫反应的机理具有重要理论意义。
1 材料与方法
1.1 材料和仪器 新鲜种鸡蛋(当地种鸡场);一抗Mouse anti RC2 IgM(Millipore);Rabbit anti BLBP(Millipore);Rabbit anti GFAP(Millipore);Mouse anti Nestin(Millipore);二抗 Donkey anti Rabbit-488(Millipore);Goat anti Mouse-568 IgM(Millipore);Goat anti Mouse-568(Millipore);Observer-Z1结构照明显微镜(德国 Zessi公司);VT1000S振荡切片机(德国Leica公司);ECM 830电转仪(美国BTX公司);HWS-150型恒温恒湿培养箱(上海精宏实验设备有限公司);B18型科裕微电脑全自动孵化箱(德州市科裕孵化设备有限公司)。
1.2 方法
1.2.1 鸡胚胎培养 从种鸡场购买新鲜受精鸡蛋当天带回实验室,用37℃温水洗净,酒精棉球擦干净并晾干,大头向上放入孵化器中,温度37.8℃,湿度60%,转蛋间隔2小时。在发育到E8、E10、E12、E14、E16、E18分别取材,每个时期取3个胚胎。
1.2.2 活体原位电转 胚胎发育至E4.5-E5将2 μg/μl的pCAG-GFP质粒0.5 μl在体视显微镜下用玻璃微电极注射到视顶盖的脑室腔内,质粒工作液中质粒与0.1%的Fast Green(Sigma)溶液以10∶1的比例混合均匀,针状电极放在已注射质粒的视顶部位两侧,阳性电极在拟转基因一侧,确保电极与组织之间有一定空隙,使用BTX电转仪进行电转,电转电压25 V,脉冲时间50 ms,脉冲间隔950 ms,电脉冲6次,电击后用医用胶布密封开口,整个过程在无菌操作工作台内完成,放回恒温恒湿培养箱中培养。到胚胎发育的E8、E10和E12进行取材。
1.2.3 固定和切片 将取下的鸡胚胎断头,将头放入4%多聚甲醛(PFA)于室温下在摇床摇晃固定3天,期间每天换一次4%PFA。将固定好的胚胎头部在体视显微镜下将整个脑取出,切下视顶盖部分用4℃预冷的0.1 mol/L pH7.4磷酸盐缓冲液(Phosphate buffer,PB)洗涤2~3次,用吸水纸将多余溶液吸干。用4%琼脂糖包埋,修整组织块,用强力胶将组织块粘在振荡切片机的载物台上,冠状切片,切片厚度为80 μm。
1.2.4 免疫荧光技术染色 将6个不同时期(E8、E10、E12、E14、E16、E18)的切片置于 24 孔培养板中,每孔放入3~4个切片,作为一个样本,采用漂浮染色法染色。用4℃预冷的0.1 mol/L PB漂洗3次,5 min/次,吸出孔内PB液体,分别加入1∶1 000稀释的 Mouse anti RC2 IgM、Rabbit anti BLBP、Mouse anti Nestin和 Rabbit anti GFAP一抗,每孔 300 μl,4℃冰箱内振荡过夜,用0.1 mol/L PB漂洗3次,30分钟/次,分别加入1∶300稀释的 Donkey anti Rabbit-488、Goat anti Mouse-568 和 Goat anti Mouse-568 IgM,每孔300 μl,4℃冰箱内振荡过夜,用0.1 mol/L PB漂洗3次,30 min/次,将染好的切片用抗荧光淬灭的封片剂封片。
1.2.5 观察和拍照 结构照明显微镜观察拍照,用Photoshop CS5软件处理图片。分析不同发育时期BLBP、RC2、Nestin和GFAP的RC的表达情况及RC的形态学特点。
2 结果
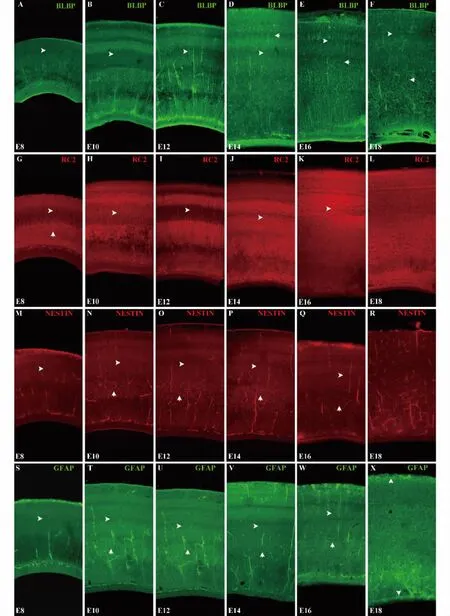
图1 鸡胚胎视顶盖不同发育时期4种胶质细胞标记物的表达Fig.1 Expression of 4 glial cell markers in chicken embryonic optic tectum at different developmental stages from E8 to E18
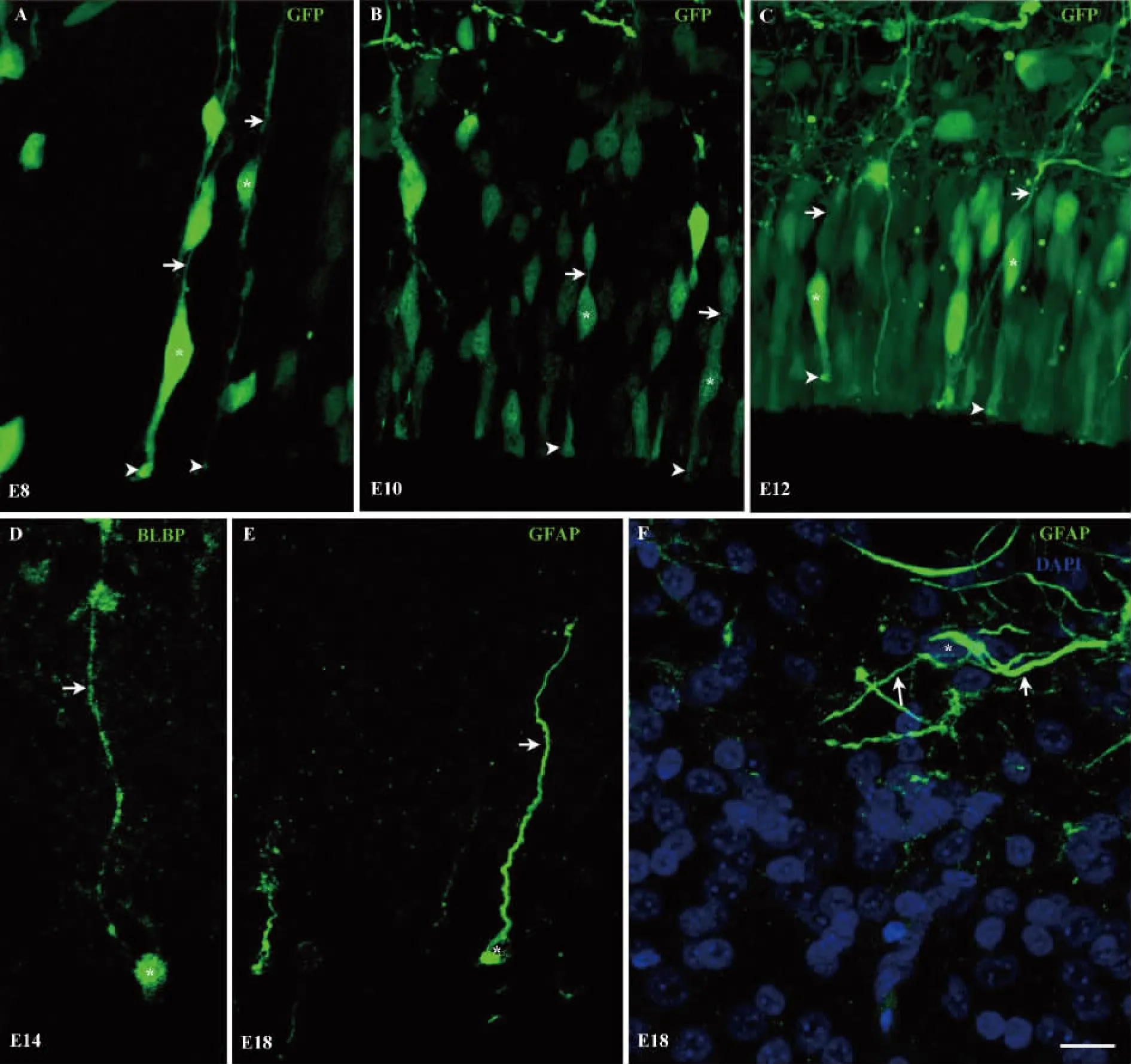
图2 鸡胚胎视顶盖不同发育时期胶质细胞的形态学特点Fig.2 Morphological characteristics of the glial cells in chicken embryonic optic tectum at different developmental stages
2.1 鸡胚胎视顶盖不同发育时期4种胶质细胞标记物的表达分布 从E8-E18,4种标记物均可标记RGCs,但表达强度有差异。BLBP从E8开始逐渐增强(图1A),E12-E16达到高峰(图1C-E),E18开始下降(图1F)。在E8-E18,BLBP标记的RGCs,胞体主要位于室管膜层(Ventricular zone,VZ)。而在E14-E18,除胞体位于VZ的RGCs外还出现了一些胞体离开VZ,随机分布于视顶盖的各层的细胞(白色箭形所示)(图1D-F)。这样的RGCs在E14开始出现(图1D),E16达到高峰(图1E)后开始降低,到E18,位于视顶盖各层的BLBP表达水平明显降低(图1F)。从 E8-E16,RC2均可标记 RGCs(图1GL),但表达强度有差异。RC2从E8开始表达(图1G),E10-E12持续增强(图1H-I),从E14开始表达逐渐减弱(图1J),E16-E18对RGCs染色不明显(图1K-L)。在E8时,RC2除特异性染出放射状排列的RGCs(白色箭形头所示)外,还可染出顶盖延髓束(Tectobulbar efferents,TE)的纤维(白色箭形所示)(图1G)。在E10和E12可以清晰看到放射状排列的RGCs的顶突起(Apical process)(白色箭形头所示),此时RC2的表达强度最强(图1H-I)。E14开始RC2的表达明显减弱,但仍可以观察到放射状排列的RGCs的顶突起(白色箭形头所示)(图1J),而到了E16,RGCs中RC2的表达持续降低,在表面灰质纤维层(Stratum griseum et fibrosum superficiale,SGFS)还能观察到RGCs(图1K),在E18,RC2表达不明显(图1L)。与RC2类似,从E8-E16,Nestin均可标记 RGCs(图1M-Q),但表达强度仍有差异。Nestin从E8开始表达(图1M),E10-E12表达持续增强(图1N-O),从 E14开始减弱(图1P),在 E16时Nestin表达继续降低(图1Q),到 E18时 Nestin表达已不明显(图1R)。与RC2不同,从E10-E14,在中央灰质层(Stratum griseum central,SGC)可明显观察到Nestin阳性的神经元(白色箭形所示),并且从E10开始表达(图1N),E12-E14表达最强(图1O-P),E16表达开始减弱(图1Q),E18时,SGC层的神经元表达Nestin已经不明显(图1R)。从E8-E16,GFAP均可标记 RGCs,但 GFAP表达较弱,且E8-E14表达强度无明显变化(图1S-V),在E16和E18表达增强。在 E18,GFAP标记明显增强(图1X),在视神经层(Stratum opticum,SO)、中央白质层(Stratum album central,SAC)和室周灰质层(Stratum griseum periventriculare,SGP)尤为明显(白色箭形头所示),在SO层已经可以观察到GFAP标记阳性的星形胶质细胞的形态。与Nestin类似,在E10-E16的SGC层(图1T-W)也可观察到GFAP阳性的神经元(白色箭形所示)。
2.2 鸡胚胎视顶盖不同发育时期胶质细胞的形态学观察 由于免疫荧光方法标记的RGCs并不十分清晰,所以E4.5时,神经元增殖高峰的时期采用活体原位电转的方法将GFP转入视顶盖中,GFP标记的细胞包括神经元、RGCs和前体细胞(Precursor cells)等。在E8、E10和E12三个时期分别取材(图2A-C)。RGCs的胞体位于VZ(白色星号所示),有极性,呈apical-basal双极突起形态,每一个RGC都有基足(Basal foot)(白色箭形头所示)锚定在VZ底部,从胞体的另一端(白色箭形所示)向软脑膜(Pia)延伸且不分枝的顶突起。胞体位于VZ的位置并不是完全一致,这可能与其处在不同的细胞分裂周期有关。BLBP标记的RGCs在E12和E14这两个时间点,在胞体的位置上出现了明显的变化,故将E14时期的切片放到高倍镜下观察。在E14时,分布于视顶盖各层的大多数RGCs仍保持双极神经元的特征,但明显可以观察到在视顶盖各层出现了BLBP阳性,但胞体脱离VZ的细胞,这些细胞具有迁移中神经元的特征,即有一条长而不分枝的顶突起(Leading process)(白色箭形所示)和卵圆形胞体(Soma)(白色星号所示)(图2D)。在E18时,GFAP可标记SO层,SAC和SGP层的胶质细胞(图2EF)。SGP层和SAC层的GFAP阳性细胞并没有明显的星形胶质细胞的特点,胞体位于SAC层或SGP层(白色星号所示)但顶突起明显变短(白色箭形所示)(图2E),免疫荧光染色明显增强,提示其可能向星形胶质细胞方向转化。在SO层,GFAP阳性细胞表现出明显的星形胶质细胞的特点,即胞体(白色星号所示)呈圆形或卵圆形,从胞体发出许多长而分枝的突起(白色箭形所示,图2F)。
3 讨论
神经系统由神经元(Neuron)和胶质细胞(Glial cell)组成。胶质细胞对神经元的存活、增殖和分化提供营养信号[11,12]。在脊椎动物发育过程中的胶质细胞类型主要为RGCs,而在脊椎动物神经系统发育成熟后,胶质细胞主要包括星形胶质细胞,少突胶质细胞(Oligodendrocyte)和小胶质细胞(Microglia)。在这三种胶质细胞中,星形胶质细胞分布最广,数量最多,并认为由RGCs发育而来。
BLBP的表达具有脑特异性和调控发育的特点,由于其存在于细胞胞质和胞核中,认为它与成体神经发生和细胞有丝分裂调控有关[5]。在禽类视顶盖中,E3-E8是神经元增殖的主要时期,E8-E12是神经元进行迁移的主要时期,在E12时视顶盖可以分为明显的6层结构,但是SGFS中的10个亚层还没有完全形成,E14-E18是SGFS中10个亚层形成的主要时期,E18时,视顶盖层的结构完全形成。BLBP的RGCs染色结果与视顶盖神经元的层的形成以及神经元的迁移过程具有一致性。在E8-E12时,RGCs的胞体主要位于VZ,其突起朝向软脑膜延伸,终足(Endfoot)终止于软脑膜。虽然E8-E12是视顶盖增厚的主要时期,但胞体并没有离开VZ,仍行使RGCs的主要功能,即作为“脚手架”使新生神经元沿着其突起进行迁移。从 E14开始,部分BLBP阳性细胞的胞体离开VZ,随机分布于视顶盖的各层,提示其可能沿RGCs进行迁移。而这些阳性细胞可能已经开始进行分化,但仍表达BLBP,故可以被BLBP抗体识别。这些胞体离开VZ的BLBP阳性细胞在E14开始出现,E16达到高峰,在E18时又迅速减少。在E14-E18时,大部分神经元已经迁移结束,只有形成SGFS层的神经元还将继续增殖和迁移,所以部分RGCs可能完成其“脚手架”功能,其胞体开始离开VZ,突起变短,开始进行迁移和分化。E18时,视顶盖层的结构已经完全形成,RGCs明显减少,且胞体离开VZ层的BLBP阳性细胞的数量也迅速下降,可能这些细胞已经分化为其他细胞。发育中的RGCs具有神经干细胞性质,可以作为前体细胞增殖分化出神经元,RGCs和星形胶质细胞[13]。
E8-E12时是神经元进行迁移的主要时期,RC2阳性的RGCs与BLBP阳性的RGCs形态相同,都是胞体位于VZ,在其胞体上发出一条朝向软脑膜的不分枝的突起,终足终止于软脑膜。而从E14开始,RGCs中RC2的表达明显减弱,到E18,RC2标记的RGCs已经不明显,提示这可能与大部分神经元迁移基本结束,RGCs开始分化有关。E14-E18时,RC2标记的RGCs并没有出现BLBP阳性胞体离开VZ,突起变短的一类细胞,提示RC2与BLBP标记的RGCs可能不是同一亚型或RC2标记RGCs的特异性更强。
Nestin属于第4类中间丝蛋白(Intermediate filament protein,IFP),被认为是一种神经干细胞(Neural stem cell,NSC)的标记物,并且在进化上高度保守[8]。Nestin表达与 RC2相似,E8-E12表达较强,主要标记RGCs,自E14开始标记RGCs开始减弱,到E18时,表达已不明显。但不同的是Nestin可标记SGC层的神经元,说明该类神经元即神经节细胞(Ganglion cell)胞体中可能含有较强的IFP。有研究表明Nestin主要存在于胚胎发育早期的一些细胞中如放射状胶质细胞、VZ层细胞、神经元和胶质细胞前体细胞和神经上皮细胞,但并不是所有的神经干细胞(Neural stem cell,NSC)都表达 Nestin,特别是一些开始分化的NSC[8]。这也与本试验结果一致,即自E14开始RGCs的表达减弱,且Nestin可以标记一些SGC层的神经元。
GFAP也是一种 IFP,属于第3类 IFP[8]。在本试验的结果中,在E8-E18的RGCs中均可检测到GFAP表达,且 E8-E14,RGCs中GFAP表达强度很弱,但在E16和E18明显观察出GFAP的表达开始增强,在E18时的SO层中已经可以观察到星形胶质细胞,在SAC层和SGP层的细胞突起变短,提示其向星形胶质细胞转化。GFAP被认为是一种星形胶质细胞常见的标记物。GFAP在小鼠发育中的大脑皮质中不能标记RGCs,但可特异性标记星形胶质细胞。但有研究发现在其他脊椎动物如灵长类动物的脑皮质RGCS中也检测到 GFAP的表达[14]。与Nestin相似,在E10-E16的SGC层神经节细胞也被GFAP标记,提示其可能含有IFP。
在E8-E12,随着大量神经元增殖的结束,VZ层厚度逐渐减小,RGCs的胞体位于VZ,但胞体的位置在VZ层具有apical-basal移动性[15]。有研究表明,RGCs分裂方式为对称分裂,有细胞分裂相,细胞位于不同的分裂时期(细胞有丝分裂周期:G1-S-G2-M),胞体在VZ的位置不同,在M期,胞体移动到靠近脑室处;在G1期,胞体开始向软脑膜移动在S期到达离脑室最远处;在G2期,胞体又向脑室方向移动,在这一过程中,突起始终与 apical-basal联结[15]。自E14开始,RGCs可能开始向其他类型细胞转化。试验结果显示趋势是,胞体离开VZ,顶突起明显变短,有的已经具有星形胶质细胞的形态特点(如E18时 SO层)。
胶质细胞对神经元功能的行使起着十分重要的作用,这些作用主要包括对神经元的支持、修复、免疫应答、营养和代谢、迁移、发育和保护等,故胶质细胞对于脑的正常发育、神经元调控和中枢神经系统再生的影响十分重要。目前,学术界广泛认为在中枢神经系统中小胶质细胞和星形胶质细胞发挥着重要的免疫调节作用[16]。小胶质细胞作为中枢神经系统的巨噬细胞,当由于病原体、抗原和毒素等的侵入而导致大脑损伤时,小胶质细胞会迅速激活并释放大量的促炎症因子,激活免疫系统并吞噬外来病原体和受损细胞[17,18]。小胶质细胞除可作为中枢神经系统的巨噬细胞外,在炎症反应中也起着重要的作用。小胶质细胞在细胞内毒素LPS刺激下首先激活,周围的星形胶质细胞接受了小胶质细胞的免疫信号后被激活,二者配合促进神经元的损伤和退化[19]。放射状胶质细胞被认为是一种胶质细胞前体,对于研究星形胶质细胞及小胶质细胞的发生和揭示中枢神经系统免疫反应的原理具有重要意义。
1 Schmid R S,Yokota Y,Anton E S.Generation and characterization of brain lipid-binding protein promoter-based transgenic mouse models for the study of radial glia[J].Glia,2006;53(4):345-351.
2 Domesick V B,Morest D K.Migration and Differentiation of ganglion cells in the optic tectum of the chick embryo[J].Neuroscience,1977;2:459-475.
3 Nadarajah B,Brunstrom J E,Grutzendler J et al.Two modes of radial migrationin early development of the cerebral cortex[J].Nat Neurosci,2001;4:143-150.
4 Morest D K.A study of neurogenesis in the forebrain of opossum pouch young.Z Anat Entwicklungsgesch,1970;130:265-305.
5 Feng L,Hatten M E,Heintz Net.Brain lipid-binding protein(BLBP):A novel Signaling System in the Developing Mammalian CNS[J].Neuron,1994;12:895-908.
6 Kuhar S G,Feng L,Vidan S et al.Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation[J].Development,1993;117:97-104.
7 Misson J P,Edward M A,Yamamoto M et al.Identification of radial glial cells within the developing murine central nervous system:studies based upon a new immunohistochemical marker[J].DEV Brain Res,1988;44:95-108.
8 Gilyarov A V.Nestin in central nervous system cells[J].Neurosci Behav Physiol,2008;38(2):165-169.
9 Eng L F,Gerstl B,Vanderhaeghen J J.A study of proteins in old multiple sclerosis plaques[J].Trans Am Soc Neurochem,1970;1:42.
10 Eng L F,Vanderhaeghen J J,Bignami A et al.An acidic protein isolated from fibrous astrocytes[J].Brain Res,1971;28:351-354.
11 Gomes F C A,Maia C G,Menezes J R L De et al.Cerebellar astrocytes treated by thyroid hormone modulate neuronal proliferation[J].Glia,1999;25:247-255.
12 Maxwell G D,Reid K,Elefanty A et al.Glial cell line-derived neurotrophic factor promotes the development of adrenergic neurons in mouse neural crest cultures[J].Proc Natl Acad Sci USA,1996;93(23):13274-13279.
13 Gray G E,Sanes J R.Lineage of radial glia in the chicken optic tectum[J].Development,1992;114:271-283.
14 Levitt P,Rakic P.Immunoperoxidase localization of glial fibrillary acidic protein in radial glial cells and astrocytes of the developing rhesus monkey brain[J].J Comp Neurol,1980;193(3):815-840.
15 Gotz M,Huttner W B.The cell biology of neurogenesis[J].Nat Rev Mol Cell Biol,2005;6(10):777-788.
16 Lucin K M,Wyss-Coray T.Immune activation in brain aging and neurodegeneration:too much or too little?[J]Neuron,2009;64(1):110-122.
17 Gehrmann J,Matsumoto Y,Kreutzberg G W.Microglia:Intrinsic immuneffector cell of the brain[J].Brain Res Brain Res Rev,1995;20(3):269-287.
18 Kettenmann H,Hanisch U K,Noda M et al.Physiology of microglia[J].Physiol Rev,2011;91(2):461-553.
19 Saijo K,Winner B,Carson C T et al.A Nurr1/CoREST pathway in microglia and astrocytes protects dopaminergic neurons from inflammation-induced death[J].Cell,2009;137(1):47-59.