生物医学光声成像技术及其临床应用进展
龚小竞 孟 静 陈健桦 林日强 白晓淞 郑加祥 宋 亮*
(中国科学院深圳先进技术研究院生物医学光学与分子影像研究室 深圳 518055)
1 引 言
1.1 光声成像原理
光声成像技术是一种新兴的生物医学成像模式,是近十年发展最快的成像方式之一,因其具有高光学对比度和大超声成像深度等优点,已成为目前生物医学成像领域的研究热点。光声成像基本原理是:利用脉冲激光照射生物组织,当组织吸收光能量后受热膨胀形成瞬时压力,产生一个宽带的超声信号(通常带宽在几十甚至上百 MHz),即光声信号。光声信号经由重建算法反演得到组织光吸收图像,即光声图像。
在激发光参数不变的情况下,光声信号的强度、频谱与生物组织的光吸收特性紧密相关。而不同的组织有不同的光吸收特性,因此光声成像可以针对组织中特定成分,选择特定波长进行高对比的结构成像。进一步地结合光声光谱技术,可以定量地分析各种组织成分的变化,精细地反映极其微小的组织病变及血红蛋白浓度、血氧浓度、氧代谢率等一系列重要的生理参数,实现功能成像。
1.2 光声成像的种类与应用
光声成像具有可灵活结合大穿透深度和高分辨成像的特点,使其可以采用不同的成像方式,以获得与应用匹配的更优质图像。在实际应用中,有三种常见的光声成像方式:光声显微成像技术(PAM)、光声计算层析成像技术(PACT)、光声内窥成像技术(PAE)。其中,光声显微成像技术和光声内窥成像技术的主要目标是在毫米级的成像深度上实现微米级的分辨率。而光声计算层析技术的探测深度和分辨率可在较大范围内变化,既可实现显微成像,也可实现大深度成像。如图 1 所示,光声成像可跨尺度地实现从细胞器、细胞到组织、器官的成像,并且均可获得相匹配的分辨率[1]。
光声成像技术凭借其灵活的成像方式、优质的成像能力、高度的生物安全性,正越来越受到生物医学成像领域的关注。近年来,光声成像已被证明在众多生物医学领域具有重要的应用价值,如肿瘤血管新生成像[2]、血红蛋白和血氧浓度成像[3]、乳腺癌诊断[4]、心脑血管易损斑块成像等[5]。

图1 跨尺度光声成像代表性结果图
本文将主要介绍本课题组在光声成像新技术中的研究成果,以及光声成像技术在临床应用中的研究进展。
2 光声成像中的新技术
2.1 光声成像解卷积技术
光学分辨率光声显微系统(OR-PAM)是光声显微的一种主要形式。它采用聚焦的激光光束作为激发光声信号,具有微米甚至是亚微米级别的横向分辨能力,其横向分辨率几乎完全由激光聚焦的能力决定。
为了进一步提高横向分辨率,一个简单而直接的方法是通过增加聚焦物镜的数值孔径来提高系统的光聚焦能力。然而,此方法存在几个缺点:第一,高数值孔径物镜对微小的光学像差十分敏感,在实际应用中必须在系统中通过光学器件进行正确的补偿;第二,由于聚焦深度反比于数值孔径的平方,这意味着增大数值孔径的同时也会急剧地缩短系统的有效成像深度范围;第三,物镜的工作距离会随着数值孔径的增大而减小。因此,采用增大数值孔径的方法虽然可提高成像分辨率,但会导致成像灵活度的下降。
信号处理的方法为提高系统分辨率提供了另一种有效途径。为了提高成像的对比度与分辨率,解卷积(Deconvolution)算法被广泛应用于多种光学成像当中。本课题组所采用的是常用的 Lucy-Richardson 解卷积算法,将其应用于迭代模式下的盲解卷积过程时,有效地提高了 OR-PAM 图像的横向分辨率和对比度。与此同时,由于在系统硬件上没有进行改动,仍然保持了较大的成像深度,有利于对活体血管精细结构进行光声成像。
本课题组对远小于系统成像分辨率的石墨烯纳米颗粒(直径约 200 nm)进行光声成像,并对成像结果进行了解卷积处理。解卷积前后,图像中的微粒直径分别为 5.78 μm、3.04 μm,证明该算法有效地实现了近2 倍的分辨率改善[6]。
接下来,该算法被用于活体小鼠耳部毛细血管网络的成像改善,对比结果如图 2(a)、(b)所示,从图中可看出图像细节有了明显的呈现。在图 2(c)中,对比了图(a)、(b)中 B 处放大后的代表性区域解卷积前后的情况。经对比发现毛细血管经过解卷积处理之后,原先的模糊状态得到了有效的消除。而在图 2(d)和(e)中,可以看出一对相邻血管之间的间隔,在解卷积后得到了更为明显的区分[6]。

图2 用 OR-PAM 对小鼠耳部活体成像结果
以上结果表明,结合盲解卷积算法,能够在保留成像深度的情况下,进一步提高 OR-PAM 的分辨能力。这使其作为一种可对精细结构成像并可获得三维深度信息的成像技术,可获得更精准的生物体细节信息,具备更为广泛的生物医学研究和临床应用前景。
2.2 光声成像压缩感知技术
光声计算层析成像易于实现较大区域和深层组织成像,具有广阔的临床应用前景。PACT 成像一般采用超声阵列获取光声信号,然而为了获得高质量图像,需要多阵元密集排布,且阵元数量较大。这种大数据量的多路数据采集,对采集系统提出了非常苛刻的要求。目前在多路复用技术下,数据采集和成像速度较慢,限制了该成像方式的应用。
如果能够降低数据空间采样率,可有效提高光声数据采集和成像速度。此外,高频超声阵列价格昂贵,因此若降低数据空间采样率,可以降低对超声阵列的要求,从而减少系统成本。然而,这种基于稀疏阵元的采集方式不能满足内奎斯特采样定理,传统方法无法重建出满足实际需要的高质量光声图像。
压缩感知理论(Compressed Sensing,CS)由美国斯坦福大学的 Candés 和 Donoho 教授于 2006 年正式提出,其核心思想是在远低于内奎斯特采样定理的数据采样率下,高质量恢复信号。近几年,CS 技术已经广泛应用于信号处理、医学影像和模式识别等领域。其中,CS 技术在磁共振快速成像领域的成功应用,体现出其巨大的价值和潜力。针对光声计算层析成像的数据采集和成像速度问题,自 2009 年开始,许多科研工作者进行了压缩感知光声成像的探索性研究,并取得了一些有意义的研究成果。
本课题组首先进行了基于部分已知支撑(Partially Known Support,PKS)新型压缩感知理论的在体人手和小动物成像[7]。在时、频域重建结果基础上,将部分已知支撑信息融入重建过程,实验对三倍稀疏采样下的反投影(Back-Projection,BP)重建结果、传统 CS结果和 CS-PKS 重建结果做了详细的比较和分析。分析结果表明在三倍稀疏采样下,传统 CS 方法可以获得更高质量的重建图像,但不能很好地抑制欠采样噪声,而 CS-PKS 重建方法获得了几乎与原始图像相同的图像质量和重建精度。

图3 在体 OR-PACT 小鼠耳血管分布图
进一步地,首次将 CS-PKS 用于光学分辨率光声计算层析系统(OR-PACT)[8]。实验过程中,成像系统采用 48 单元线性超声阵列(配合 8 通道数据采集卡)采集光声信号。此 OR-PACT 系统与传统 PACT 系统的主要区别在于光照明是聚焦的,系统用微透镜阵列实现对成像组织的聚焦光线照射(共 20 条聚焦光线,两条相邻光线间隔 250 μm,单条光线的聚焦光斑大小为 10 μm),超声阵列在组织的另一侧实现透射式信号采集。
该系统对一个长 5 mm 的断面区域成像需要 25次光照扫描和 25 次数据采集,因此数据采集量非常大。而本课题组基于 CS-PKS 方法实现了三倍稀疏欠采样下的高质量在体小动物成像(图 3),将 ORPACT 的数据采集多路复用比由 6:1 降为 2:1,成像速度与传统光学分辨率光声显微成像系统相比,大约提高了 10 倍[8]。
压缩感知理论已经成功应用于光声计算层析成像系统,实现了时域和频域的在体光声图像重建。小动物和人的在体成像结果表明:压缩感知技术在降低系统成本、提高数据采集速度方面有巨大的应用潜力。压缩感知光声成像的研究将进一步促进光声成像技术在各种生物医学临床疾病诊断、检测和治疗中的广泛应用。

图4 Nano- rGO 尾静脉注射后,在肿瘤区域聚焦的光声成像图
2.3 光声分子影像技术
光声分子影像是近期发展起来的新型无创在体影像技术。该技术结合了光声层析成像和分子影像的特点,具有成像深度深、分辨率高和特异性强等优点,拥有广阔的应用前景。
兼具诊断和治疗功能的光声分子影像对比剂在个性化医疗领域展现出了极大的应用潜力。本课题组设计并制备了具有高稳定性和低毒性的纳米还原氧化石墨烯颗粒(nano-rGO)。利用自主研制的光声/超声波双模成像和光热治疗的平台,研究该颗粒光声成像和光热治疗性质[9]。
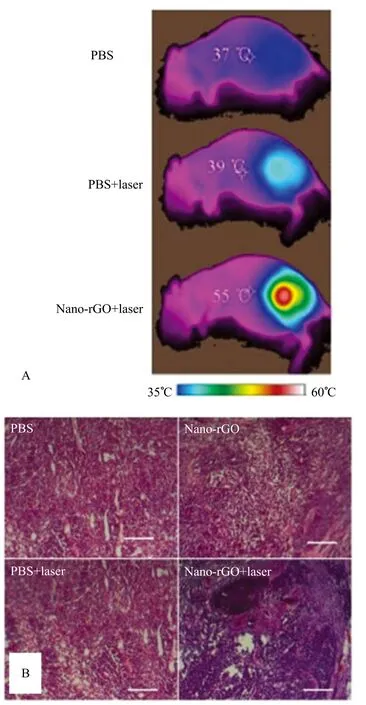
图5 在不同条件下,小鼠红外热成像分布和不同实验条件下的肿瘤组织切片染色图,本图片的使用得到原作者[9]的授权
在实验过程中,通过对小鼠尾静脉注射 nanorGO,然后比较注射前后的光声图像(图 4(c-f)),结果发现注射 nano-rGO 后的信号显著增强。由此可证明,该纳米颗粒可有效提高光声信号强度[9]。
在此基础之上,进一步进行了光热治疗实验,结果见图 5。从图 5 可看出,注射 nano-rGO 后,激光照射 5 分钟后,注射区域温度高达 60 摄氏度,可以有效杀死肿瘤细胞。图 5 中 (A)图比较了三种情况下小鼠肿瘤区域的温度情况。与 (A)图对应的(B)图中的肿瘤组织切片表明,只有注射 nano-rGO 的肿瘤细胞死亡。以上实验表明,静脉注射 nano-rGO 的肿瘤小鼠在肿瘤区域表现出快速和显著的光声信号增强。同时,光热治疗结果显示,由于材料的光热效应,小鼠体内的癌细胞都被有效地烧蚀。因此,nano-rGO能很好的结合肿瘤成像和治疗,是非常有前景的光声成像和光热治疗对比剂[9]。
由于采用了光学对比、超声探测的技术,光声分子影像技术可以在保持高空间分辨率的同时对深层的活体组织进行成像,可以对分子影像对比剂在各脏器的动力学代谢和三维分布等进行分析。这对于纯光学手段来说是不可比拟的优势。
3 光声成像技术的临床研究
3.1 乳腺癌光声成像技术
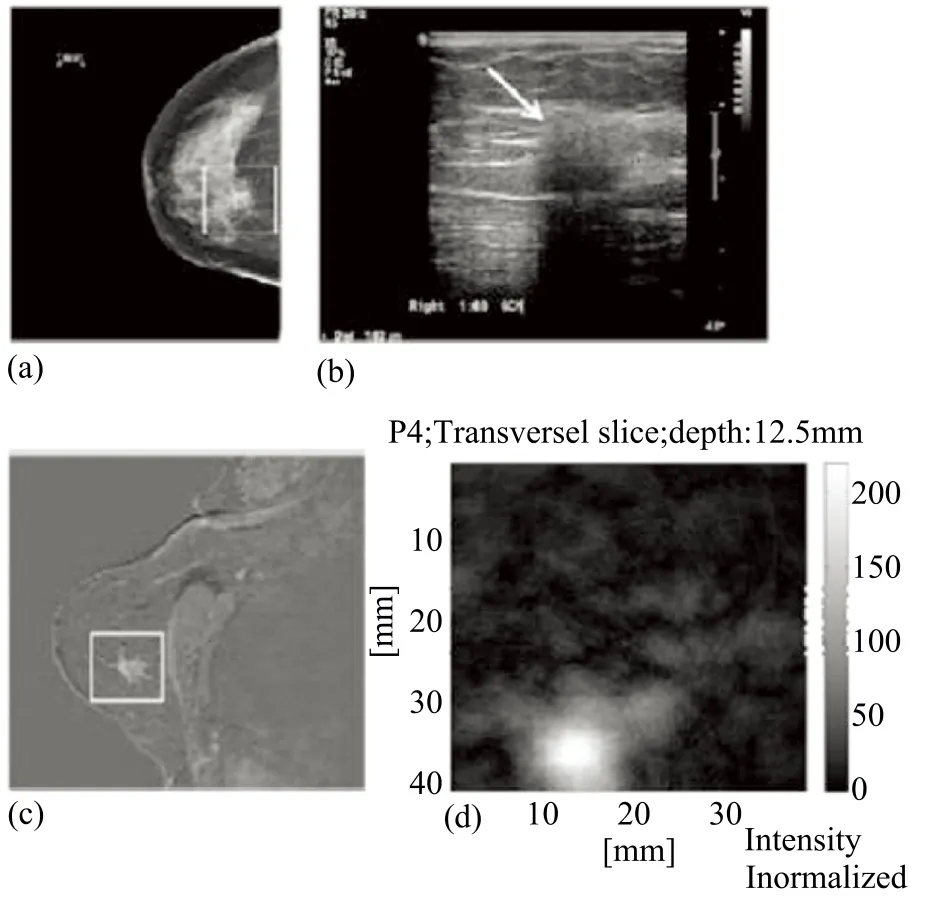
图6 浸润性导管癌成像结果图
在中国,对乳腺癌的临床检测通常用超声作为初筛,再辅以 X 射线钼靶成像,但是其灵敏度和特异性无法满足临床早期检测的需求。光声成像技术以肿瘤的血管新生作为内源性对比剂,实现癌症疾病的早期检测,同时光声光谱方法可以实现肿瘤的氧饱和度功能成像。因此,该成像方式与传统乳腺检查手段相比,具有灵敏度高、价格低、非电离辐射和不受乳腺组织致密性影响等优点,在乳腺癌筛查方面具有很好的应用前景。
学术界和工业界均在光声成像用于乳腺癌的检测方面做了很多研究。荷兰 Twente 大学生物医学光学研究室 2012 年发表了该研究组在光声乳腺成像系统方面的最新临床研究进展[10]。该小组在临床实验中发现,基于光声成像技术的乳腺检查方式与超声成像相比具有更好的成像对比度;与 CT 相比不受组织致密性影响;与 MRI 相比,系统成本低,成像速度快;且光声成像方式可以区分乳腺癌和囊肿性疾病,成像结果见图 6。该研究成果充分展示了光声成像技术在乳腺癌检测方面的可行性和应用潜力。该研究小组目前正在开展一项包括 100 位病人的光声乳腺癌成像临床研究。

图7 用光声对覆盖在鸡肉下方的老鼠前哨淋巴结进行成像
工业界也在积极推动将光声成像技术应用于乳腺癌的检测。目前包括 OptoSonics、Seno Medical Instruments、TomoWave Labs 在内的数家初创公司正在开展光声乳腺癌成像技术的产业化。他们的临床试验表明,光声系统具备乳腺组织血管新生的成像能力,在乳腺癌诊断方面具有很强的应用潜力[11]。
3.2 前哨淋巴结光声成像技术
前哨淋巴结作为原发肿瘤发生淋巴结转移的第一批淋巴结,其临床意义已受到人们的重视。然而,当前临床上对前哨淋巴结的活检,仍会给患者带来一定创伤,并有可能会造成淋巴水肿甚至致残,且70%~90% 病人结果均为阴性。
光声成像技术通过对美国食品药品管理局(FDA)批准的临床外源性对比剂(吲哚菁绿或亚甲基蓝)的成像,可以无损地在体外精确定位前哨淋巴结的位置,并通过活检针,把手术转化为活检取样的微创过程,这样不仅极大地减少了病人的创伤和痛苦,也给医生带来极大的便利,并有望显著地减少医疗费用、降低手术创伤。国际医学界和国际医疗影像公司对此也抱有极大的研究热情。
美国圣路易斯华盛顿大学小组以亚甲基蓝(Methylene blue)作为光声对比剂,对大鼠体内 2.5 厘米深处(用覆盖鸡肉的方法增加了厚度)的前哨淋巴结进行了成像。从图 7 可以看出,成像效果非常地明显(见图 7 中上图白色箭头标注的区域)。光声成像得到的前哨淋巴结位置与成像结束后将大鼠解剖后看到前哨淋巴结(图 7 中下图)位置一致[12]。目前圣路易斯华盛顿大学生物医学工程系和医学院正在开展光声前哨淋巴结的临床研究,最初的二十余例病人成像均获得较好的结果。
3.3 光声血管内窥成像技术
临床上使用的血管内超声(IVUS)和血管内光学相干层析技术(IVOCT)相较体外成像,大幅提高了对斑块成像的精确性和敏锐度。但是 IVUS 的分辨率不足以分辨薄纤维帽,而 IVOCT 穿透深度太浅,且IVUS和 IVOCT 都只能获得形态学信息,无法获得斑块成分、炎性反应等重要的生理信息,因此还存在明显的不足。
而光声成像既可利用组织自身的光吸收对比和光声光谱的方法检测斑块的化学成分(如易损斑块的脂质核心和纤维帽),亦可借助生物分子探针对活动性炎症(如巨噬细胞浸润)等细胞和分子层面的生物活动进行探测。因此,光声成像可为研究斑块破损的机理和炎症等重要生物过程提供新的方法和手段。而把光声成像发展为血管内窥成像技术将更加有利于对易损斑块的早期发现。
荷兰伊拉兹马斯医疗中心的 Krista Jansen 等开发了血管内光声成像系统,组装了外径 1.25 mm 的光声/超声成像导管[13]。利用该系统获得了冠状动脉的离体光声、超声图像,如图 8 所示。图 8(a)为富含脂质核并有钙化的斑块染色病理切片照片;图(b)为 IVUS 图像;图(c)和图(d)均为血管内光声图像,分别于 1210 nm 波长和1230 nm 波长照射获得。由于脂肪在 1210 nm 激光处有一个较强的吸收峰,而在 1230 nm 处的吸收变弱,所以可以通过对不同波长的光声图像进行差异对比,准确探测动脉粥样硬化样品的脂质区域。

图8 冠状动脉(男性,56 岁)样品图
此外还有德州大学奥斯汀分校、普度大学、南加州大学、圣路易华盛顿大学等多个光声医学成像小组在开展光声血管内成像的研究工作,通过光声光谱成像、光声光谱定量分析等多种方法,研究光声技术在体血管内检测斑块的可行性。
4 总 结
光声成像技术作为一种兼具光学对比度与超声大成像深度的新型生物医学成像技术,具有独特的优势。其可利用不同组织的波长选择性高对比显示特定组织,又可利用组织的光吸收谱对组织进行光谱分析,实现功能成像,这些已被证明在众多生物医学领域具有重要的应用价值。同时,光声成像可进行跨尺度的成像,并可实现与之相匹配的分辨率,这使得光声成像可根据成像对象灵活的选择成像方式,为光声成像的应用提供了极大的便利。
为进一步拓展光声成像技术的应用范围,本课题组在提高分辨率、加快成像速度以及提高信噪比等方面也作了相应的研究,包括发展光声成像解卷积技术、光声成像压缩感知技术以及光声分子成像技术等。研究取得了良好的结果,为推动该技术的临床应用提供了新的机遇。
同时,为了推动光声成像技术的发展,研究人员针对癌症、心脑血管病等重大疾病开展了多项临床研究。研究结果进一步展示了光声成像技术在生物医学成像领域的重要应用价值和广阔前景。
[1]Wang L V, Hu S. Photoacoustic tomography: in vivo imaging from organelles to organs [J]. Science, 2012, 335: 1458-1462.
[2]Lao Y Q, Xing D, Yang S H, et al. Noninvasive photoacoustic imaging of the developing vasculature during early tumor growth [J]. Physics in Medicine and Biology, 2008, 53: 4203-4212.
[3]Zhang H F, Maslov K, Sivaramakrishnan M, et al. Imaging of hemoglobin oxygen saturation variations in single vessels in vivo using photoacoustic microscopy [J]. Applied Physics Letters, 2007, 90: 053901.
[4]Ermilov S A, Khamapirad T, Conjusteau A, et al. Laser optoacoustic imaging system for detection of breast cancer [J].Journal of Biomedical Optics, 2009, 14: 024007.
[5]Wang B, Su J L, Karpiouk A B, et al. Intravascular photoacoustic imaging [J]. Ieee Journal of Selected Topics in Quantum Electronics, 2010, 16: 588-599.
[6]Chen J, Lin R, Wang H, et al. Blind-deconvolution opticalresolution photoacoustic microscopy in vivo [J]. Optics Express,2013, 21: 7316-7327.
[7]Meng J, Wang L V, Ying L, et al. Compressed-sensing photoacoustic computed tomography in vivo with partially known support [J]. Optics Express, 2012, 20: 16510-16523.
[8]Meng J, Wang L V, Liang D, et al. In vivo optical-resolution photoacoustic computed tomography with compressed sensing [J]. Optics Letters, 2012, 37: 4573-4575.
[9]Sheng Z, Song L, Zheng J, et al. Protein-assisted fabrication of nano-reduced graphene oxide for combined in vivo photoacoustic imaging and photothermal therapy [J].Biomaterials, 2013, 34: 5236-5243.
[10]Heijblom M, Piras D, Xia W, et al. Visualizing breast cancer using the twente photoacoustic mammoscope: what do we learn from twelve new patient measurements? [J]. Optics Express,2012, 20(11): 11582-11597.
[11]Kruger R A, Lam R B, Reinecke D R, et al. Photoacoustic angiography of the breast [J]. Medical Physics, 2010, 37(11):6096-6100.
[12]Erpelding T N, Kim C, Pramanik M, et al. Sentinel lymph nodes in the rat: noninvasive photoacoustic and us imaging with a clinical us system [J]. Radiology, 2010, 256(1): 102-110.
[13]Jansen K, Steen A, Springeling G, et al. Intravascular photoacoustic imaging of human coronary atherosclerosis [J].Optics Letters, 2011, 36(5): 597-599

