缺血性脑血管病患者白质病变与视网膜血管病的相关性
朱伟谦 李佳 翁益云 任王芳 张旭
脑白质病变(white matter lesions,WMLs)又称白质疏松(leukoaraiosis,LA),早在19世纪由Binswanger通过尸检发现。随着现代影像学技术的飞速发展,WMLs才逐渐被人们所认识。1987年Hachiski首先提出了LA这一概念,用来描述侧脑室旁或皮质下区CT弥漫性低密度病灶或MRI T2WI弥漫性高信号病灶。其病因及发病机制尚不完全清楚,多数研究发现,LA的发生可能与脑小血管病变导致白质慢性缺血损伤有关。目前的脑血管成像技术主要用于大血管评估,而无法使小血管显影。视网膜血管作为颈内动脉的分支,与脑小血管在胚胎起源、功能上具有相似性[1]。近年来发现,视网膜血管病变(retinal angiopathy,RA)与脑小血管病(cerebral small vessel disease,SVD)具有一定的相关性,可间接地用于评价脑内小动脉病变。该研究对缺血性脑血管病患者WMLs与RA的关系进行探讨。
1 对象和方法
1.1 研究对象 收集2011-10-2012-06温州医学院附属第一医院住院的缺血性脑病患者共128例,其中男84例,女44例,平均年龄(61.3±8.6)岁。纳入标准:(1)年龄50~80岁;(2)既往无脑卒中病史,均为首次发病。排除标准:(1)合并心脏病、肝肾功能衰竭、自身免疫性疾病等严重的内科疾病;(2)存在炎性脱髓鞘、代谢、中毒、感染、肿瘤等非血管性因素导致的神经系统白质病变的患者;(3)眼部炎性反应、肿瘤,视网膜脱离、严重屈光介质混浊;(4)不配合或不宜行眼底照片检查的患者;(5)除动脉粥样硬化、小血管病外,其他病因导致脑梗死或大面积脑梗死的患者。根据有无LA将患者分为对照组和LA组,其中对照组无LA,共35例;LA组共93例。
1.2 方法
1.2.1 暴露因素:通过收集血压、血生化、颈动脉超声检查以及病史、既往医疗记录等资料对高血压、糖尿病、总胆固醇、三酰甘油、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、吸烟、饮酒、颈动脉硬化等进行评估。高血压判定标准:收缩压≥140 mmHg,舒张压≥90mmHg。糖尿病诊断标准:根据糖尿病症状以及糖耐量试验(OGTT),空腹血糖≥7.0mmol/L,或餐后2h血糖≥11.1mmol/L。患者未常规服用降血糖、降血压、降血脂等药物。
1.2.2 眼底照片:通过采集患者眼底图像,用扫描仪对眼底图像进行扫描,并采用计算机图像处理软件对眼底血管进行分析。眼底动静脉口径比值测量:以视盘为中心,以视盘直径0.5倍及1倍作两个同心圆,对同心圆之间的血管口径测量计算比值,动静脉比值为2∶3为正常,小于2∶3(1∶2、1∶3、1∶4)为异常。按 Keith-Wagener-Barker分型:Ⅰ型为视网膜动脉狭窄、轻度硬化;Ⅱ型为视网膜动脉肯定的局部狭窄,有动脉交叉征病理性改变;Ⅲ型为视网膜动脉明显硬化狭窄,并有出血、渗出;Ⅳ型为视网膜病变严重,合并视乳头水肿。
1.2.3 脑白质分级:所有患者经3.0T磁共振扫描,采用Fazekas评分法对患者WMLs程度评分。评分标准:在MRI轴位像上分别对脑室旁和深部白质病变评分。脑室旁病变评分:0分:无病变;1分:冒状或铅笔样薄层病变;2分:病变呈光滑的晕圈;3分:不规则的侧脑室旁高信号,延伸到深部白质。深部白质病变评分:0分:无病变;1分:点状病变;2分:病变开始融合;3分:病变大面积融合。将两部位病变评分相加(最低0分,最高6分)作为WMLs程度。脑梗死新鲜病灶不计入评分。
1.3 统计学处理 应用SPSS19统计软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,均数间比较采用t检验;非正态分布资料以中位数(Md)和四分位数间距(QR)表示,采用Kruskal-Wallis H检验;计数资料采用卡方检验;暴露因素采用Logistic回归分析,相关性分析采用Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 暴露因素分析 LA组与对照组在年龄、高血压、颈动脉病变、RA之间比较差异具有统计学意义(P<0.05),具体结果见表1。将年龄、高血压、颈动脉病变、RA带入Logistic回归分析,结果发现RA与LA之间的关联性较强(OR=5.948,95%CI=2.133~16.584),具体结果见表2。
2.2 RA与LA相关性分析 无RA组(n=38)、RA Ⅰ型(n=21)、RA Ⅱ型(n=48)和RA Ⅲ型+型Ⅳ(n=21)的Fazekas评分中位数(四分位数间距)分别为0(1)、1(2.5)、2.5(2)、3(3)分,各 RA分型的Fazekas评分之间比较差异具有统计学意义(P<0.01)。通过Spearman相关分析发现RA严重程度与Fazekas评分之间成呈相关性(r=0.623,P<0.01)。
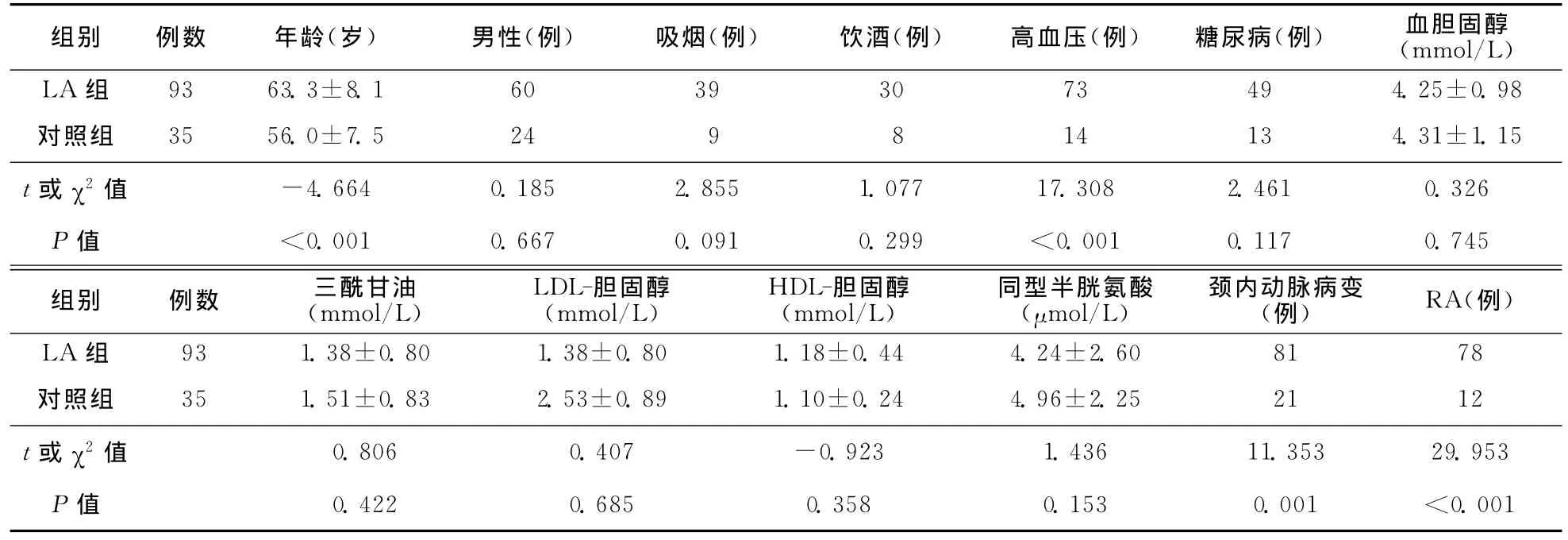
表1 对照组与LA组暴露因素比较
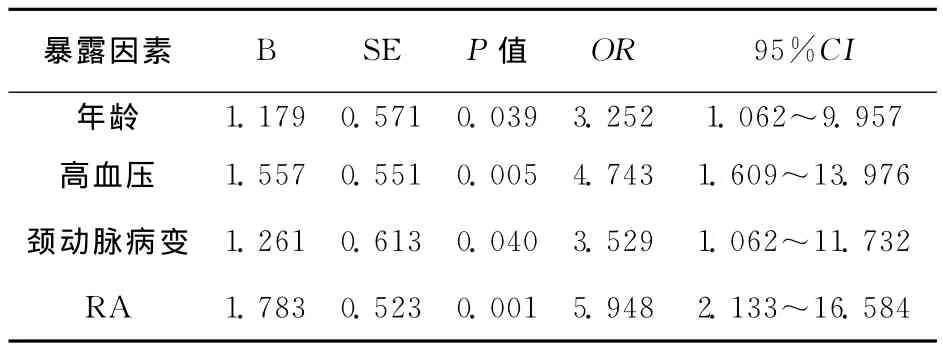
表2 相关暴露因素的Logistic回归分析
3.3 眼底照片及脑MRI检查 LA患者眼底照片(局部)表现见图1。不同RA分型脑部MRI图像表现见图2~4。
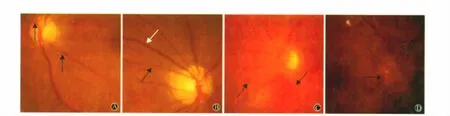
图1 LA患者眼底照片示动脉局部狭窄(箭头所示,A);动脉变细(黑色箭头为变细的动脉,白色箭头为静脉),动静脉比值1∶3(B);视网膜出血(箭头所示,C);血管扭曲、出血、视乳头水肿(箭头所示为视乳头,D)
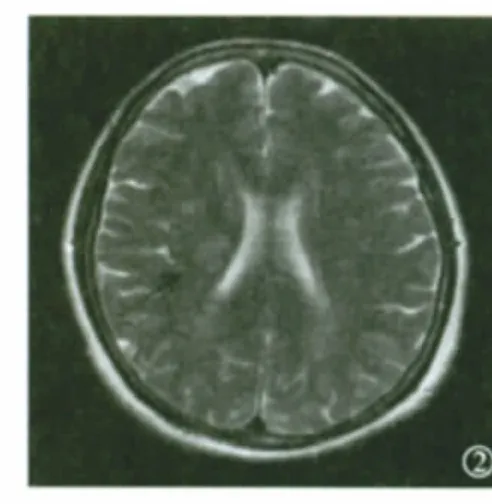
图2 RAⅠ型患者MRI T2加权像显示脑实质深部散在点状高信号(箭头所示为新鲜梗死灶)
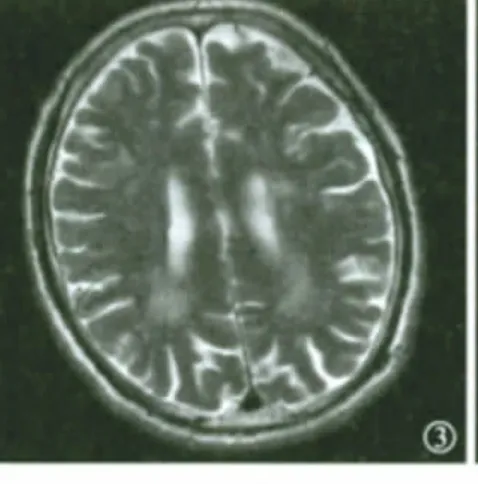
图3 RAⅡ型患者MRI T2加权像显示侧脑室旁部分高信号病灶融合
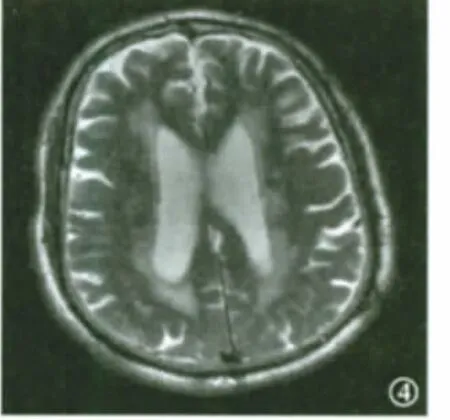
图4 RAⅢ及Ⅳ型患者MRI T2加权像显示侧脑室旁不规则高信号,延伸到深部白质,病变大面积融合,侧脑室扩大
3 讨论
SVD在脑血管病患者较常见,因其病变常发生在非功能区的腔隙性脑梗死而被人们所忽视。目前认为LA是SVD的影像学表现之一,其与认知功能减退、步态失常、排尿不稳定等密切相关,严重影响患者生活功能[2]。LA病理机制表现为髓鞘苍白、血管周围间隙扩大、脑梗死、胶质细胞增生、轴突缺失等[3],而且与随后发生的脑梗死、痴呆、死亡密切相关[4]。近年来发现,RA与SVD存在相关性[5]。视网膜血管与脑内前循环供血系统同属于颈内动脉分支,在胚胎起源、血管口径、功能上与脑小血管相似[1],在一定程度上能反映脑小血管情况。
本研究发现LA的年龄、高血压、颈动脉病变以及RA等情况与对照组间比较存在统计学差异。年龄相关的SVD主要表现脑动脉硬化和淀粉样血管病,而高血压常引起小血管病变,这些因素导致血管内皮病变,引起血-脑屏障通透性增加,血浆、蛋白渗出,小动脉壁、血管周围组织、神经元、胶质细胞破坏,血管管腔狭窄,导致血流量减少[6],从而促进了LA的发展。大动脉粥样硬化可能与LA相关,尤其是颈动脉增厚、硬化狭窄,可能因加重了脑血流低灌注,长期慢性缺血导致白质损害[7]。而相比之下,RA与LA的关联性较强,原因可能有以下两点:(1)RA是全身小血管病的一部分,它的结构和功能的改变,可以直接反映小血管病变的情况;(2)年龄、高血压、颈动脉增厚、硬化狭窄等暴露因素对小血管的影响,与这些因素的严重程度、作用时间以及治疗或控制情况密切相关。Gons等通过弥散张量成像(DTI)研究发现,与健康对照比较,高血压患者脑白质区域已经出现了显微结构改变,而其中一些经过治疗的高血压患者可减少这一病变的风险[8]。而RA为这些因素对微血管的损害提供了佐证[9-11]。
视网膜血管征主要为动静脉口径比值减小、动脉局部狭窄、动脉交叉征及视网膜出血、渗出等。高血压常导致血管平滑肌和内皮细胞坏死,是引起视网膜动脉狭窄的主要原因[9]。严重的内皮细胞破坏使血-眼屏障崩解,从而出现视网膜出血、渗出等征象[10]。而Baleanu等也发现视网膜血管动静脉比值下降与颈动脉中内膜增厚相关[11]。本研究发现,RA严重程度分型与LA的Fazekas评分呈正相关性。Liu等报道了眼底血管病在伴有皮质下梗死和白质脑病的常染色体显性遗传性脑动脉病(CADASIL)患者中较常见,动静脉比值下降程度与患者白质高信号范围大小呈正相关[12]。动静脉比值下降包括动脉变细和静脉扩张,目前一些学者研究发现,视网膜静脉扩张与血管内皮功能障碍、炎性反应、脑组织缺氧更加密切[13],因此还有待进一步研究。张东平等也研究证实白质疏松与眼底血管病独立相关,眼底血管病变在一定程度上能够反映白质疏松的存在及严重程度[14]。一般认为,一些严重的视网膜血管病包括小动脉瘤、出血、渗出,与LA关系较密切,但Qiu等发现,小动脉瘤、出血与LA无关,而小动脉局部狭窄与LA关系密切[15]。在本研究中,视网膜出血、渗出的患者多数存在动脉狭窄,不能得出相关结论。另外,根据日本学者提出的张力血管学说,脑内穿支动脉、视网膜动脉均为张力血管,是直接由血压较高的较大的血管分出,血压的变化常导致这些血管的损害,也进一步解释了RA与SVD之间的相关性。
总之,RA与LA密切相关,且LA随着RA加重而加重。因此眼底检查作为一种非侵入性的检查工具,对评价微血管系统的病理生理具有重要的意义[13]。
[1]Doubal FN,MacGillivray TJ,Hokke PE,et al.Differences in retinal vessels support a distinct vasculopathy causing lacunar stroke[J].Neurology,2009,72(20):1773-1778.
[2]De Leeuw FE,de Groot JC,Achten E,et al.Prevalence of cerebral white matter lesions in elderly people:apopulation based magnetic resonance imaging study.The Rotterdam Scan Study[J].Neurol Neurosurg Psychiatry,2001,70(1):9-14.
[3]Fazekas F,Kleinert R,Offenbacher H,et al.Pathologic correlates of incidental MRI white matter signal hyperintensities[J].Neurology,1993,43(9):1683-1689.
[4]Debette S,Markus HS.The clinical importance of white matter hyperintensities on brain magnetic resonance imaging:systematic review and meta-analysis[J].BMJ,2010,341:c3666.
[5]Lindley RI,Wang JJ,Wong MC,et al.Retinal microvasculature in acute lacunar stroke:a cross-sectional study[J].Lancet Neurol,2009,8(7):628-634.
[6]Arboix A.Retinal microvasculature in acute lacunar stroke[J].Lancet Neurol,2009,8(7):596-598.
[7]Grueter BE,Schulz UG.Age-related cerebral white matter disease(leukoaraiosis):a review[J].Postgrad Med,2012,88(1036):79-87.
[8]Gons RA,de Laat KF,van Norden AG,et al.Hypertension and cerebral diffusion tensor imaging in small vessel disease[J].Stroke,2010,41(12):2801-2806.
[9]Klein R,Klein BE,Moss SE.The relation of systemic hypertension to changes in the retinal vasculature:the Beaver Dam Eye Study[J].Trans Am Ophthalmol Soc,1997,95:329-348;discussion 348-350.
[10]Grosso A,Cheung N,Veglio F,et al.Similarities and differences in early retinal phenotypes in hypertension and diabetes[J].Hypertens,2011,29(9):1667-1675.
[11]Baleanu D,Ritt M,Harazny J,et al.Wall-to-lumen ratio of retinal arterioles and arteriole-to-venule ratio of retinal vessels in patients with cerebrovascular damage[J].Invest Ophthalmol Vis Sci,2009,50(9):4351-4359.
[12]Liu Y,Wu Y,Xie S,et al.Retinal arterial abnormalities correlate with brain white matter lesions in cerebral autosomal dominant arteriopathy with subcortical infarcts and leucoencephalopathy[J].Clin Exp Ophthalmol,2008,36(6):532-536.
[13]Liew G,Wang JJ,Mitchell P,et al.Retinal vascular imaging:a new tool in microvascular disease research[J].Circ Cardiovasc Imaging,2008,1(2):156-161.
[14]张东平,胡长林.脑白质疏松与视网膜微血管病变的相关性[J].中国老年医学杂志,2010,30(2):462-464.
[15]Qiu C,Cotch MF,Sigurdsson S,et al.Microvascular lesions in the brain and retina:The age,gene/environment susceptibility-Reykjavik study[J].Ann Neurol,2009,65(5):569-576.

